что такое изотопный индикатор
Изотопные индикаторы
Изот о пные индик а торы, вещества, имеющие отличный от природного изотопный состав и благодаря этому используемые в качестве метки при изучении самых разнообразных процессов. Роль изотопной метки выполняют стабильные или радиоактивные изотопы химических элементов, которые легко могут быть обнаружены и определены количественно. Высокая чувствительность и специфичность изотопных индикаторов позволяют проследить за ними в сложных процессах перемещения, распределения и превращения веществ в сколь угодно сложных системах, в том числе и в живых организмах.
Метод изотопных индикаторов (называется также методом меченых атомов) был впервые предложен Д. Хевеши и Ф. Панетом в 1913. Широкое использование изотопных индикаторов стало возможным благодаря развитию ядерной техники, позволившей получать изотопы в массовом масштабе.
Метод изотопных индикаторов основан на том, что химические свойства разных изотопов одного элемента почти одинаковы (благодаря чему поведение меченых атомов в изучаемых процессах практически не отличается от поведения других атомов того же элемента), и на лёгкости обнаружения изотопов, особенно радиоактивных. При использовании метода необходим учёт возможных реакций изотопного обмена, приводящих к перераспределению меченых атомов (следовательно, к потере соединением метки), а иногда и учёт радиационных эффектов, связанных с влиянием радиоактивных излучений на ход процесса. Изотоп, используемый в качестве метки, вводится в состав изучаемых соединений. Могут быть использованы как стабильные, так и радиоактивные изотопы.
Преимущество стабильных изотопов — их устойчивость и отсутствие ядерных излучений. Однако только небольшое число элементов имеет подходящие стабильные изотопы. Малая доступность последних и сравнительно сложная техника обнаружения составляют недостатки метода изотопных индикаторов с применением стабильных изотопов. Преимущество радиоактивных изотопов — возможность их получения практически для всех элементов периодической системы, высокая чувствительность, специфичность и точность определения, простота и доступность измерительной аппаратуры. Поэтому большинство исследований, использующих метод изотопных индикаторов, выполнено с радиоактивными изотопами.
Такие элементы, как водород, углерод, сера, хлор, свинец, имеют удобные для использования как стабильные — 2 H, 13 C, 34 S, 35 Cl, 37 Cl, 204 РЬ, так и радиоактивные изотопы — 3 H, 11 C, 14 C, 35 S, 36 C1, 212 РЬ. В качестве изотопов азота и кислорода чаще всего применяются стабильные 15 N и 18 O и другие. Стабильные изотопные индикаторы получают обогащением природных изотопных смесей путём многократного повторения операции разделения (перегонка, диффузия, термодиффузия, изотопный обмен, электролиз; см. Изотопов разделение), а также на масс-спектрометрических установках и при ядерных реакциях.
Для элементов, существующих в природе в виде одного изотопа (Be, F, Na, Al, P, I), в качестве меченых атомов используют только искусственные радиоактивные изотопы; примером часто применяемых радиоактивных изотопов служат 3 H, 14 C, 32 P, 35 S, 45 Ca, 51 Cr, 59 Fe, 60 Co, 89 Sr, 95 Nb, 110 Ag, 131 I и др. Выбор радиоактивного изотопа определяется его ядерными характеристиками — периодом полураспада, типом и энергией излучения. Для индикации пригодны радиоактивные изотопы, период полураспада которых не очень мал, что позволяет работать в течение времени, необходимого для эксперимента, но и не очень велик, что даёт возможность работать с весьма малыми количествами индикатора.
Известны различные способы синтеза меченых соединений. Наряду с обычным химическим синтезом используются реакции изотопного обмена и биологический синтез. В большинстве случаев изотопная метка занимает определённое положение в молекуле; например, пропионовую кислоту можно пометить по углероду тремя способами: 14 CH3CH2COOH, СН3 14 СН2СООН, СН3СН2 14 СООН.
Имеются три основных направления использования изотопных индикаторов. Методом изотопных индикаторов изучают характер распределения веществ и пути их перемещения. Изотопные индикаторы вводят в ту или иную систему и через определённые промежутки времени устанавливают наличие изотопных индикаторов в различных частях системы. Наиболее наглядные картины распределения получаются без разрушения образца при помощи радиоавтограмм (см. Авторадиография).
Другое направление использования изотопных индикаторов — количественный анализ. Один из самых простых и распространённых вариантов метода изотопных индикаторов — метод изотопного разбавления, при котором к анализируемому веществу добавляют дозированное количество изотопного индикатора и по степени его разбавления судят об исходном количестве вещества. Этот метод позволяет производить определение ничтожно малых количеств трудноопределяемых веществ и, наоборот, больших масс веществ; анализировать сложные смеси, анализ и разделение которых другими методами невозможны. Широкими возможностями отличается примыкающий к методу изотопных индикаторов активационный анализ, где меткой служит изотоп другого элемента, образованный из данного в результате ядерной реакции. Особенно большое значение этот метод имеет при определении микроэлементов в металлах, сплавах, минералах, тканях, при быстром контроле технологических процессов. Количественный анализ природных изотопов, входящих в естественные радиоактивные ряды урана и тория, а также количественное определение изотопа 14 C в умерших организмах позволяют определять возраст горных пород и археологических находок.
Третьим направлением использования изотопных индикаторов является выяснение механизма различных процессов и изучение строения химических соединений. Введение изотопной метки в определённое положение молекулы устраняет химическую неразличимость атомов, допуская возможность однозначного выяснения механизма тех или иных реакций, для которых обычные химические методы описывают только начальное и конечное состояния.
Все указанные направления применения изотопных индикаторов широко представлены в различных областях химии, биологии, медицины, техники, сельского хозяйства и т. д. Ниже приводятся отдельные примеры их использования.
Лит.: Радиоактивные изотопы в химических исследованиях, Л. — М., 1965; Рогинский С. З., Теоретические основы изотопных методов изучения химических реакций, М., 1956; Ядернофизические методы анализа веществ, М., 1971 (Всесоюзная научно-техническая конференция «XX лет производства и применения изотопов и источников ядерных излучений в народном хозяйстве СССР», Минск, 1968).
В биологии изотопные индикаторы применяют для решения как фундаментальных, так и прикладных биологических проблем, изучение которых другими методами затруднено или невозможно. Существенное для биологии преимущество метода меченых атомов состоит в том, что использование изотопных индикаторов не нарушает целостности организма и его основных жизненных отправлений. С применением изотопных индикаторов связаны многие крупные достижения современной биологии, определившие расцвет биологических наук во 2-й половине 20 в. С помощью стабильных и радиоактивных изотопов водорода ( 2 H и 3 H), углерода ( 13 C и 14 C), азота ( 15 N), кислорода ( 18 O), фосфора ( 32 P), серы ( 35 S), железа ( 59 Fe), йода ( 131 I) и др. были выяснены и детально изучены сложные и взаимосвязанные процессы биосинтеза и распада белков, нуклеиновых кислот, углеводов, жиров и др. биологически активных соединений, а также химические механизмы их превращений в живой клетке (рис. 1 — 3). Применение изотопных индикаторов привело к пересмотру прежних представлений о природе фотосинтеза, а также о механизмах, обеспечивающих усвоение растениями неорганических веществ — карбонатов, нитратов, фосфатов и др.
С помощью изотопных индикаторов выполнено огромное число исследований в самых разнообразных направлениях биологии и биохимии. Одно из направлений включает работы по изучению динамики и путей перемещения популяций в биосфере и отдельных особей внутри данной популяции, миграции микробов, а также отдельных соединений внутри организма. Вводя в организмы с пищей или путём инъекций метку, удалось изучить скорость и пути миграции многих насекомых (москитов, мух, саранчи), птиц, грызунов и др. мелких животных и получить данные о численности их популяций. В области физиологии и биохимии растений с помощью изотопных индикаторов решен ряд теоретических и прикладных проблем: выяснены пути поступления минеральных веществ, жидкостей и газов в растения, а также роль различных химических элементов, в том числе микроэлементов, в жизни растений (рис. 4). Показано, в частности, что углерод поступает в растения не только через листья, но и через корневую систему, установлены пути и скорости передвижения ряда веществ из корневой системы в стебель и листья и из этих органов к корням. В области физиологии и биохимии животных и человека изучены скорости поступления различных веществ в их ткани (в том числе скорость включения железа в гемоглобин, фосфора — в нервную и мышечные ткани, кальция — в кости).
Важная группа работ охватывает исследования механизмов химических реакций в организме. Так, во многих случаях удалось установить связь между исходными и вновь образующимися молекулами, проследить за «судьбой» отдельных атомов и химических групп в процессах обмена веществ, а также выяснить последовательность и скорость этих превращений. Полученные данные сыграли решающую роль при построении современных схем биосинтеза и метаболизма (метаболических карт), путей превращения пищи, лекарственных препаратов и ядов в живых организмах. К работам этой группы относится выяснение вопроса о происхождении кислорода, выделяемого в процессе фотосинтеза: оказалось, что его источником является вода, а не двуокись углерода. С другой стороны, применение 14 CO2 позволило выяснить пути превращений двуокиси углерода в процессе фотосинтеза. Использование «меченой» пищи привело к новому представлению о скоростях всасывания и распространения пищевых веществ, об их «судьбе» в организме и помогло проследить за влиянием внутренних и внешних факторов (голодание, асфиксия, переутомление и т. д.) на обмен веществ. Метод изотопных индикаторов позволил изучить процессы обратимого транспорта веществ через биологические мембраны. Было показано, что концентрации веществ по обе стороны мембраны остаются постоянными с сохранением градиентов концентрации, характерных для каждой из разделённых мембранами сред.
Метод изотопных индикаторов нашёл применение в исследовании процессов, решающую роль в которых играет передача информации в организме (проводимость нервных импульсов, инициация и рецепция раздражения и др.) Эффективность метода изотопных индикаторов в работах этого рода обусловлена тем, что исследования проводятся на целостных, интактных организмах, сохраняющих неповрежденной всю сложную систему нервных и гуморальных связей. Наконец, группа работ включает исследования статических характеристик биологических структур, начиная с молекулярного уровня (белки, нуклеиновые кислоты) и кончая надмолекулярными структурами (рибосомы, хромосомы и др. органеллы). Например, исследования относительной устойчивости белков и нуклеиновых кислот в 1 H2O, 2 H2O и в H2 18 O способствовали выяснению природы сил, стабилизирующих структуру биополимеров, в частности роли водородных связей в биологических системах.
Важное значение при выборе изотопа имеет вопрос о чувствительности метода изотопного анализа, а также о типе радиоактивного распада и энергии излучения. Преимущество стабильных изотопов ( 2 H, 18 O, 15 N и др.) — отсутствие излучений, часто оказывающих побочное воздействие на исследуемую живую систему. В то же время, сравнительно низкая чувствительность методов их определений (масс-спектроскопия, денситометрия), а также необходимость выделения меченого соединения ограничивают применение стабильных изотопов в биологии. Высокая чувствительность регистрации гамма-активных изотопов ( 59 Fe, 131 I и др.) позволила в живом организме измерить скорость кроветока, определить количество крови и время её полного кругооборота, исследовать работу желёз внутренней секреции.
Лит.: Камен М., Радиоактивные индикаторы в биологии, пер. с англ., М., 1948; Хевеши Г., Радиоактивные индикаторы, их применение в биохимии, нормальной физиологии и патологической физиологии человека и животных, пер. с англ., М., 1950; Метод меченных атомов в биологии, Изотопы в биохимии, М., 1963; Ванг Ч., Уиллис Д., Радиоиндикаторный метод в биологии, пер. с англ., М., 1969; Радиоактивные изотопы во внешней среде и организме, М., 1970.
Изотопные индикаторы в медицине. С помощью изотопных индикаторов были раскрыты механизмы развития (патогенез) ряда заболеваний; их применяют также для изучения обмена веществ и диагностики многих заболеваний (см. Радиоизотопная диагностика). Изотопные индикаторы вводят в организм в крайне малых количествах, не способных вызвать какие-либо патологические сдвиги. Различные элементы неравномерно распределяются в организме. Аналогично им распределяются и изотопные индикаторы. Излучение, возникающее при распаде изотопа, регистрируют радиометрическими приборами, скенированием, авторадиографией и др. Так, состояние большого и малого круга кровообращения, сердечного кровообращения, скорости кроветока, изображение полостей сердца определяют с помощью соединений, включающих 24 Na, 131 I, 99M Tc; для изучения лёгочной вентиляции и заболеваний спинного мозга применяют 99M Tc, 133 Xe; макроагрегаты альбумина человеческой сыворотки с 131 I используют для диагностики различных воспалительных процессов в легких, их опухолей и при различных заболеваниях щитовидной железы. Концентрационную и выделительную функции печени изучают при помощи краски бенгал-роз с 131 I, 198 Au; функцию почек — при ренографии c 131 I-гиппураном и скенированием после введения неогидрина, меченого 203 Hg или 99M Tc. Изображение кишечника, желудка получают, используя 99M Tc, селезёнки — применяя эритроциты с 99M Tc или 51 Сr; с помощью 75 Se диагностируют заболевания поджелудочной железы. Диагностическое применение имеют также 85 Sr и 85 P.
Изотопные индикаторы в сельском хозяйстве ( 3 H, 14 C, 22 Na, 32 P, 35 S, 42 K, 45 Ca, 60 Co, 65 Zn, 99 Mo и др.) широко используются для определения физических свойств почвы и запасов в ней элементов пищи растений, для изучения взаимодействия почвы и удобрений, процессов усвоения растениями питательных элементов из минеральных туков, поступления в растения минеральной пищи через листья и других вопросов почвоведения и агрохимии. Пользуются изотопными индикаторами для выявления действия на растительный организм пестицидов, в частности гербицидов, что позволяет установить концентрацию и сроки обработки ими посевов. Применяя метод изотопных индикаторов, исследуют важнейшие биологические свойства с.-х. культур (при оценке и отборе селекционного материала) — урожайность, скороспелость, хладостойкость. В животноводстве изучают физиологические процессы, протекающие в организме животных, проводят анализ кормов на содержание токсичных веществ (малые дозы которых трудно определить химическими методами) и микроэлементов. При помощи изотопных индикаторов разрабатывают приёмы автоматизации производственных процессов, например отделение корнеклубнеплодов от камней и комков почвы при уборке комбайном на каменистых и тяжёлых почвах.
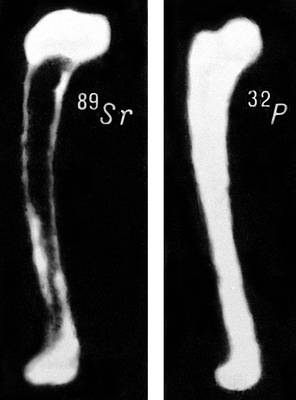
Рис. 1. Отложение радиоактивных изотопов стронция и фосфора в костях: 89 Sr откладывается преимущественно в самой кости, 32 P — в костном мозге.
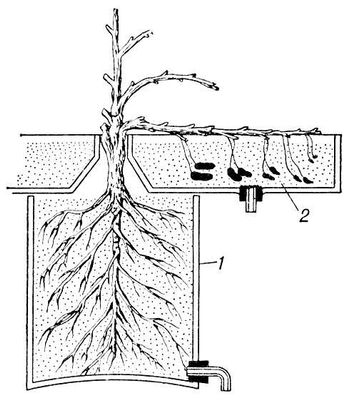
Рис. 4. Схема опыта по изучению поглощения радиоактивных изотопов раздельно корнями и плодами арахиса: 1 — среда для корней; 2 — среда для плодов.
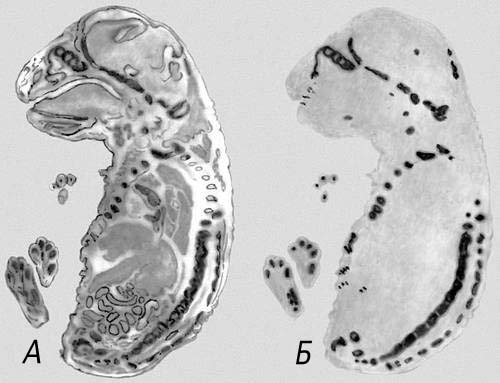
Рис. 3. Избирательное накопление радиоизотопа серы ( 35 S) в хрящевой ткани 20-дневного зародыша крысы: А — окрашенный срез; Б — радиоавтограф.
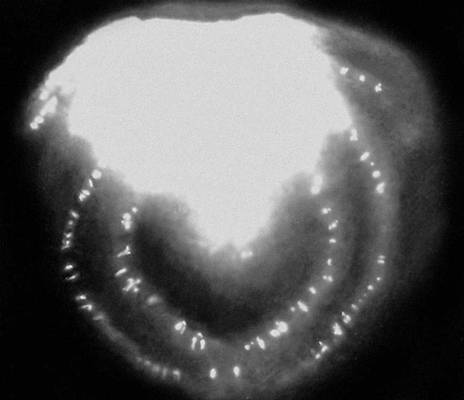
Рис. 2. Распределение радиоизотопа фосфора ( 32 P) на поперечном срезе сахарной свёклы при нанесении изотопа на один из листьев растения.
ИЗОТОПНЫЕ ИНДИКАТОРЫ
Полезное
Смотреть что такое «ИЗОТОПНЫЕ ИНДИКАТОРЫ» в других словарях:
ИЗОТОПНЫЕ ИНДИКАТОРЫ — ИЗОТОПНЫЕ ИНДИКАТОРЫ, то же, что меченые атомы … Современная энциклопедия
ИЗОТОПНЫЕ ИНДИКАТОРЫ — (меченые атомы) радиоактивные (реже стабильные) нуклиды, которые используются в составе простых или сложных веществ для изучения химического, биологического и других процессов с помощью специальных методов (напр., масс спектрометрия, радиометрия) … Большой Энциклопедический словарь
ИЗОТОПНЫЕ ИНДИКАТОРЫ — (меченые атомы), вещества, имеющие отличный от природного изотопный состав, используемые в кач ве «метки» при исследовании разл. процессов (в т. ч. в живом организме). Метод И. и. был предложен венг. радиохимиком Д. Хевеши и нем. химиком Ф.… … Физическая энциклопедия
Изотопные индикаторы — ИЗОТОПНЫЕ ИНДИКАТОРЫ, то же, что меченые атомы. … Иллюстрированный энциклопедический словарь
изотопные индикаторы — (меченые атомы), радиоактивные (реже стабильные) нуклиды, которые используются в составе меченых соединений для изучения химических, биологических и других процессов с помощью специальных методов (например, масс спектрометрия, радиометрия). * * * … Энциклопедический словарь
Изотопные индикаторы — Меченые атомы (изотопные индикаторы) содержат изотопы, которые по своим свойствам (радиоактивности, атомной массе) отличаются от других изотопов данного элемента. Их добавляют к химическому соединению или смеси, где находится исследуемый элемент; … Википедия
Изотопные индикаторы — вещества, имеющие отличный от природного изотопный состав и благодаря этому используемые в качестве метки при изучении самых разнообразных процессов. Роль изотопной метки выполняют стабильные или радиоактивные Изотопы химических элементов … Большая советская энциклопедия
ИЗОТОПНЫЕ ИНДИКАТОРЫ — меченые атомы, радиоактивные или стабильные атомы, к рые отсутствуют в природной изотопной смеси к. л. элемента и легко могут быть обнаружены и определены количественно. Примером часто используемых стабильных изотопов служат 2Н(дейтерий), 13 С,… … Большой энциклопедический политехнический словарь
ИЗОТОПНЫЕ ИНДИКАТОРЫ — (меченые атомы), радиоактивные (реже стабильные) нуклиды, к рые используются в составе меченых соединений для изучения хим., биол. и др. процессов с помощью спец. методов (напр., масс спектрометрия, радиометрия) … Естествознание. Энциклопедический словарь
Примером использования изотопного мечения является исследование фенола (C 6 H 5 OH) в воде путем замены обычного водорода ( протия ) дейтерием ( мечение дейтерием ). При добавлении фенола к дейтерированной воде (вода, содержащая D 2 O в дополнение к обычной H 2 O), в гидроксильной группе фенола наблюдается замещение дейтерия на водород (что приводит к C 6 H 5 OD), что указывает на то, что фенол легко подвергается реакции водородообмена с водой. Затрагивается только гидроксильная группа, что указывает на то, что другие 5 атомов водорода не участвуют в реакциях обмена.
СОДЕРЖАНИЕ
Изотопный индикатор
Маркировка стабильных изотопов
Анализ метаболического потока с использованием метки стабильных изотопов
Методы измерения изотопной маркировки
Протонный ЯМР был первым методом, использованным в экспериментах по мечению 13 C. Используя этот метод, каждое отдельное положение протонированного углерода внутри определенного пула метаболитов можно наблюдать отдельно от других положений. Это позволяет узнать процентное соотношение изотопомеров, меченных в этом конкретном положении. Предел протонного ЯМР состоит в том, что если в метаболите n атомов углерода, может быть не более n различных значений позиционного обогащения, что составляет лишь небольшую часть общей информации об изотопомерах. Хотя использование протонного ЯМР-мечения ограничено, эксперименты с чистым протонным ЯМР намного легче оценить, чем эксперименты с большим количеством информации об изотопомерах.
В дополнение к протонному ЯМР использование методов 13 C ЯМР позволит получить более подробное представление о распределении изотопомеров. Меченый атом углерода будет производить различные сигналы сверхтонкого расщепления в зависимости от состояния метки его прямых соседей в молекуле. Если соседние атомы углерода не помечены, появляется синглетный пик. Дублетный пик появляется, если помечен только один соседний атом углерода. Размер дублетного расщепления зависит от функциональной группы соседнего атома углерода. Если помечены два соседних атома углерода, дублет дублетов может выродиться в триплет, если расщепления дублетов равны.
Недостатками использования методов ЯМР для анализа метаболических потоков является то, что он отличается от других приложений ЯМР, поскольку это довольно специализированная дисциплина. ЯМР-спектрометр может быть доступен не всем исследовательским группам. Оптимизация параметров измерения ЯМР и надлежащий анализ структуры пиков требует наличия квалифицированного специалиста по ЯМР. Для некоторых метаболитов также могут потребоваться специальные процедуры измерения для получения дополнительных данных по изотопомеру. Кроме того, необходимы специально адаптированные программные инструменты для определения точного количества площадей пиков, а также для определения разложения запутанных синглетных, дублетных и триплетных пиков.
В газовой хроматографии-масс-спектрометрии ( ГХ-МС ) МС соединяют с газовым хроматографом для разделения соединений гидролизата. Затем соединения, элюирующие из колонки для ГХ, ионизируются и одновременно фрагментируются. Преимущество использования ГХ-МС заключается в том, что измеряются не только массовые изотопомеры молекулярного иона, но также массовый спектр изотопомеров нескольких фрагментов, что значительно увеличивает измеряемую информацию.
В жидкостной хроматографии-масс-спектрометрии ( ЖХ-МС ) ГХ заменяется жидкостным хроматографом. Основное отличие состоит в том, что химическая дериватизация не требуется. Однако применения ЖХ-МС к MFA редки.
В каждом случае приборы MS делят конкретное распределение изотопомера по его молекулярной массе. Все изотопомеры конкретного метаболита, содержащие одинаковое количество меченых атомов углерода, собираются в один пиковый сигнал. Поскольку каждый изотопомер вносит вклад в ровно один пик в спектре МС, процентное значение затем может быть вычислено для каждого пика, давая массовую долю изотопомера. Для метаболита с n атомами углерода производится n + 1 измерение. После нормализации остается ровно n информативных массовых количеств изотопомеров.
Кроме того, наблюдаемые сильные изотопные эффекты влияют на время удерживания изотопомеров, меченных по-разному, в колонке для ГХ. Также необходимо предотвратить перегрузку колонки ГХ.
Наконец, естественное изобилие других атомов, помимо углерода, также приводит к нарушению массового спектра изотопомеров. Например, каждый атом кислорода в молекуле может также присутствовать как изотоп 17 O и как изотоп 18 O. Более значительным влиянием естественного изотопов изотопов является влияние кремния с естественным содержанием изотопов 29 Si и 30 Si. Si используется в дериватизирующих агентах для методов МС.
Приложения в исследованиях минерального питания человека
Изучаемые аспекты минерального питания / метаболизма включают всасывание (из желудочно-кишечного тракта в организм), распределение, хранение, выведение и кинетику этих процессов. Изотопные индикаторы вводятся субъектам перорально (с пищей или без нее или с минеральной добавкой) и / или внутривенно. Затем измеряется содержание изотопов в плазме крови, эритроцитах, моче и / или кале. Обогащение также измерялось в грудном молоке и содержимом кишечника. Дизайн экспериментов с индикаторами иногда отличается для разных минералов из-за различий в их метаболизме. Например, абсорбция железа обычно определяется по включению индикатора в эритроциты, тогда как абсорбция цинка или кальция измеряется по появлению индикатора в плазме, моче или кале. Введение нескольких изотопных индикаторов в одном исследовании является обычным делом, что позволяет использовать более надежные методы измерения и одновременное исследование нескольких аспектов метаболизма.
В связи с распространением дефицита полезных ископаемых и их критическим воздействием на здоровье и благополучие людей в странах с ограниченными ресурсами Международное агентство по атомной энергии недавно опубликовало подробные и всеобъемлющие описания методов стабильных изотопов, чтобы облегчить распространение этих знаний среди исследователей за пределами страны. западные академические центры.
Радиоизотопная маркировка
Строго говоря, радиоизотопная маркировка включает только те случаи, когда радиоактивность искусственно вводится экспериментаторами, но некоторые природные явления позволяют проводить аналогичный анализ. В частности, радиометрическое датирование использует тесно связанный принцип.
Приложения в протеомике
Приложения для анализа экосистемных процессов
Приложения для океанографии
Трассеры также широко используются в океанографии для изучения широкого круга процессов. Используемые изотопы обычно встречаются в природе с хорошо установленными источниками и скоростями образования и распада. Однако антропогенные изотопы также могут использоваться с большим успехом. Исследователи измеряют изотопные отношения в разных местах и в разное время, чтобы получить информацию о физических процессах в океане.
Перенос частиц
Океан представляет собой разветвленную сеть переноса частиц. Изотопы тория могут помочь исследователям расшифровать вертикальное и горизонтальное движение вещества. 234 Th имеет постоянную четко определенную скорость производства в океане и период полураспада 24 дня. Было показано, что этот встречающийся в природе изотоп изменяется линейно с глубиной. Следовательно, любые изменения этой линейной картины можно объяснить переносом 234 Th на частицах. Например, низкие отношения изотопов в поверхностных водах с очень высокими значениями на несколько метров ниже будут указывать на вертикальный поток в нисходящем направлении. Кроме того, изотоп тория можно проследить на определенной глубине, чтобы расшифровать боковой перенос частиц.
Тираж
Циркуляция в местных системах, таких как заливы, устья и подземные воды, может быть исследована с помощью изотопов радия. 223 Ra имеет период полураспада 11 дней и может естественным образом встречаться в определенных местах в реках и источниках подземных вод. Изотопное соотношение радия затем будет уменьшаться по мере того, как вода из исходной реки входит в залив или эстуарий. Измеряя количество 223 Ra в нескольких различных местах, можно расшифровать картину циркуляции. Тот же самый процесс можно использовать для изучения движения и разгрузки грунтовых вод.
Для изучения циркуляции в глобальном масштабе можно использовать различные изотопы свинца. Разные океаны (например, Атлантический, Тихий, Индийский и т. Д.) Имеют разные изотопные сигнатуры. Это происходит из-за различий в изотопных соотношениях отложений и горных пород в разных океанах. Поскольку разные изотопы свинца имеют период полураспада 50–200 лет, не хватает времени для гомогенизации изотопных соотношений во всем океане. Таким образом, точный анализ изотопных соотношений Pb может быть использован для изучения циркуляции различных океанов.
Тектонические процессы и изменение климата
Изотопы с чрезвычайно длительным периодом полураспада и продукты их распада могут быть использованы для изучения многомиллионных летних процессов, таких как тектоника и экстремальное изменение климата. Например, при датировании рубидий-стронций изотопное отношение стронция ( 87 Sr / 86 Sr) может быть проанализировано в ледяных кернах для изучения изменений на протяжении всей жизни Земли. Различия в этом соотношении в ледяном керне указывают на значительные изменения в геохимии Земли.