Цитокератин 7 что это
Цитокератин 7 что это
Из большого числа исследованных раковых опухолей различного гистогенеза, локализации, степени дифференцировки в них обнаружены только цитокератины, исключение составили плейоморфные аденомы околоушной слюнной железы и рак почки. Только в двух указанных опухолях, кроме цитокератинов, в клетках найден также виметин, причем в некоторых опухолевых клетках этих новообразований цитокератнн и виметин обнаруживаются одно временно.
Объяснение этой особенности опухолевых клеток следует искать в эмбриогенезе органов, в которых они возникают. Почка, как известно, развивается из мезодермы, клетки которой содержат промежуточные волокна, построенные из виметниа, однако в процессе детерминации и дивергентной дифференцировки нефрогеиные клетки мезодермального происхождения приобретают эпителиальные свойства и соответственно происходит перестройка промежуточных волокон, которые теперь состоят из цитокератнна. Однако способность синтезировать виметин при определенных условиях, очевидно, в них сохраняется, что и происходит в раковых клетках. Переключение с синтеза цитокератнна на синтез виметина наблюдается в мезотелиальных клетках в условиях редкой культуры, при формировании в культуре плотного слоя, мезотелий вновь начинает синтезировать цитокератнн. Таким образом, это исключение только подтверждает правило о специфичности белков промежуточных волокон для определенных тканей и сохранности этой специфичности в опухолевых клетках.
Использование белков промежуточных волокон в качестве иммуногистохимических маркеров определенных типов клеток открывает широкие перспективы для дифференциальной диагностики опухолей человека, изучение их гистогенеза, механизмов дифференцировки опухолевых клеток, определения нивазивного роста и решения других вопросов.
Сохранность в опухолевых клетках промежуточных волокон, характерных для соответствующих нормальных клеток, свидетельствует о способности опухолевых клеток к специфической дифференцировке в виде образования этих структур, ответственных за определенный объем морфогенетических потенций клеток, в частности за взаимодействие клеток друг с другом. Нарушение этого механизма межклеточных взаимодействий в процессе малигнизации, очевидно, не является обязательным. Однако в новообразовакнях он полностью не реализуется, так как опухолевые клетки никогда в полной мере не образуют полноценную ткань или орган.
Дифференцировочные антигены клеточной мембраны. Антигенные свойства клеточных мембран и главным образом поверхности клеток в процессе клеточной дифференцировки претерпевают определенные изменения.
Благодаря созданию гибридов и моноклональных антител мембранные дифференцнровочные антигены были детально изучены в нормальных кроветворных клетках, при лейкозе и лимфомах см обзоры Г И. Абелев (1982), А Ю Барышников (1984).
Так, например, нормальные клетки-предшественники лимфо-, миело- и эритропоэза н клетки при некоторых острых лимфатических лейкозах содержат на поверхности одинаковый антиген — так называемый общий антиген острых лимфатических лейкозов (CALL) и Ia-подобный антиген.
При дальнейшей дифференцнровке клеток-предшественников, например лимфопоэза и образовании В- и Т-лимфоцитов, антиген CALL в иих исчезает и появляются другие антигены, характерные для пре-В-лимфоцитов (цнтоплаз-матнческий антиген с lgM и остающийся мембранный — la-подобный), для В-лимфоцитов (Ig, относящийся к М- и D-классам, н la-подобный антиген), для ранних Т-лимфоцитов (тимуслейкемический антиген — HTLA, антиген эритроцитов барана), для зрелых Т-лимфоцитов (антигены МАТ ОКТ-1, МАТ Leu-i, МАТ ОКТ-3). Здесь упомянуты лишь отдельные антигены клеток лимфоцитарного ряда. В действительности для каждой стадия созревания и типа лимфоцитов характерен свой определенный набор поверхностных и цитоплазматическнх антигенов. Конкретные наборы антигенов определены и для различных стадий созревания клеток миело-, моио- и эритроцитарного ряда.
Следует особенно подчеркнуть, что в лейкозных и лимфосаркоматозкых клетках практически сохраняются антигенные свойства (наборы антигенов), характерные для соответствующих стадий созревания и типов нормальных клеток гемопоэза. Именно это свойство опухолевых клеток, связанное с их способностью воспроизводить антигенную структуру своих нормальных аналогов, послужило основой для иммунологической классификации морфологически н гнстохимически однородных лейкозов и возможности выделения из них групп с различным клиническим течением, прогнозом, чувствительностью к химиотерапии.
Дифференцнровочные антигены мембран играют разиообразую и важную роль в процессах днфференцировки и функционирования клеток. Например, Ia-подобиые антнгены участвуют в реакциях гистосовместимости, контролируют межклеточные взаимодействия, иммунный ответ, чувствительность к ряду заболеваний, пролиферацию предшественников гемопоэтических клеток. Одни антигены Т-лимфоцитов обусловливают их цитотоксическое и иммуносупресснвное действие, другие — хелперную и индуцирующую активность и т. д.
Существует распространенное мнение о том, что популяция клеток прилейкозах является гомогенной, так как клетки «заморожены» на определенной стадии дифференцировки. Однако имеются примеры, свидетельствующие о том, что популяция клеток при лейкозах может быть гетерогенной как по степени дифференцировки клеток, так н по ее направлению. Особенно четко гетерогенность лейкозных клеток видна при электронно-микроскопическом исследовании. Оно позволяет выявить, например, при остром миелобластиом лейкозе наряду с бластными клетками лейкозные клетки типа оромнелоцитов, мнелоцнтов, метамнелоцитов и даже сегментированных нейтрофилов. Та же картина наблюдается и при других формах лейкозов. В целом эти данные указывают на способность недифференцированных лейкозных клеток к специфической днфференцировке. Иногда встречаются лейкозы, в которых опухолевые клетки представлены разными типами дифференцировки элементами и миелоидного, и лимфоидного н эритрондного ряда. Способность лейкозных клеток к специфической днфференцировке в различных направлениях и возможное образование вследствие этого гетерогенной клеточной популяции может найти свое объяснение с тех позиций о гистогенезе опухолей, которые изложены выше. В определении гетерогенности популяции опухолевых клеток от уровня и направления дифференцировки важная роль принадлежит нммуногистохнмическим исследованиям на электронно-микроскопическом уровне.
Иммуногистохимическое выявление с помощью моноклональных антител дифференцировочных антигенов мембран опухолевых клеток — одно из перспективных направлений в диагностике, определении прогноза, гистогенеза, степени дифференцировки, лекарственной чувствительности, новообразований человека.
Цитокератин 7 что это
Нейроэндокринноклеточные опухоли (НЭО) – это разнородная группа новообразований, происходящих из нейроэндокринных клеток, способных к продукции гормонов и других веществ, обладающих биологически активными свойствами [1]. Научный интерес к проблеме нейроэндокринных новообразований возрастает с каждым годом. Эта тенденция во многом связана с увеличением частоты их обнаружения относительно опыта прошлых лет, что может быть обусловлено широким внедрением в практику современных методов диагностики, повышенной онкологической настороженностью, а также абсолютным стремительным ростом заболеваемости НЭО под влиянием изменяющихся факторов внешней среды в условиях урбанизации [2]. За последние 30 лет отмечается значительное увеличение числа новых зарегистрированных случаев заболеваемости НЭО всех локализаций [2; 3]. Так, на сегодняшний день заболеваемость НЭО составляет 5,25 случая НЭО на 1 миллион населения в год [4]. Хотя НЭО могут встречаться во всех органах, где есть нейроэндокринные клетки, большая часть из них приходится именно на желудочно-кишечный тракт (61%), и не менее 40% от этого количества составляют НЭО поджелудочной железы (ПЖ) [4; 5]. По данным литературы, последние выявляются с частотой 3-5 случаев на 1 млн населения в год [6]. Одна из главных проблем НЭО ПЖ в Российской Федерации сводится к отсутствию единого регистра этих опухолей, в связи с чем нет достоверных данных о заболеваемости ими в нашей стране [7].
Долгое время НЭО оставались предметом многочисленных дискуссий по поводу представлений об их истинной биологии. С 1907 года, после того как Oberndorfer ввел термин «карциноид», считалось, что НЭО имеют доброкачественную природу [8]. Однако благодаря развитию электронной микроскопии, иммуногистохимическим и молекулярно-биологическим методам исследования было установлено, что НЭО – это группа опухолей с неопределенным злокачественным потенциалом, способных в отдаленные сроки после операции рецидивировать и метастазировать [9]. Этот факт произвел настоящую революцию во взглядах ученых на проблему НЭО. Был сделан вывод, что, несмотря на сходные особенности в отношении морфологического строения, НЭО ЖКТ и ПЖ представляют собой гетерогенную группу, внутри которой существует множество различий как на клиническом уровне, так и на молекулярном. Данное обстоятельство определяет необходимость дифференцированного подхода к ведению пациентов с НЭО. Важное значение в диагностике НЭО ПЖ имеют морфологическое и иммуногистохимическое исследования, которые позволяют с высокой точностью установить потенциал злокачественности опухолей и на этом основании определить тактику лечения и сделать соответствующие прогнозы [9; 10].
Классификация НЭО ПЖ претерпела множество изменений, и в настоящее время рекомендовано использовать новую классификацию ВОЗ НЭО ПЖ от 2017 года, где основным фактором для определения злокачественности (Grade) также считается уровень индекса пролиферативной активности Ki-67 (Ki-67 ≤2 – G1, Ki-67 3–20% – G2, Ki-67 > 20% – G3), но новая концепция предполагает выделение высокодифференцированных НЭО ПЖ (G1, G2, G3), низкодифференцированных нейроэндокринных карцином (G3), в том числе их крупно- и мелкоклеточные варианты, смешанных карцином (MiNEN) [10]. Иммуногистохимический анализ, в свою очередь, позволяет подтвердить нейроэндокринную природу опухоли и уточнить ее гормональный статус.
Лечение НЭО ПЖ, как и их диагностика, требует мультидисциплинарного подхода. Это значит, что хирургическое лечение в иных случаях необходимо сочетать с химиотерапевтическими препаратами (особенно при низкодифференцированных карциномах) и препаратами из группы аналогов соматостатина. Применение последних является наиболее перспективным направлением в современной онкологии, но перед их назначением требуется иммуногистохимическое подтверждение экспрессии специфических рецепторов к соматостатину (SSTR2) на клетках опухоли [10]. В настоящее время нет достоверных данных о характере экспрессии данных рецепторов в различных органах и тканях, поэтому для изучения этого вопроса необходимы дальнейшие исследования с большими и репрезентативными выборками. Все вышеперечисленное обуславливает высокую актуальность проблемы НЭО ПЖ.
Цель исследования. Проанализировать иммунофенотипические особенности НЭО ПЖ, выраженность экспрессии диагностически значимых маркеров (Ki-67, синаптофизин, CD-56, NSE, Хромогранин А, CK-7, CK-18, CK-20, АЕ1/АЕ3) и оценить отдаленные результаты хирургического лечения.
Полученные результаты ИГХ-исследования экспрессии девяти маркеров представлены в таблице 1.
Характеристика экспрессии исследованных маркеров в образцах НЭО ПЖ
Cytokeratin 7
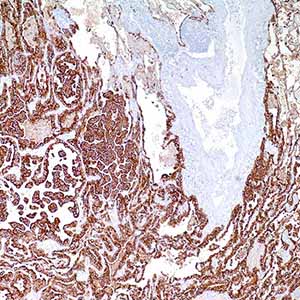
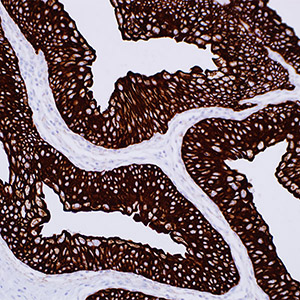
Антитело к цитокератину 7 вступает в реакцию с белками, которые обнаруживаются в большинстве эпителиальных клеток протоков, железистом и переходном эпителии мочевыводящих путей и эпителиальных клетках желчных протоков. Это антитело позволяет отличить эпителий лёгкого или молочной железы (положительное окрашивание) от эпителиальных клеток толстой кишки и предстательной железы (отрицательное окрашивание). Антитело к цитокератину 7 также вступает в реакцию со многими доброкачественными и злокачественными поражениями эпителия, такими как аденокарциномы яичника, молочной железы и лёгкого. Карциномы из переходных клеток положительны и рак предстальной железы отрицателен при окрашивании с использованием данных антител. Антитело к цитокератину 7 не взаимодействует с белками промежуточных филаментов.
Цена предоставляется по запросу
Наши преимущества:
Только качественные
официальные поставки
Минимально возможные
сроки поставок
Доставка по всей России с соблюдением температурного режима
Полный пакет документов
На данный момент мы сотрудничаем с ведущими зарубежными производителями лабораторных реактивов. Нашими клиентами являются как негосударственные, так и государственных учреждения, в том числе медицинские организации Москвы и других городов России. Для постоянных клиентов предусмотрена система скидок.
2003–2021 © ООО «Микротесты в биологии, медицине и ветеринарии». Официальный дистрибьютор ведущих производителей.
+7 (495) 969-98-26
Цитокератин 7 что это
Цитокератины – важные маркеры для классификации недифференцированных опухолей. В процессе злокачественной трансформации клеток экспрессия цитокератинов повышается. Каждому виду эпителиальных клеток с определенной локализацией соответствуют разные молекулярные формы цитокератинов. Низкомолекулярный цитокератин 20 экспрессируют высокодифференцированные «зонтичные» клетки поверхностного слоя уротелия. Определение содержания цитокератинов в моче позволяет проводить раннюю диагностику и мониторинг течения заболевания, дает возможность предсказать развитие метастазов и является надежным дополнительным показателем эффективного лечения болезни.
Какой биоматериал можно использовать для исследования?
Среднюю порцию утренней мочи.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Цитология мочи является простым скрининговым тестом, используемым для выявления и мониторинга рака мочевого пузыря. Несмотря на то что морфологические методы являются золотым стандартом, их чувствительность составляет около 40-80% и снижена при выявлении низкодифференцируемых опухолей. Одним из способов повышения диагностической ценности цитологии мочи является использование цитокератина 20 – для идентификации злокачественных клеток, выделенных в осадке мочи.
Достаточно долгое время цитокератин 20 применяют в диагностике различных злокачественных заболеваний в урологии. В некоторых исследованиях подчеркивается значимость цитокератина 20 как биомаркера карциномы переходных клеток мочевого пузыря (достигался высокий процент подтвержденных случаев карциномы переходных клеток мочевого пузыря – 86%). Помимо этого, в исследованиях подчеркивалась простота техники иммуноокрашивания, в сравнении с такими методами, как морфометрия и проточная цитометрия, а также высокая интенсивность окрашивания.
Несмотря на то что при цитологии осадка мочи не всегда удается определить вид опухоли, с использованием антитела цитокератина 20 в пробах мочи можно установить как факт простое наличие злокачественных клеток. Высокая ценность метода выявлена в случаях малого количества злокачественных клеток или большого количества затрудняющих исследование клеток воспаления в полученном образце.
Исследование повышает точность выявления интраэпителиальной неоплазии вместе с исследованием осадка мочи на атипические клетки; позволяет выбирать более консервативную или более агрессивную тактику лечения пациентов со злокачественными новообразованиями мочевого пузыря; снижает уровень ложноположительных результатов у пациентов с доброкачественным папилломатозом мочевого пузыря; позволяет проводить раннюю диагностику рака мочевого пузыря, а также контроль излеченности и выявления рецидивов; применяется в качестве скрининга при отборе пациентов для проведения цистоскопии.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Экспрессия СК20 характерна для папиллярных уротелиальных опухолей, переходноклеточного рака высокой степени злокачественности.
Цитокератин 20 экспрессируется в неинвазивных опухолях в 57% случаев; при Т1 карциномах в 69%; при Т2 опухолях в 100%.
Пациентам, у которых по результатам клинического анализа мочи обнаружены SRC выше референсных значений и выявлена экспрессия СК20 в осадке мочи, в сочетании с макро- или микрогематурией, рекомендуется проводить дальнейшую целенаправленную диагностику рака мочевого пузыря.
Выявление экспрессии СК20 в осадке мочи после выполнения трансуретральной резекции мочевого пузыря с большой долей вероятности свидетельствует о наличии остаточной опухоли.
Выявление экспрессии СК20 в осадке мочи является показанием для проведения цистоскопии.
Цитокератин 7 что это
Экспертное заключение – доктор медицинских наук, профессор кафедры патологической анатомии лечебного факультета РГМУ М.В. Самойлов
Учебное пособие выполнено в рамках инновационной образовательной программы Российского университета дружбы народов, направление «Комплекс экспортоориентированных инновационных образовательных программ по приоритетным направлениям науки и технологий»
ПРИКЛАДНЫЕ ВОПРОСЫ ИММУНОГИСТОХИМИИ Тема № 4. Значение клеточных белков в оценке гистогенеза опухолей Тема № 5. Рецепторные белки в неизмененных и опухолевых клетках Тема № 6. Белки – маркеры клеточного цикла Тема № 7. Факторы апоптоза и пролиферации
ПРАКТИЧЕСКИЕ ВОПРОСЫ ОНКОМОРФОЛОГИИ
В настоящее время иммуногистохимический метод исследования широко применяется для выявления неизвестной локализации первичной опухоли при наличии её метастазов. От 10 до 15% раковых опухолей характеризуются метастазами в различных органах, полостях и лимфатических узлах.
При морфологической диагностике метастатические опухоли, согласно рекомендациям Европейского общества медицинской онкологии (ESMO, 2004), целесообразно разделять на пять крупных категорий: аденокарцинома, плоскоклеточный рак, нейроэндокринный рак, недифференцированный рак, недифференцированная опухоль. Эти морфологические категории наряду с данными о распространённости процесса во многих случаях позволяют определить адекватный план обследования и лечения.
Частота случаев, когда заболевание сопровождалось развитием метастазов, а локализация первичной опухоли на момент морфологического исследования неизвестна, составляет 3-15% от всех онкологических заболеваний. При этом локализация первичного очага определяется при жизни в среднем у 30-40% пациентов, на аутопсии – у 60-70%.
Иммуногистохимическое исследование в зависимости от морфологического типа новообразования позволяет уточнить гистогенез опухоли и/или высказаться о вероятной локализации первичного очага. Большинство из этих опухолей представляют аденокарциномы молочной железы, толстого кишечника, легких, яичников, поджелудочной железы, предстательной железы и желудка.
В случае метастазов аденокарциномы задача иммуногистохимического исследования состоит в выявлении вероятного источника метастазирования.
Для этих целей в настоящее время используется целый ряд маркеров включая цитокератины 7 и 20, тиреоидный фактор транскрипции (TTF-1), CA125, CDX2, рецепторы к эстрогенам, GCDFP-15, лизоцим, мезотелин, простат-специфический антиген.
Цитокератин 7 (CK7) относится к семейству белков промежуточных филаментов, имеет молекулярную массу 54 кДа, выявляется в различных видах железистого эпителия. Антитела клона OV-TL (Dako) окрашивают цитоплазму различных видов клеток нормального и неопластического железистого эпителия, включая эпителий протоков. CK7 выявляется в клетках цилиндрического и железистого эпителия легких, шейки матки, молочной железы, желчевыводящих путей и собирательных трубочек почек. CK7 окрашивает переходный эпителий мочевого пузыря, эпителий яичников и легких. Иногда можно встретить положительное окрашивание эндотелия сосудов. В свою очередь, CK7 не экспрессируется в эпителиальных клетках желудочно-кишечного тракта, предстательной железы. Практически не выявляется CK7 в гепатоцитах, эпителии проксимальных и дистальных извитых канальцев почек, миоэпителиальных клетках, многослойном эпителии кожи, языка, пищевода и эктоцервикса. Моноклональные антитела OV-TL выявляют отдельные виды аденокарцином и могут быть использованы для проведения дифференциальной диагностики между CK7-позитивными тканями (такими как рак яичников и переходноклеточный рак) и CK7-негативными тканями (такими как аденокарциномы желудочно-кишечного тракта и рак предстательной железы).
Цитокератин 20 (CK20) является представителем кератина I типа, который непосредственно экспрессируется в эпителии желудка и тонкого кишечника, уротелии и клетках Меркеля кожи. Антитела (клон Ks 20.8, Dako) реагируют с соответствующим белком молекулярной массой 46 кДа. CK 20 – это основной белок зрелых энтероцитов и бокаловидных клеток; он специфически экспрессируется в эпителиальных клетках слизистой оболочки желудка и тонкого кишечника. Его также можно выявить в аденокарциномах толстого кишечника, желудка, поджелудочной железы, желчных капилляров, в муцинозных опухолях яичников, переходноклеточном раке мочевого пузыря и раке из клеток Меркеля. В свою очередь, в плоскоклеточных раках, аденокарциномах молочной железы, легких, эндометрия, не муцинозных опухолях яичников и мелкоклеточных карциномах легких CK 20 не экспрессируется.
Лизоцим катализирует гидролиз отдельных мукополисахаридов клеточной оболочки бактерий. Используется для выявления опухолей из гистиоцитов и лейкозных клеток миелоидного ряда. Он выявлен в клетках селезенки, легких, почек, лейкоцитах крови, плазматических клетках, слюне, молоке и слезной жидкости.
Мезотелин – клеточный гликопротеин (молекулярная масса 40 кДа), располагается на поверхности мезотелиальных клеток и связан с механизмами клеточной адгезии. Он также выявляется в мезотелиомах, эпителиальных раках яичников и некоторых плоскоклеточных раках. Клон 5В2 (Novocastra) окрашивает эпителиоидные мезотелиомы и аденокарциномы легких, яичников, опухоли брюшины, эндометрия, поджелудочной железы, желудка и толстого кишечника. Антитела не реагируют с тканью почек, печени, плаценты, кожи и щитовидной железы. Мезотелина много в обычных мезотелиальных клетках, из которых формируются злокачественные мезотелиомы и цистаденокарциномы яичников. Эти антитела вместе с антителами к калретинину могут быть использованы для выявления мезотелиом.
CDX2 – рекомбинантный белок прокариотов, соответствующий аминокислотному N-терминальному участку молекулы CDX2 человека. Является специфическим транскрипционным фактором клеток тонкого кишечника. Ген cdx2 кодирует интестинально-специфический транскрипционный фактор, его белок экспрессируется на ранних стадиях развития тонкого кишечника и может иметь значение в регулировании пролиферации и дифференцировки эпителиальных клеток тонкого кишечника. Играет важную роль в инициации дифференцировки клеток в зрелые энтероциты. Клон AMT28 (Novocastra) реагирует с 40кДа белком, расположенным в ядрах клеток. Он экспрессируется в ядрах эпителиальных клеток кишечника от двенадцатиперстной кишки до прямой кишки. Белок CDX2 экспрессируется также в первичных и метастатических опухолях толстого кишечника, а также выявляется при кишечной метаплазии желудка и кишечном типе рака желудка, в свою очередь, в нормальных эпителиальных клетках желудка он не встречается. Данный белок обнаруживается в ядрах только цилиндрического эпителия и раковых клетках колоректальных аденокарцином, таким образом с его помощью можно идентифицировать метастазы рака толстого кишечника.
CA125 – белок ракового антигена яичников. Моноклональные антитела (клон Ov185:1, Novocastra) распознают муциноподобный гликопротеин молекулярной массой около 200 кДа. Антитела окрашивают различные опухоли, такие как аденокарциномы толстого кишечника, аденокарциномы молочной железы, опухоли матки, бронхо-альвеолярные раки, эндометриоидные и серозные аденокарциномы яичников.
ER – рецепторы к эстрогенам. Клон 6F11 (Novocastra) взаимодействует с эстрогеновым рецептором альфа. Антитела окрашивают ядра с рецепторами к эстрогенам в эпителиальных и гладкомышечных клетках матки, а также ядра эпителия молочных желез. Выявление рецепторов к стероидным гормонам широко применяется при лечении гормонально-зависимых опухолей. Наличие рецепторов к эстрогенам является маркером рака молочной железы, а также может свидетельствовать о прогнозе заболевания и эффективности эндокринной терапии.
Простат-специфический антиген (ПСА) – представляет собой гликопротеин. Клон ER-PR8 (Dako) получен к белку молекулярной массой 35 кДа. ПСА биохимически и иммуногистохимически отличается от другого широко используемого маркера опухоли предстательной железы – кислой простатической фосфатазы. Он располагается в цитоплазме клеток ацинарного и протокового эпителия нормальной ткани, выявляется при доброкачественной гиперплазии предстательной железы и аденокарциноме. Эти антитела можно использовать для выявления метастазов рака предстательной железы, поскольку ПСА выделяется опухолевыми клетками простаты и определяется в плазме крови у больных с раком простаты.
GCDFP-15 – белок, который встречается при диффузной кистозной мастопатии, для которой характерны макро- и микрокисты, протоковая и дольковая гиперплазия и др. патология молочных желез. Кисты формируются за счет апокриновой секреции эпителиальными клетками. Жидкость кист содержит гликопротеины, включая уникальный 15 кДа мономер. В нормальной ткани подобный белок встречается в эпителии слезных, подъязычных и мелких слюнных желез, в клетках серозных оболочек, трахеальных и бронхиальных желез.
GCDFP-15 и PSA одновременно экспрессируются в опухолях молочных желез с положительной реакцией на рецепторы к андрогенам. Данный маркер может быть использован для выявления аденокарциномы молочной железы, протоковых раков слюнных желез и апокринового эпителия.
Часть маркеров, такие как ПСА для рака предстательной железы, TTF-1 для рака легких, работают моноспецифично. Другая часть маркеров этой панели характерна для нескольких опухолей: так, рецепторы к эстрогенам могут быть выявлены при раке молочной железы или яичников, CDX2 – при опухолях желудочно-кишечного тракта. Часть маркеров может характеризовать источник метастаза только комплексно: рецепторы к эстрогенам, мезотелин и CA125 характеризуют опухоли яичников.
Метастазы плоскоклеточного и нейроэндокринного рака без выявленного
первичного очага (Савелов Н.А., Петровичев Н.Н., 2006)
При метастазах плоскоклеточного рака проводить иммуногистохимическое исследование нецелесообразно, так как возможности метода не позволяют уточнить вероятный источник метастазирования. Это относится и к метастазам низкодифференцированного нейроэндокринного рака. Однако при метастазах высокодифференцированного нейроэндокринного рака (синоним – атипичный карциноид) коэкспрессия CK7 и TTF1 может свидетельствовать о локализации первичного очага в легком, а коэкспрессия CK20 и CDX2 – в органах ЖКТ.
Метастазы недифференцированного рака без выявленного первичного
очага (Савелов Н.А., Петровичев Н.Н., 2006)
У пациентов с метастазами без четких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее, установление направления дифференцировки опухолевых клеток). Для этого применяется следующая панель антител: р63, CК5, CK14 или CК5/CK6, CК18, СD56 (N-CAM).
Антитела к белку Р63 (клон 4А4, Dako). Белок Р63 принадлежит к семейству Р53 опухолевых супрессорных генов, которые также включают белок Р73. Эти белки регулируют процессы клеточной транскрипции и запускают процессы апоптоза в ответ на повреждение ДНК и развитие гипоксии. Р63 экспрессируется в ядрах базальных клеток различных видов эпителия. Белок Р63 выявляется в пролиферирующих клетках эпителия шейки матки, уротелия и предстательной железы. Он также экспрессируется в большинстве низкодифференцированных плоскоклеточных раков. Антитела к Р63 помогают дифференцировать доброкачественные и злокачественные опухоли предстательной железы.
Антитела к белку CD56 (клон МОС-1, Dako). Белок CD56 является антигеном клеток натуральных киллеров. Реагирует с CD4+ и CD8+, Т-клетками в периферической крови. CD56 можно выявить в нейробластоме и мелкоклеточном раке легких, а также некоторых других опухолях.
Цитокератины CK5/CK6 (клон D6/16 B4, Dako). Цитокератины относятся к семейству промежуточных филаментов и выявлены практически во всех клетках. Типы цитокератинов CK5/CK6 выявляются в мезотелиальных клетках и не встречаются в аденокарциномах. CK5/CK6 применяются как маркеры мезотелиомы и плоскоклеточного рака легких, болезни Боуэна (разновидности карциномы, поражающей чешуйчатые клетки эпидермиса кожи, но не распространяющейся на ее базальные слои). Они не встречаются в аденокарциномах легких, но окрашивают мезотелиому и базальные клетки желез простаты. Данные антитела не реагируют с тканями мезодермального происхождения, такими как мышцы и соединительная ткань. Цитокератины CK5/CK6 экспрессируются в низкодифференцированных аденокарциномах и выявляются в эпителиоидных мезотелиомах.
Цитокератин CK14 (клон LL002, BioGenex), молекулярная масса 50 кДа, – это кислый цитокератин первого типа, с помощью которого можно отличить многослойный плоский эпителий от простого эпителия. Цитокератин CK14 равномерно экспрессируется в цитоплазме всех клеток многослойного плоского ороговевающего эпителия. Моноклональные антитела к цитокератину CK14 помогают дифференцировать типы клеток в молочных железах при развитии аденокарциномы.
Цитокератин CK18 (клон DC10, Dako) – белок с молекулярной массой 45 кДа. Антитела реагируют с большинством видов простого эпителия, включая эпителий протоков и ацинусов желез. Данный белок экспрессируется в эпителии щитовидной железы, молочной железы, желудочно-кишечного тракта и дыхательной системы. Антитела используют для выявления аденокарцином легких, при этом они окрашивают цитоплазму опухолевых клеток из эпителия и не окрашивают опухолевые неэпителиальные клетки (глиомы, меланомы, остеосаркомы).