Цефалоспорины или фторхинолоны что лучше
Цефалоспорины или фторхинолоны что лучше
Цефалоспорины являются бета-лактамными антибиотиками, используемыми при внебольничных, госпитальных пневмониях, а также пневмониях при иммунодефицитах. Они оказывают бактерицидное действие, превосходя пенициллины по антибактериальной активности и показателям фармакокинетики.
Наибольшее распространении получило деление цефалоспоринов на геренации (поколения), основанное на спектре их антимикробного действия.
Цефалоспорины 2 поколения (цефуроксим, цефамандол, цефоксетил, цефаклор и др.) имеют широкий спектр действия, активны в отношении грамотрицательных и грамположительных микроорганизмов, выделяющих бета-лактамазы. Они используются в качестве средств 1 ряда при внегоспитальной пневмонии у больных пожилого возраста, имеющих сопутствующие заболевания.
Цефалоспорины 3 поколения обладают преимущественной активностью в отношении грамотрицательных бактерий и некоторых анаэробов. Поэтому они рассматриваются в качестве средств первого ряда при госпитальных пневмониях и пневмониях на фоне иммунодефицитов. Их недостатком является слабая активность в отношении стафилококков, продуцирующих бета-лактамазы.
К этой группе относятся цефтазидим (фортум), цефотаксим (клафоран тарцефоксим, Polfa), цефтриаксон (лонгацеф), цефоперазон (цефобид), цефтибутен (цедекс). Цефтазидим обладает наиболее высокой активностью против синегнойной палочки. Поэтому он является препаратом выбора при лечении пневмоний у больных, находящихся на искусственной вентиляции легких в отделениях реанимации. Цефтриаксин имеет наибольший период полувыведения и может назначаться 1 раз в сутки. Цефоперазон метаболизируется в печени и выделяется с желчью, поэтому он может назначаться в обычных дозах у, больных почечной недостаточностью.
В последние годы синтезированы цефалоспорины 4 поколения (цефепим, цефпиром), которые высокоактивны против грамположительных и грамотрицательных микроорганизмов. Место этих средств в лечении пневмоний требует уточнения.
Цефалоспорины характеризуются хорошей переносимостью. Побочные реакции при их приеме у больных возникают редко. Следует отметить, что эти препараты вызывают перекрестные с пенициллинами реакции гиперчувствительности (в 5-10% случаев). Поэтому их не следует назначать больным с аллергическими реакциями на пенициллин.
Как правило, госпитальные пневмонии вызываются грамотрицательной флорой (в том числе Ps.aeruginosae), анаэробами и стафилококками. Поэтому препаратами выбора у больных являются цефалоспорины 3 поколения, фторхинолоны, комбинации пенициллинов и ингибиторов бета-лактамаз (аугментин, уназин, тазоцин, тиментин и др.).
Наиболее изученными представителями этого класса соединений являются ципрофлоксацин (ципробай, ципринол и др.), офлоксацин (таре-вид), пефлоксацин (пефлацин, абактал), ломефоксацин (максаквин), флерофлоксацин. Следует помнить, что ципрофлоксацин и пефлоксацин тормозят клиренс теофиллина, что требует уменьшения дозы последнего при их совместном применении.
Побочные эффекты, возникающие при приеме фторхинолонов (дисфункции пищеварительной системы, фотосенсибилизация и др.), встречаются относительно редко.
При тяжелом течении госпитальных пневмоний используются комбинации препаратов первого ряда с аминогликозидами и карбапенемы.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
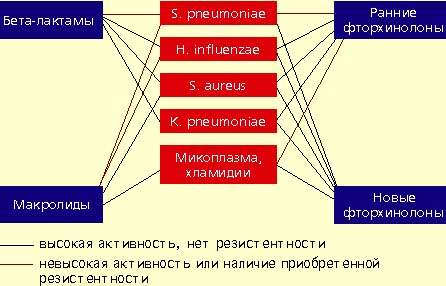 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Рациональный выбор антибиотика: взгляд фармаколога.
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Сейчас я с удовольствием попрошу Елену Николаевну Кареву, доктора медицинских наук, профессора, сделать сообщение «Рациональный выбор антибиотика» вот уже с позиции фармаколога. Пожалуйста, Елена Николаевна.
Елена Николаевна Карева, профессор:
– Спасибо большое. Рациональный выбор любого лекарственного препарата заключает в себе принцип разумной достаточности. Но что касается именно антибактериальной терапии, здесь, конечно, важно, чтобы подобранный антибиотик, во-первых, был правильно угадан, если мы про эмпирический подбор говорим. Во-вторых, с современных позиций, учитывая огромное количество резистентных форм микроорганизмов, желательно было бы, чтобы выбранный антибактериальный препарат в меньшей степени индуцировал эту самую резистентность. И, конечно же, чтобы препарат, его использование не позволяло переходить заболеванию в хроническую форму, то есть предупреждение хронического развития.
И давайте вернемся к ситуации следующей. Внебольничная пневмония, о ней сейчас, в основном, пойдет речь, неспецифическая инфекция. Естественно, основные патогенны – это те микроорганизмы, которые находятся у нас в нестерильных зонах. И соответственно, мы вправе ожидать… Этиология внебольничных пневмоний тоже нам вполне известна. Инфекционный процесс обычно начинается или является результатом так называемого нарушения паритета микробиота. Если мы вспомним с вами, микробиот – это в организме человека имеются микроорганизмы, на одну клетку человека приходится до ста микроорганизмов. Это и бактерии, и вирусы, и простейшие черви. То есть все они здесь есть. Так вот, для того чтобы начался инфекционный процесс, необходимо, соответственно, преодолеть некие границы, возможно, механические причины нарушения. И вторая причина чаще всего – как раз вирусная атака. Как говорят классики, вирус выносит приговор человеку, а присоединившаяся бактериальная флора приводит этот приговор в исполнение. Как только появляется гнойное отделяемое, необходимо начинать антибактериальную терапию, не раньше.
Итак, внебольничная пневмония, основная причина этиологическая – это пневмококки, в первую очередь, H. influenza, M. Catarrhalis. И вот цитата Сергея Михайловича Навашина, хотела бы я отметить одну фразу, что нельзя надеяться на существование некой волшебной золотой таблетки. Нет и не будет никогда антибактериального препарата, который не будет вызывать резистентность. Здесь мы должны реально смотреть на жизнь.
Каковы же механизмы возникновения резистентности микроорганизмов к антибиотикам? Несоблюдение дозы, длительности приема, кратности приема и нецелевое использование. Антибактериальные препараты – очень благодарные препараты в каком плане: если врач угадал с препаратом, фактически в ближайшие часы, сутки, мы видим положительную динамику. И соответственно, когда прекращают? Опять же, это исследование все показывает. Когда прекращают пациенты да и врачи сами, когда лечатся, прекращают принимать антибактериальный препарат – да через сутки после того как ушла основная симптоматика. Правильно? И мы с вами как раз получаем то, что мы подращиваем сами себе резистентные формы. Нецелевое использование антибактериальных препаратов. Посмотрите, пожалуйста, 2010 год, что нам говорят. антибактериальные препараты используются очень активно в сельском хозяйстве: это и мясная промышленность, это и птица, это и рыба, это, посмотрите, даже медоносные пчелы не избежали своего участия. При этом если раньше использовали антибактериальные препараты исключительно для того, чтоб предупредить инфекционный падеж скота, то оказалось, что использование антибактериальных препаратов приводит к приросту мышечной массы. И теперь антибиотики используют не только в эпидемиологических каких-то опасных ситуациях, а все время. И что мы с вами видим, посмотрите, пожалуйста. Рыба…
Ивашкин В.Т.:
Карева Е.Н.:
– Да, конечно. Особенно тех осетров, которые сидят в бочках. Там вот, смотрим дальше. 2012 год, вот это европейское медицинское общество представляет нам использование антибактериальных препаратов в, соответственно, пищевой промышленности. То есть здесь идет речь о сельском хозяйстве. Цветами, соответственно, определено, какие антибактериальные препараты используются. На первом месте – больше всего и чаще всего это тетрациклины и бета-лактамы. 80% всего объема антибактериальных препаратов, производимого на планете Земля, используются в сельском хозяйстве. И поэтому ничего удивительного нет в том, что, вы помните, в 2009 году в Испании проводили исследование: детей, которые никогда в жизни не получали антибактериальную терапию, проверяли Escherichia coli на предмет резистентности к антибактериальной терапии. Что же оказалось? Более половины штаммов Escherichia coli были резистентны к пенициллинам, хотя дети никогда не получали антибактериальную терапию. Опять же, это связано с пищевой промышленностью, со способами передачи резистентности.
Ну, с чем же связана такая уникальная способность фторхинолов? Каковы особенности механизма действия? Ну, все фторхинолоны являются достаточно простыми молекулами. Мы видим с вами гетероцикл – это налидиксовая кислота. Введение галогенов, хлора, фтора в молекулу, больших, крупных радикалов позволило значительно расширить спектр антибактериальной активности, добавить антианаэробной активности и улучшить фармакокинетические свойства препарата. Более 10000 препаратов фторхинолонов было синтезировано. Конечно, не все они используются в клинической практике, но, тем не менее. Каков механизм действия? Механизм действия сводится к нескольким принципиальным моментам. Основными мишенями действия вторхинолонов являются два фермента – это топоизомеразы второго и четвертого типа. Для того чтобы понимать, вообще, для чего существуют эти топоизомеразы в клетке микроорганизма, нужно вспомнить о том, что генетический материал микробов – это суперспирализованная кольцевая ДНК. Для того чтобы, соответственно, начать работать с целью производства белка или с целью собственного воспроизводства, необходимо релаксировать эту самую ДНК. Что происходит, каким образом работает ДНК-гираза, или топоизомераза второго типа? Она осуществляет две реакции. Первая реакция – это разрез одной нити ДНК, переворот ее вокруг второй нити ДНК, и вторая реакция – сшивка. Две реакции. Что делают фторхинолоны? Они не препятствуют первой реакции, но тормозят вторую. И мы видим с вами так называемые сколы ДНК, которые, накапливаясь и достигая критического значения, вызывают апоптоз клетки – такое мощнейшее цитотоксическое действие. Второй фермент – тоже топоизомераза, только уже теперь четвертого типа, и ее функция – разведение сцепленных, дочерних кольцевых ДНК с материнской. Что делают фторхинолоны? Блокируют топоизомеразу четвертого типа. И мы видим с вами в результате: на материнской ДНК кольцевой нанизано большое количество дочерних ДНК. Как вы понимаете, это тоже особенно не способствует размножению микроорганизмов.
Что касается безопасности, аминокислотная последовательность мишени, то есть области фермента, с которым взаимодействует антибактериальный препарат – у микроорганизма аминокислотная последовательность этой мишени и у человека (имеется в виду эукариотический аналог топоизомераз) принципиально различаются. То есть для того чтобы заингибировать функциональный аналог топоизомеразы второго типа, эукариот, требуются дозы, посмотрите, пожалуйста, в 500-2500 тысячи раз больше терапевтической дозы. То есть генно-токсичностью эти препараты, очевидно, не обладают.
Кроме влияния на топоизомеразы второго и четвертого типа, фторхинолоны блокируют эффлюксный механизм. Опять же, в микроорганизме этот эффлюксный механизм выполняет определенную функцию. Его нагрузка функциональная – вывести токсические продукты метаболизма из клетки. Но этот же эффлюксный механизм работает, например, как один из способов развития резистентности. Оверэкспрессия, большое количество этих насосов на поверхности клетки, приводит к тому, что выбрасывает микроорганизм изнутри попавший антибактериальный препарат. И к сожалению, именно этим механизмом развивается резистентность ципрофлоксацина, потому как он является гидрофильным, он водорастворим. А такие препараты, как левофлоксацин, он же просто гидрофобный, он же просто не выходит через указанный канал.
И вот, пожалуйста, структуры субъединицы эффлюксного механизма и та предположительная область, с которой связываются фторхинолоны. Кроме того, фторхинолоны повреждают механизм так называемой бактериальной коммуникации. Что это за механизм бактериальной коммуникации? Это образование известных вам биопленок, биофильмов. А биофильмы и биопленки – это признак хронизации процесса. Для того чтобы инициировался процесс формирования вот этого липидного слоя с холестерином, все, как у больших, вот для этого необходимо появление в системе определенных сигнальных молекул. Синтез этих сигнальных молекул блокируется фторхинолонами. То есть это один из механизмов перехода в хроническое состояние.
Кроме микроорганизмов, действию фторхинолонов подвергаются и макроорганизмы. Иммуномодулирующее действие. В чем оно заключается? Снижается активность провоспалительных цитакинов, уменьшается их концентрация, в частности, некротического фактора опухоли альфа, но при этом повышается синтез и секреция интерферона гамма. То есть вот такое интересное иммуномодулирующее действие.
Казалось бы, какое отношение вот эти биохимические параметры, какую аппликацию могут иметь в клинику. И вот, пожалуйста, сравнительное исследование: пациенты с внебольничной, тяжелой формой пневмонии, леченые цефтриаксоном и левофлоксацином. Так вот оказалось, что на левофлоксацине динамика положительной симптоматики, то есть излечения, происходила почти на полтора суток быстрее. И это совершенно четко коррелировало с уровнем некротического фактора опухоли альфа в плазме крови. Какие параметры исследовались? Это восстановление сатурации кислорода, частота сердечных сокращений, и так далее, там по списку.
Итак, помните те самые 10000 фторхинолонов? Соответственно, из них небольшая часть получила клиническое использование. Мы видим с вами препараты первого поколения – это, в основном, мочевая инфекция. Второе поколение – это уже системный, но все-таки с преимущественным антиграмм-отрицательным действием. Ну, правда, здесь добавляются некоторые особенности. А вот третье и четвертое – это антиграмм-положительные, против пневмококков специально заточенные фторхинолоны. То есть они так и называются – респираторные фторхинолоны третьего-четвертого поколения. А к третьему поколению у нас как раз относится и левофлоксацин.
Как бы хороши ни были наши препараты в пробирке, не будет клинической эффективности без достойной фармакокинетики. Соответственно, здесь я привела результаты только частично только респираторных фторхинолонов. И что же мы видим? Все фторхинолоны обладают очень хорошей биодоступностью. И это хорошо почему, потому что не приходится пересчитывать дозы с парентеральной на пероральную терапию. Это во-первых. Большой объем распределения. А большой объем распределения – это значит, что фторхинолон не задерживается в плазме крови, он уходит в ткани. Причем там, где происходит воспалительный процесс, там накапливается он в большей степени. В 40-100 раз больше концентрация в тканях по сравнению с плазмой крови фторхинолонов.
Возвращаемся к внебольничной пневмонии. Препараты выбора – конечно же, бета-лактамы, макролиды. И когда мы переходим к респираторным фторхинолонам? Только в той ситуации, если резистентность высеяна у пневмококков к бета-лактамам или макролидам. Но здесь присоединяется еще одна группа больных. Помните насчет использования бета-лактамов в сельскохозяйственной практике? Вырастает не только резистентность к бета-лактамам у потребителей, но и аллергические реакции. К сожалению, это характерно для бета-лактамов. Так вот при резистентности к бета-лактамам и макролидам, а также при наличии непереносимости препаратов этого ряда, и только в этой ситуации рациональным является, потому что респираторные фторхинолоны – это сильная группа препаратов, то есть в этой ситуации рационально используется применение фторхинолонов.
Факторы риска. Ну, Владимир Трофимович нам очень хорошо и популярно объяснил клинические признаки, например, МРСА. Ну, какие добавляются еще внешние признаки вероятности встретить резистентную флору? Это пациенты в возрасте старше 65 лет, то есть старшая возрастная группа, это терапия в течение последних трех месяцев антибактериальными препаратами, ну, обычно широкого спектра действия, и иммунокомпрометированные состояния, то есть это соматическая патология, это метаболические заболевания, сахарный диабет и так далее, хронический алкоголизм и так далее. То есть вот в этой ситуации мы вправе ожидать наличие резистентной флоры. Ну, то, что левофлоксацин показан при монотерапии – да, при инфекции нижних дыхательных путей, я имею в виду внебольничную пневмонию. У госпитальной пневмонии, уже было обсуждено, комплексная терапия, там тоже используется левофлоксацин.
Что интересно, среди респираторных фторхинолонов самым изученным является левофлоксацин, потому как он чаще и шире всего используется из всех фторхинолонов. Чаще него использовали в клинической практике только ципрофлоксацин, но ципро не относится к респираторным. То есть если мы говорим про респираторные – левофлоксацин. То есть использование, посмотрите, 450 миллионов пациентов. И это два года назад, то есть наверное, цифра подросла. Соответственно, все возможные варианты побочных эффектов уже известны. Вся эффективность, безопасность, то есть спектр мы знаем этого препарата. Естественно, у левофлоксацина имеют ограничения, как у всех фторхинолонов – это детский возраст, это беременные и непереносимость, гиперчувствительность, это как для всех лекарственных препаратов.
И «Левохин», оригинальный препарат левофлоксацина, он уже утратил свою патентную защиту, и поэтому существует много разных препаратов, аналогов, воспроизведенных лекарственных средств. С 2009 года на территории Российской Федерации левофлоксацин имеется еще и под названием «Леволет» и производится компанией «Dr. Reddy’s Laboratories LTD». Независимая международная лаборатория проводит исследование биоэквивалентности. Мы видим сравнение с оригинальным препаратом. А то, что в компании «Dr. Reddy’s», вообще, все производство имеет сертификат GMP, на основании всего этого, естественно, левофлоксацин этой компании, или «Леволет», как мы его знаем, включен в «Orange book». Причем в «Orange book» под литерой «А». А что такое литера «А»? Это значит, что возможна замена оригинального (…) (00:18:37), то есть фактически мы имеем дело с такого типа препаратом.
И возвращаясь к началу нашего разговора, учитывая основные характеристики рациональной химиотерапии, можно сказать, что левофлоксацин в этой ситуации и обеспечивает эффективное лечение, и предупреждает развитие устойчивости. Вернее, не предупреждает, но по сравнению с другими антибактериальными препаратами значительно реже вызывает развитие резистентности. И соответственно, насчет перехода в хроническую инфекцию мы тоже с вами уже обсудили. А среди левофлоксацина достойное место занимает препарат «Леволет». Спасибо за внимание.
