лат гем асс инф что это
Азбука прививок: кому, когда, зачем? Иммунизация против гемофильной инфекции
Источником инфекции является больной клинически выраженной формой заболевания (от ОРЗ до воспаления легких, менингитов и сепсиса) и здоровые носители гемофильной палочки. В очаге гемофильной инфекции частота носительства может достигать 70% среди детей и 30-40% среди взрослых.
Путь передачи инфекции – воздушно-капельный, распространение возбудителя происходит при чихании, разговоре, кашле со слизью и мокротой. Наибольшая вероятность инфицирования у лиц, находящихся в непосредственной близости с источником инфекции (3 метра и менее). Больной становится заразен с появлением симптомов болезни. Носитель внешне здоров, но наиболее опасен, однако у таких людей выделяют наименее заразные типы гемофильной палочки. Дополнительный путь инфицирования – контактно-бытовой (через предметы обихода – полотенца, посуду, игрушки).
Сезонность при данной инфекции – зима-весна. Восприимчивость к данной инфекции высокая среди детей раннего возраста – с 6 месяцев до 2-х лет, а иногда 4-х лет. До 6 месяцев в силу «материнской защиты» дети заболевают редко. Старше 5-ти лет и взрослые болеют в единичных случаях.
Первая вакцина появилась 1985 году. С 1989 года, с момента появления эффективных вакцин, прививки против ХИБ стали проводиться по всему миру.
На сегодняшний день на территории Российской Федерации проводится вакцинация против гемофильной инфекции среди детей, относящихся к группам риска. Это дети с иммунодефицитными состояниями или анатомическими дефектами, приводящими к резко повышенной опасности заболевания гемофильной инфекцией, с онкогематологическими заболеваниями и/ или длительно получающие иммуносупрессивную терапию, рожденные от матерей с ВИЧ-инфекцией, ВИЧ- инфицированные, находящиеся в домах ребенка, таких детей прививают по следующей схеме:
I прививка – 3 месяца
II прививка– 4,5 мес. (не ранее, чем через 45 дней после первой)
III прививка – 6 мес. (не ранее, чем через 45 дней после второй)
I ревакцинация – 18 мес.
Сегодня в Российской Федерации зарегистрировано несколько вакцин против гемофильной инфекции:
—«Пентаксим» (производитель – Франция), комплексная вакцина, защищает организм сразу от пяти заболеваний (коклюша, дифтерии, столбняка, полиомиелита и гемофильная инфекция), отличается высокой степенью очистки и считается одним из лучших препаратов в Европе,
—«Акт-Хиб» (производитель –Франция),
—«Хиберикс» (производитель- Бельгия).
Для чего нужна иммунизация против гемофильной инфекции?
Благодаря иммунизация против гемофильной инфекции достигается высокий уровень защиты от данного заболевания, который сохраняется длительное время. Согласно клиническим испытаниям в Великобритании, уменьшение заболеваемости представленным заболеванием составило на 87%. В Голландии после прививания врачи отмечают полное отсутствие подобных случаев. При заражении привитого малыша заболевание протекает в лёгкой форме. Вакцинация абсолютно безопасна, так как не оставляет никаких последствий в организме. Прививка от гемофильной инфекции снижает процент заражения заболеванием при попадании ребёнка в детский сад.
Осложнения после вакцинации против гемофильной инфекции
Реакций на введение препарата практически нет или они очень слабые, это небольшое уплотнение в месте введения препарата и незначительное повышение температуры тела.
Противопоказание к вакцинации.
Специальных противопоказаний к вакцинации не существует, кроме гиперчувствительности к ее компонентам и сильных реакций на предыдущую дозу.
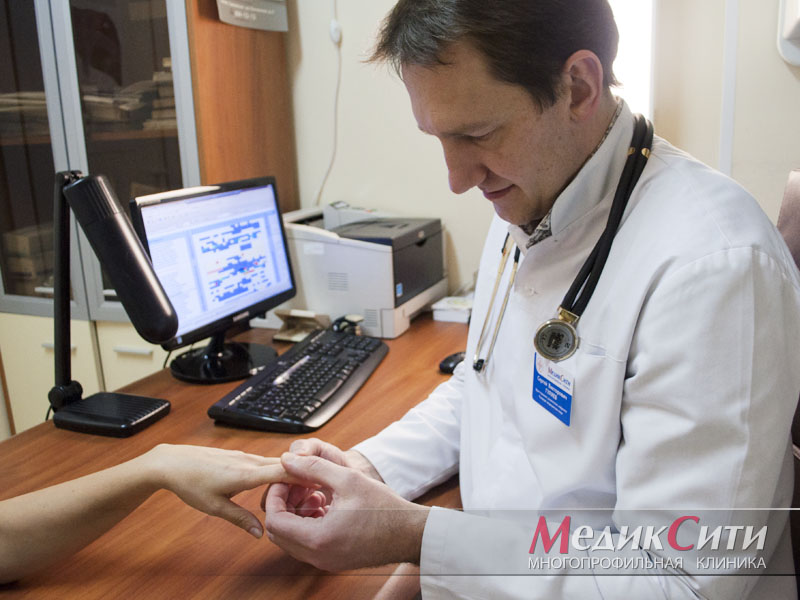
Ревматологическое обследование
Скидки для друзей из социальных сетей!
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
«Men’s Health», медицинский блог (август 2016г.)
Если ваши суставы опухают и болят по ночам, врач-ревматолог предложит вам проверить ревматологический профиль. Это обследование поможет поставить точный диагноз, проследить динамику заболевания и назначить правильное лечение.
При подозрении на ревматическую болезнь используют следующие исследования:
Анализ крови на уровень мочевой кислоты
Мочевая кислота – это окончательный продукт распада пуринов. Ежедневно человек получает пурины вместе с продуктами питания, преимущественно с мясными продуктами. Затем с помощью определенных ферментов, пурины перерабатываются с образованием мочевой кислоты.
В нормальных физиологических количествах мочевая кислота нужна организму, она связывает свободные радикалы и защищает здоровые клетки от окисления. Кроме того, она так же, как и кофеин, стимулирует клетки головного мозга. Однако повышенное содержание мочевой кислоты имеет вредные последствия, в частности может приводить к подагре и некоторым другим заболеваниям.
Исследование уровня мочевой кислоты дает возможность диагностировать нарушение обмена мочевой кислоты и связанные с этим заболевания.
Когда нужно провести обследование:
Уровень мочевой кислоты
Уровень мочевой кислоты определяют в крови и в моче.
Мочевая кислота в крови называется урекемия, в моче – урикозурия. Повышенное содержание мочевой кислоты – гиперурикемия, пониженный уровень мочевой кислоты – гипоурикемия. Патологическое значение имеет только гиперурикемия и гиперурикозурия.
Концентрация мочевой кислоты в крови зависит от следующих факторов:
В обычном состоянии наш организм поддерживает уровень мочевой кислоты в норме. Увеличение ее концентрации так или иначе связано с обменными нарушениями.
Нормы содержания мочевой кислоты в крови
У мужчин и женщин может наблюдаться различная концентрация мочевой кислоты в крови. Норма может зависеть не только от пола, но и возраста человека:
Если превышение нормы происходит в течение длительного времени, то кристаллы соли мочевой кислоты (ураты) откладываются в суставах и тканях, вызывая различные болезни.
Гиперурикемия имеет свои признаки, но может протекать и бессимптомно.
Причины повышения содержания мочевой кислоты:
Как снизить концентрацию мочевой кислоты
Те, кто болен подагрой, знают, сколько неприятностей может доставить повышенная концентрация мочевой кислоты. Лечение этого недуга должно быть комплексным и обязательно включать прием препаратов, снижающих концентрацию мочевой кислоты в крови (ингибиторы ксантиноксидазы). Рекомендуется употребление большего количества жидкости и снижение потребления продуктов богатых пуринами.
Важно также постепенно избавиться от лишнего веса, поскольку ожирение обычно ассоциируется с повышением мочевой кислоты. Диета должна быть составлена так, чтобы количество продуктов, богатых пуринами было ограничено (красное мясо, печень, морепродукты, бобовые). Очень важно отказаться от алкоголя. Необходимо ограничить употребление винограда, томатов, репы, редьки, баклажанов, щавеля – они повышают уровень мочевой кислоты в крови. Зато арбуз, наоборот, выводит мочевую кислоту из организма. Полезно употреблять продукты, ощелачивающие мочу (лимон, щелочные минеральные воды).
Антинуклеарные антитела (АНА)
С помощью АНА теста можно определить наличие в крови антинуклеарных антител (антител к ядерным антигенам).
АНА – это группа специфических аутоантител, которые производит иммунная система нашего организма в случае аутоиммунных нарушений. Антитела оказывают повреждающее действие на клетки организма. При этом человек испытывает различные болезненные симптомы, например боль в мышцах и суставах, общую слабость и др.
Обнаружение в сыворотке крови антител принадлежащих к группе АНА (например, антител к двуспиральной ДНК) помогает выявить аутоимунное заболевание, контролировать течение болезни и эффективность его лечения.
Исследование крови на АЦЦП
Анализ крови на С-реактивный белок
Исследование крови на АЦЦП
Когда необходим анализ крови на антинуклеарные антитела
Выявление антинуклеарных антител может быть признаком следующих аутоиммунных заболеваний:
Как выполняется тест на антинуклеарные антитела
Кровь на антинуклеарные антитела берется из вены на локтевом сгибе, натощак. Перед исследованием можно не придерживаться никакой диеты.
В некоторых случаях, для того чтобы дифференцировать различные аутоиммунные заболевания, могут потребоваться дополнительные уточняющие тесты на аутоантитела из группы антинуклеарных антител, так называемый иммуноблот АНА.
Что обозначают данные теста
У здорового человека с нормальным иммунитетом антинуклеарных антител в крови быть не должно или их уровень не должен превышать установленные референсные значения.
Нормальное значение АНА подразумевает титр антител, не превышающий значение 1: 160. Ниже этого значения анализ считается отрицательным.
Положительный анализ на антинуклеарные антитела (1:320 и более) указывает на повышение антинуклеарных антител, и наличие у человека заболевания аутоиммунной природы.
В настоящее время для выявления антинуклеарных антитела используются две методики: непрямую реакцию иммунофлюоресценции с использованием так называемой клеточной линии Нер2 и иммуноферментный анализ. Оба теста дополняют друг друга, в связи с чем их рекомендуют выполнять одновременно.
Можно выделить следующие виды антинуклеарных тел АНА в реакции непрямой иммунофлюоресненции:
При положительном анализе на антинуклеарные антитела необходимо провести иммуноблот антинуклеарных антител для уточнения типа аутоиммунного заболевания и постановки диагноза.
Ревматоидный фактор
Исследование крови на ревматоидный фактор направлено на выявление специфических антител класса IgM к антителам класса IgG.
Лабораторный тест на ревматоидный фактор является скрининговым исследованием, направленным на выявление аутоиммунных нарушений. Главная задача исследования на ревматоидный фактор – выявление ревматоидного артрита, болезни и синдрома Шегрена и ряда других аутоиммунных болезней.
Анализ на ревматоидный фактор может потребоваться при следующих симптомах:
Антитела ССР (Антитела к циклическому цитруллин содержащему пептиду) (кол.) в Москве
Анализ крови на АЦЦП — высокоспецифичный современный анализ для раннего выявления и прогнозирования исхода ревматоидного артрита.
Приём и исследование биоматериала
Комплексы с этим исследованием
Когда нужно сдавать анализ Антитела ССР (Антитела к циклическому цитруллин содержащему пептиду) (кол.)?
Подробное описание исследования
Ревматоидный артрит — хроническое системное аутоиммунное воспалительное заболевание соединительной ткани неизвестной этиологии, приводящее к инвалидизации и сокращению продолжительности жизни пациентов. Характеризуется симметричным эрозивно-деструктивным поражением нескольких суставов, а также вовлечением в воспалительный процесс различных органов и систем.
Симптомы ревматоидного артрита:
Анти-ЦЦП – это группа аутоантител (способных связываться с антигенами собственного организма), взаимодействующих с аномальными белками, содержащими аминокислоту цитруллин. При ревматоидном артрите происходит локальное цитруллинирование белков синовиальной оболочки суставов, что является одним из факторов, запускающих продукцию АЦЦП. Эти аутоантитела относятся к классу IgG и выявляются на ранней стадии ревматоидного артрита. Они более специфичны, чем IgM ревматоидного фактора.
У людей с высоким уровнем анти-ЦЦП ревматоидный артрит имеет более тяжелое течение. Этот факт используется для прогнозирования исходов заболевания.
Особенности и преимущества методики
Платформа модульная для биохимического и иммунохимического анализа Cobas 8000 (Roche Diagnostics GmbH, Германия).
Методические рекомендации. Гематологические анализаторы. Интерпретация анализа крови
УТВЕРЖДАЮ
Заместитель Министра
здравоохранения и
социального развития
Российской Федерации
Р.А.ХАЛЬФИН
21 марта 2007 г. N 2050-РХ
ГЕМАТОЛОГИЧЕСКИЕ АНАЛИЗАТОРЫ. ИНТЕРПРЕТАЦИЯ АНАЛИЗА КРОВИ
В эру использования современных технологий автоматизированного анализа крови стало реальным предоставлять значительно больше клинической информации о состоянии кроветворной системы и реагировании ее на различные внешние и внутренние факторы. Анализ результатов исследования крови составляет неотъемлемое звено в диагностическом процессе и последующем мониторинге на фоне проводимой терапии.
Высокотехнологические гематологические анализаторы способны измерять более 32 параметров крови, осуществлять полный дифференцированный подсчет лейкоцитов по 5-ти основным популяциям: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, что делает возможным в случае отсутствия от референсных значений этих показателей не проводить ручной подсчет лейкоцитарной формулы.
Аналитические возможности гематологических анализаторов:
высокая производительность (до 100-120 проб в час)
небольшой объем крови для анализа (12-150 мкл)
анализ большого количества (десятки тысяч) клеток
высокая точность и воспроизводимость
оценка 18-30 и более параметров одновременно
графическое представление результатов исследований в виде гистограмм, скатерограмм.
Диагностические возможности гематологических анализаторов:
оценка состояния гемопоэза
диагностика и дифференциальная диагностика анемий
диагностика воспалительных заболеваний
оценка эффективности проводимой терапии
мониторинг за мобилизацией стволовых клеток из костного мозга.
Несмотря на все достоинства, даже самые современные гематологические анализаторы обладают некоторыми ограничениями, которые касаются точной морфологической оценки патологических клеток (например, при лейкозах), и не в состоянии полностью заменить световую микроскопию.
Преаналитический этап гематологических исследований
Контроль преаналитических факторов в гематологических исследованиях является ключевым для обеспечения качественных результатов тестов. Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, интерферирующие вещества, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. До 70% лабораторных ошибок связаны именно с преаналитическим этапом исследования крови. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество гематологических анализов, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов.
Снижение до минимума возможных ошибок и обеспечение высокого качества гематологических исследований возможно за счет стандартизации преаналитического и аналитического этапов работы.
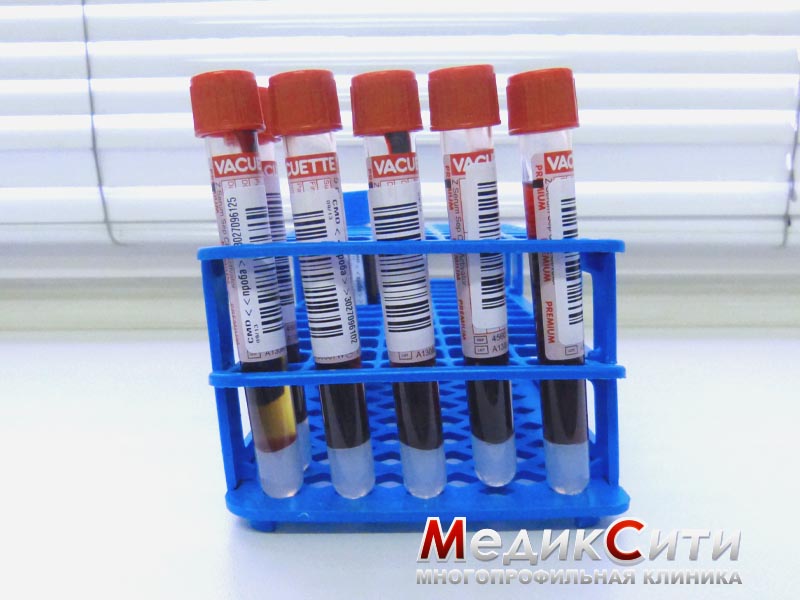
На точность и правильность результатов оказывает влияние техника взятия крови, используемые при этом инструменты (иглы, скарификаторы и др.), а также пробирки, в которые берется, а в последующем хранится и транспортируется кровь.
— Кровь следует брать натощак (после примерно 12 часов голодания, воздержания от приема алкоголя и курения), между 7 и 9 часами утра, при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин.), в положении пациента лежа или сидя.
— Взятие материала следует проводить в резиновых перчатках, соблюдая правила асептики.
Венозная кровь. Венозная кровь считается лучшим материалом для клинического исследования крови. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ, например, добавив исследование ретикулоцитов.
Достоверность и точность гематологических исследований, проводимых из венозной крови, во многом определяется техникой взятия крови.
Подготовка пациента к взятию крови из вены включает несколько этапов. Место венепункции нужно продезинфицировать марлевой салфеткой или специальной безворсовой салфеткой, смоченной 70 град. спиртом, и подождать до полного высыхания антисептика (30-60 секунд). Применение ватных тампонов и других волокнистых материалов подобного рода может привести к засорению волокнами счетной и гемоглобиновой камер, что влечет снижение точности и воспроизводимости измерения. Не рекомендуется использовать 96 град. спирт, так как он дубит кожу, поры кожи закрываются, и стерилизация может быть неполной.
Не рекомендуется вытирать и обдувать место прокола, пальпировать вену после обработки. Рука пациента должна покоиться на твердой поверхности, быть вытянута и наклонена немного вниз так, чтобы плечо и предплечье образовывали прямую линию. Необходимо следить, чтобы в момент взятия крови кулак пациента был разжат. Жгут следует накладывать не более чем на 1-2 минуты, тем самым обеспечивается минимальный стаз, при котором клетки крови не повреждаются. Игла должна быть достаточно большого диаметра и иметь короткий срез, чтобы не травмировать противоположную стенку вены во избежание тромбоза. После взятия крови необходимо приложить сухую стерильную салфетку к месту венепункции, а затем наложить давящую повязку на руку или бактерицидный пластырь.
— Кровь для гематологических исследований должна поступать
свободным током непосредственно в пробирку, содержащую
антикоагулянт К ЭДТА. Взятие крови шприцом без антикоагулянта с последующим переливанием в пробирку нежелательно из-за
формирования микросгустков и гемолиза. При взятии капиллярной
крови необходимо использовать специальные пробирки с ЭДТА для
капиллярной крови.
У некоторых пациентов может наблюдаться небольшая спонтанная агрегация тромбоцитов или реже так называемая ЭДТА-зависимая псевдотромбоцитопения (иммунного характера), причем эти явления прогрессируют по мере увеличения времени, прошедшего после взятия крови. У таких лиц точный подсчет числа эритроцитов может быть осуществлен при взятии крови с цитратом в качестве антикоагулянта.
Следует помнить, что применение в качестве антикоагулянтов гепарина или цитрата натрия сопровождается структурными изменениями клеток и поэтому не рекомендуется для использования как при автоматизированном, так и морфологическом исследовании крови.
Капиллярная кровь. Для гематологических исследований капиллярную кровь рекомендуется брать в следующих случаях:
— при ожогах, занимающих большую площадь поверхности тела пациента;
— при выраженном ожирении пациента;
— при установленной склонности к венозному тромбозу;
Применение ватных тампонов и других волокнистых материалов не рекомендовано, поскольку это приводит к засорению волокнами счетных и гемоглобиновой камер. В результате точность и воспроизводимость измерения падает.
Первую каплю крови, полученную после прокола кожи, следует удалить тампоном, поскольку эта капля содержит примесь тканевой жидкости. Капли крови должны свободно вытекать, нельзя давить на палец и массировать зону вокруг прокола, так как при этом в кровь попадает тканевая жидкость, что существенно искажает результаты исследования. После взятия крови к раневой поверхности прикладывается новый стерильный тампон, смоченный 70 град. спиртом. Тампон следует удерживать, пока не прекратится кровотечение.
При прикосновении края пробирки к месту пункции капли крови начинают стекать в нее под действием капиллярного эффекта. После завершения сбора крови пробирку следует плотно закрыть. Необходимым условием для обеспечения качественной пробы является ее обязательное немедленное перемешивание с антикоагулянтом осторожным переворачиванием пробирки до 10 раз. В случае последовательного взятия капиллярной крови в несколько микропробирок необходимо соблюдать определенный порядок их заполнения. Последовательность взятия крови такова: в первую очередь заполняются пробирки с ЭДТА, затем с другими реактивами и в последнюю очередь заполняются пробирки для исследования сыворотки крови.
Основные рекомендации при работе с капиллярной кровью:
— При взятии крови в пробирку с антикоагулянтом не допускается стекание крови по коже пальца, стенке пробирки и любой другой поверхности, так как мгновенно происходит контактная активация прогресса свертывания.
— Кровь самотеком из прокола должна попадать прямо в антикоагулянт, перемешиваясь с ним.
— Нельзя выдавливать кровь из пальца во избежание спонтанной агрегации тромбоцитов и попадания в пробу большого количества межтканевой жидкости (тканевого тромбопластина).
Следует отметить, что при взятии капиллярной крови возможен ряд особенностей, которые бывает весьма трудно стандартизировать:
Все это приводит к значительным разбросам в получаемых результатах и, как следствие, к необходимости повторных исследований для уточнения результата.
Доставка, хранение и подготовка проб к исследованию
Для обеспечения качественного результата исследований нужно четко контролировать время и условия хранения проб до выполнения анализа.
— Непосредственно после взятия крови исключается возможность спонтанной агрегации тромбоцитов, примерно 25 мин. необходимо для адаптации тромбоцитов к антикоагулянту. При анализе, проведенном позже чем через 6-8 часов после взятия образца, уменьшается достоверность результатов. Более продолжительное хранение крови не рекомендуется, т.к. изменяются некоторые характеристики клеток (сопротивляемость клеточной мембраны), снижается объем лейкоцитов, повышается объем эритроцитов, что в конечном итоге приводит к ошибочным результатам измерения и неправильной интерпретации результатов. Только концентрация гемоглобина и количество тромбоцитов остаются стабильными в течение суток хранения крови.
— Кровь нельзя замораживать. Капиллярную кровь с ЭДТА следует хранить при комнатной температуре и анализировать в течение 4 часов после взятия.
— Непосредственно перед исследованием кровь должна быть тщательно перемешана в течение нескольких минут для разведения антикоагулянта и равномерного распределения форменных элементов в плазме. Длительное постоянное перемешивание образцов на ротомиксе до момента их исследований не рекомендуется вследствие возможного травмирования и распада патологических клеток.
— Исследование крови на приборе проводится при комнатной температуре. Кровь, хранившуюся в холодильнике, необходимо вначале согреть до комнатной температуры, так как при низкой температуре увеличивается вязкость, а форменные элементы имеют тенденцию к склеиванию, что, в свою очередь, приводит к нарушению перемешивания и неполному лизису. Исследование холодной крови может быть причиной появления «сигналов тревоги» вследствие компрессии лейкоцитарной гистограммы.
— Приготовление мазков крови рекомендуется делать не позднее 1-2 часов после взятия крови.
При выполнении гематологических исследований на значительном удалении от места взятия крови неизбежно возникают проблемы, связанные с неблагоприятными условиями транспортировки. Тряска, вибрация, постоянное перемешивание, нарушения температурного режима, возможные проливы и загрязнения проб могут оказывать существенное влияние на качество анализов. Для устранения этих причин при перевозках пробирок с кровью рекомендуется использовать герметично закрытые пластиковые пробирки (BD Vacutainer (R) производства компании «Becton Dickinson», Deltalab, Sarstedt) и специальные транспортные изотермические контейнеры (фирма «Гем»).
Влияние преаналитических факторов, зависящих от пациента
На результаты гематологических исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма пациента. Изменения клеточного состава периферической крови наблюдаются не только при различных заболеваниях, они также зависят от возраста, пола, диеты, курения и употребления алкоголя, менструального цикла, беременности, физической нагрузки, эмоционального состояния и психического стресса, циркадных и сезонных ритмов; климатических и метеорологических условий; положения пациента в момент взятия крови; приема фармакологических препаратов и др. Так, например, число эритроцитов и концентрация гемоглобина у новорожденных выше, чем у взрослых. С увеличением высоты над уровнем моря значительное повышение наблюдается для гематокрита и гемоглобина (до 8% на высоте 1400 м). Физические упражнения могут приводить к существенным изменениям числа лейкоцитов, обусловленным гормональными сдвигами. У больных при переходе из положения лежа в положение стоя показатели гемоглобина и число лейкоцитов могут увеличиваться на 6-8%, а показатели гематокрита и число эритроцитов возрастать на 15-18%. Этот эффект обусловлен переходом жидкости из сосудистого русла в ткани в результате повышения гидростатического давления. Выраженная диарея и рвота могут приводить к значительной дегидратации и гемоконцентрации. После регидратации наблюдается снижение гемоглобина и гематокрита, что может быть ошибочно принято за кровопотерю.
Для устранения или сведения к минимуму влияния этих факторов кровь для повторных анализов необходимо брать в тех же условиях, что при первом исследовании.
Автоматизированное исследование клеток крови
Автоматические счетчики крови оценивают размеры, структурные, цитохимические и другие характеристики клеток. Они анализируют около 10000 клеток в одном образце и имеют несколько различных каналов подсчета клеточных популяций и концентрации гемоглобина. На основании количества определяемых параметров и степени сложности их можно условно разделить на 3 основных класса:
В основе работы анализаторов I-го класса лежит кондуктометрический метод. Анализаторы II и III-го классов используют в своей работе комбинации разных методов.
Кондуктометрические гематологические анализаторы
Если в один и тот же момент в канале находятся две клетки, они регистрируются в виде одного импульса, что приведет к ошибке подсчета клеток. Во избежание этого, проба крови разводится до такой концентрации, при которой в канале датчика всегда будет не больше одной клетки.
Апертуро-импедансный метод позволяет определять большинство эритроцитарных и тромбоцитарных показателей, связанных с объемом клеток (НСТ, MCV, МСН, МСНС, MPV), а также является основой для дифференцировки лейкоцитов по трем параметрам.
Подсчет эритроцитов и тромбоцитов, расчет величины гематокрита, эритроцитарных и тромбоцитарных индексов
Устройство, которое разделяет импульсы по величине амплитуды, называется дискриминатор. В современных анализаторах применяются многоканальные дискриминаторы, позволяющие получить детальную информацию о размерах клеток в виде гистограмм, поскольку каждый канал соответствует определенному объему клеток.
Поскольку в норме концентрация эритроцитов в крови на 3 порядка превышает концентрацию лейкоцитов, то вклад лейкоцитов в общее количество подсчитываемых клеток пренебрежимо мал по сравнению с эритроцитами, поэтому в некоторых анализаторах за количество эритроцитов принимают общее подсчитанное количество клеток. Такое допущение справедливо, за исключением случаев явных лейкоцитозов.
Подсчет и дифференцировка лейкоцитов
Определение количества лейкоцитов возможно только после лизиса эритроцитов. Эта задача оказалась легко решаемой, так как свойства мембран эритроцитов и лейкоцитов существенно различаются. Эритроциты легко лизируются под воздействием многих поверхностно-активных веществ, при этом лейкоциты, хотя и претерпевают некоторые изменения, остаются целыми. Поэтому при подсчете лейкоцитов, прежде чем пропустить разведенную суспензию крови через апертуру датчика, к ней добавляют лизирующий раствор или гемолитик, эритроциты разрушаются до очень мелких фрагментов, которые при подсчете лейкоцитов генерируют электрические импульсы очень низкой амплитуды, не влияющие на результат анализа.
Разделение неизмененных лейкоцитов кондуктометрическим методом на основные субпопуляции невозможно в виду близости их объемов, однако можно подобрать такую композицию растворителя и гемолитика, что различные формы лейкоцитов претерпевают изменения размеров в разной степени и, благодаря этому, могут разделяться данным методом. Изменение объема клетки зависит от многих факторов, включающих величину и форму ядра, объем цитоплазмы, наличие внутриклеточных включений и т.д., поэтому размер трансформированных клеток не соответствует размерам клеток при визуальном просмотре их в окрашенном мазке крови (таблица 1)
| Соотношение размеров клеток в окрашенных мазках крови и в приборах после обработки их лизирующим реагентом | ||
| Тип клеток | Размер клеток при визуальном анализе мазков крови | Размер клеток после обработки лизатом |
| Лимфоциты | малый | малый |
| Базофилы | средний | средний, малый |
| Эозинофилы | средний | средний, большой |
| Моноциты | наибольший | средний |
| Нейтрофилы | средний | большой, средний |
| Патологические формы клеток | различный | различный |
| Дальнейшая идентификация патологических форм клеток проводится визуально | ||
— Область малых объемов (35-90 фл) формируется лимфоцитами, которые под действием гемолитика значительно уменьшаются в объеме.
— Гранулоциты (нейтрофилы, базофилы и эозинофилы), напротив, подвергаются небольшому сжатию и расположены в области больших объемов (120-400 фл).
— Между двумя пиками имеется зона так называемых «средних лейкоцитов» (90-120 фл), которая лучше всего коррелирует с моноцитами (по этой причине в некоторых анализаторах клетки в этой области указываются как моноциты). Однако, учитывая тот факт, что коэффициент корреляции с моноцитами R = 0,5-0,8 сравнительно невысок, более корректным является название параметра «средние лейкоциты» или «средние клетки» (MID). Практически в область средних клеток могут частично попадать базофилы, эозинофилы, различные патологические формы.
Высокотехнологические гематологические анализаторы
Высокотехнологические гематологические анализаторы способны осуществлять дифференцированный счет лейкоцитов по 5-ти (5Diff) основным популяциям, используя различные принципы дифференцирования клеток: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, оценивать наличие незрелых гранулоцитов, анализировать ретикулоциты и их субпопуляции, проводить оценку стволовых гемопоэтических клеток и субпопуляций лимфоцитов. Многочисленные функции современных гематологических анализаторов стали возможны, благодаря развитию новых технологий, которые отличаются у разных фирм-производителей.
— для оценки клеточной зернистости и дифференцировки эозинофилов используется оценка светорассеивания деполяризованного луча под углом в 90 град.
Сравнивая информацию, получаемую с Perox- и Baso-каналов, компьютер осуществляет дифференцировку лейкоцитов на 5 основных популяций, а также сигнализирует в виде флагов о присутствии в крови активированных лимфоцитов, незрелых гранулоцитов, бластов, эритробластов.
3. Детекция специфического флюоресцентного сигнала (SFL), которая регистрируется также как боковое светорассеивание под углом 90 град. и позволяет судить о содержании РНК/ДНК в клетках.
Кроме того, приборы оборудованы каналом для выделения незрелых гранулоцитов и атипичных лимфоцитов.
Таким образом, использование приборов с полным дифференцированным подсчетом лейкоцитов (5Diff) позволяет повысить точность дифференциального подсчета лейкоцитов, провести скрининг нормы и патологии, динамический контроль за лейкоцитарной формулой и резко сократить ручной подсчет лейкоцитарной формулы, оставляя примерно до 15-20% образцов крови для световой микроскопии.
В классическом гемиглобинцианидном методе (метод Драбкина) +2 +3 Fe гемоглобина окисляется до Fe метгемоглобина феррицианидом, затем метгемоглобин переводится в стабильный цианметгемоглобин цианидом. Оптическая плотность CNmetHb измеряется при 540 нм, при которой имеется максимум поглощения. Гемиглобинцианидный метод рекомендован Международным комитетом по стандартизации в гематологии Всемирной Организации Здравоохранения и используется в мировой практике более 30 лет.
В гематологических анализаторах к методам определения гемоглобина предъявляется ряд специфических требований. Во-первых, время реакции должно быть в десятки раз меньше для обеспечения высокой производительности анализаторов. Во-вторых, для оптимизации конструкции анализаторов гемоглобин должен измеряться в том же гемолизате, который используется для подсчета лейкоцитов, и, следовательно, компоненты, обеспечивающие гемоглобиновую реакцию, не должны негативно влиять на подсчет лейкоцитов.
Многие гематологические анализаторы измеряют концентрацию гемоглобина модифицированным гемиглобинцианидным методом. Высокая
скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью
поверхностно-активных веществ. Последующая реакция с цианидом формирует устойчивую форму со спектром поглощения, похожим на
спектр гемиглобинцианида в методе Драбкина, и максимумом поглощения около 545 нм. Достоинством метода является его простота, высокая скорость реакции и стабильность конечного продукта. Применение циановых методов в гематологических автоанализаторах имеет два существенных недостатка, связанных с тем, что цианид из флаконов постепенно выпаривается в виде синильной кислоты. Во-первых, это может оказывать вредное воздействие на персонал при плохой вентиляции помещения. Во-вторых, это приводит к ухудшению реакции и изменению калибровки по гемоглобину через 2-3 месяца после подсоединения к прибору флакона с гемолитиком.
Учитывая недостатки модифицированных гемиглобинцианидных методов, в последние годы в большинстве новых моделей гематологических анализаторов используются бесциановые методы. Одной из первых бесциановый SLS (натрий лаурил сульфат)-метод использовала фирма Sysmex. Этот метод оказался не совместимым с определением лейкоцитов в одном канале, для его реализации используется дополнительный реагент и канал измерения.
В других современных бесциановых методах используются компоненты гемихромной реакции, которые совместимы с подсчетом лейкоцитов и их дифференциацией на три популяции. Высокая скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью окислителей в присутствии поверхностно-активных веществ. При этом в качестве лигандов атомов железа гема используются отличные от цианида вещества.
Качество результатов исследования крови на гематологическом анализаторе определяется следующими факторами:
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при проведении процедуры разведения крови;
— точностью определения объема суспензии, пропущенного через датчики подсчета клеток;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерений.
Во избежание случаев несовместимости реагентов следует использовать изотонический раствор и гемолитик от одного изготовителя. При смене реагентов одного производителя на реагенты другого производителя необходимо проверить калибровку анализатора по контрольной крови, обращая особое внимание на Hb и MCV/HCT, и при необходимости нужно делать перекалибровку этих показателей. Калибровка других показателей, как правило, не меняется.
Периодически необходима калибровка по стандартным материалам, так как электронные и механические компоненты прибора, датчиков, насосов и т.д. со временем подвергаются старению и меняют свои технические параметры. Для осуществления калибровки необходимо пользоваться только качественными контрольными материалами!
Гематологические анализаторы очень чувствительны к длительным отключениям и перебоям в работе, что связано с подсыханием шлангов, проростом микрофлоры, кристаллизацией из растворов. При длительной остановке (на период отпуска, переезда или отсутствия реагентов) обязательным является заполнение шлангов консервирующими растворами с последующей многократной отмывкой от них.
Автоматизированные гематологические анализаторы, поставляемые в КДЛ в рамках Приоритетного национального проекта «Здоровье»
Для оснащения клинико-диагностических лабораторий поликлиник предпочтение отдано автоматизированным гематологическим анализаторам, работа которых основана на кондуктометрическом методе, который позволяет получить до 18 параметров крови с определением трех популяций лейкоцитов (лимфоциты, клетки средних размеров, гранулоциты).
При использовании такого анализатора определяют:
— RBC (количество эритроцитов)
— HGB (концентрация гемоглобина)
— MCV (средний объем эритроцита)
— МСН (среднее содержание гемоглобина в эритроците)
— МСНС (средняя концентрация гемоглобина в эритроците)
— RDW (ширина распределения эритроцитов по объему)
— PLT (количество тромбоцитов)
— MPV (средний объем тромбоцита)
— PDW (ширина распределения тромбоцитов по объему)
— WBC (количество лейкоцитов)
Гистограммы (распределение клеток по объему)
Автоматизированный гематологический анализатор MEK-6400J/K
В приборе существует пять режимов разведения: нормальный, режим низкого, высокого и очень высокого разведения, режим предварительного разведения.
В нормальном режиме разведения измеряется образец объемом 30 мкл.
Для режимов измерения крови с предварительным разведением можно указать объем исследуемой крови (10 или 20 мкл). Этот режим удобен при работе с малым объемом крови, особенно у детей и пожилых людей.
При наличии лейкоцитоза образец крови может быть измерен в режиме высокого или более высокого разведения. В режиме высокого разведения образец крови объемом 10 мкл разводится втрое больше обычной пропорции разведения. В режиме более высокого разведения 5 мкл образца крови разводится в пропорции, в шесть раз большей обычной пропорции разведения.
В случаях низкого содержания в крови лейкоцитов и тромбоцитов образец измеряется в режиме низкого разведения, при котором 55 мкл крови разводится в пропорции, вдвое меньшей обычной пропорции. Пересчет с высоким/низким разведением недоступен для образцов в режиме предварительного разведения.
Прибор снабжен системой закодированных флагов, которые появляются на экране при наличии отклонений в измерении или изменении гистограмм распределения клеток. Следует внимательно изучить названия флагов, т.к. они помогают определить возможные причины их появления. Помимо количественных характеристик клеток крови в анализаторе отображается распределение клеток по объему в виде гистограмм, анализ которых имеет диагностическое значение.
Уважаемые коллеги!
Все методические рекомендации, пособия и т.д. интеллектуальная собственность авторов, Ассоциации и являются архивными материалами разных лет!!