что такое молекула белка
Что такое молекула белка
Белки — это высокомолекулярные соединения (биополимеры), мономерами которых яв ляются аминокислоты, соединенные пептидными связями.
Аминокислотой называют органическое соединение, имеющее карбоксильную и амино группу, а также радикал. В природе встречается около 200 аминокислот, которые различаются взаимным расположением функциональных групп и радикалами, но только 20 из них входят в состав белков. Такие аминокислоты называют протеиногенными.

Не все протеиногенные аминокислоты могут синтези роваться в организме человека. Аминокислоты, которые образуются в организме человека в необходимом коли честве, называют заменимыми (их насчитывается 12), а аминокислоты, которые не синтезируются и должны поступать с пищей, — незаменимыми (8). К незамени мым аминокислотам относят валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин.
Уровни структурной организации белка.
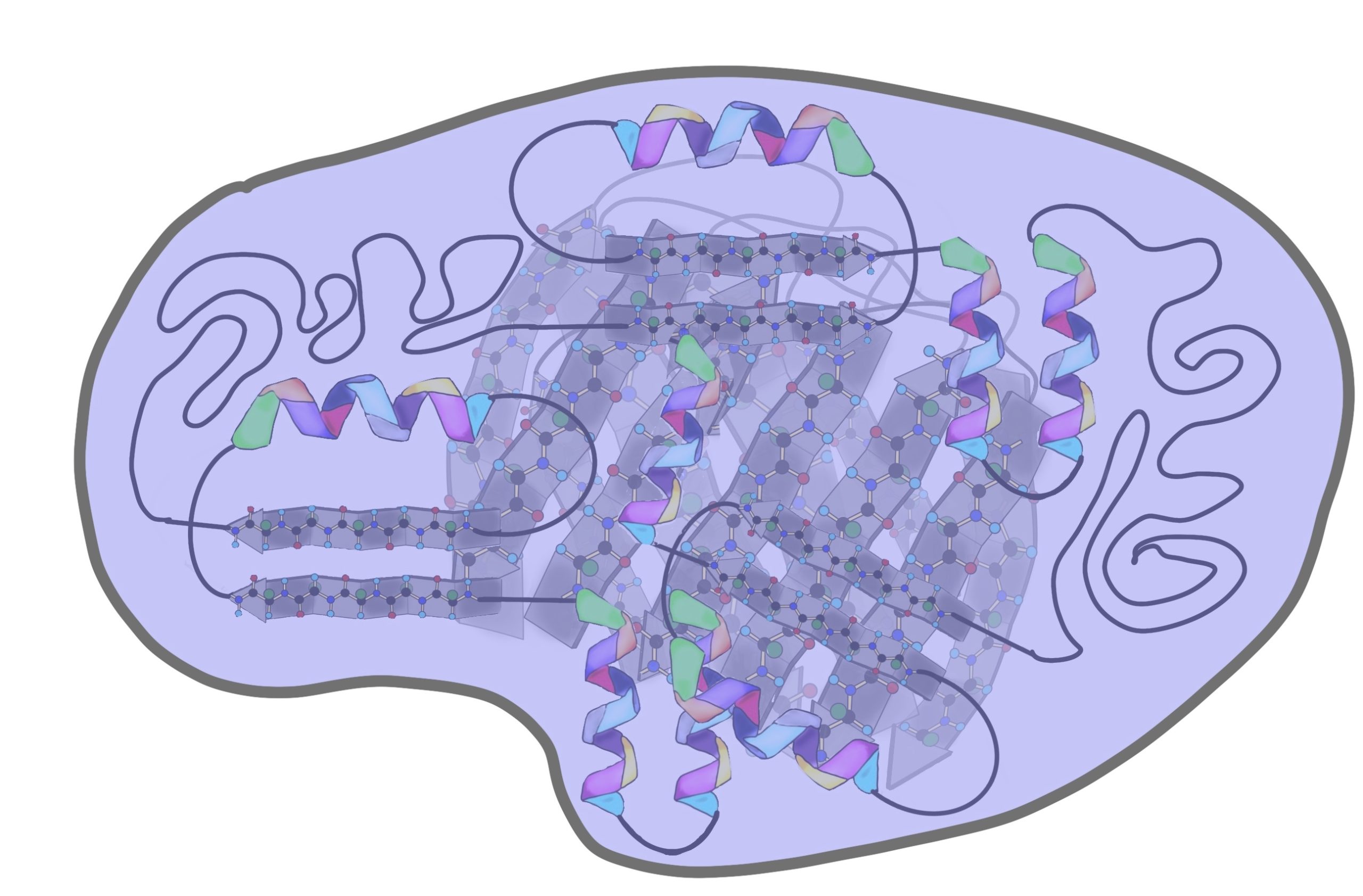
У белков различают первичную, вторичную, третичную и четвертичную структуры.
Первичная структура белка — это последовательность аминокислот, соединенных пептидной связью. Особенности аминокислотного состава белка обусловливают его пространственную укладку — возникновение вторичной и третичной структур. Изменение расположения хотя бы одной аминокислоты в первичной структуре влечет за собой измене ние более высоких структур, а также свойств белка в целом.
Вторичная структура представляет собой упорядоченную пространственную структуру белковой молекулы в виде спиралей или складок, поддерживаемых водородными связями, которые возникают между атомами кислорода и водорода. Болееменее длинные участки со вторичной структурой имеют, например, кератины волос и ногтей, фиброин шелка.
Четвертичная структура — это про странственная организация нескольких глобул, которая поддерживается слабы ми взаимодействиями (гидрофобными, ионными, водородными и др.). Четвертичная структура характер на для гемоглобина и хлорофилла.
По форме молекулы различают фи бриллярные и глобулярные белки. Первые из них вытянуты, как, например, колла ген соединительной ткани или кератины волос и ногтей. Глобулярные же белки имеют форму глобулы, как миоглобин мышц.
Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую. Строительная функция белков связана с их наличи ем в клеточных мембранах и структурных компонентах клетки. Энергетическая обусловлена тем, что при расщеплении 1 г белка высвобождается 17,2 кДж энер гии. Белки — рецепторы мембран принимают участие в восприятии сигналов окружающей среды и их пе редаче в клетке, а также в межклеточном узнавании. Без белков невозможно движение клеток и организмов в целом. Они составляют основу жгутиков и ресничек, а также обеспечивают сокращение мышц и перемеще ние внутриклеточных компонентов. В крови человека и многих животных белок гемоглобин переносит кисло род и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана с иммунитетом: белок интерферон способен уничтожать многие вирусы, а белкиантитела участвуют в иммун ных реакциях. Среди белков и пептидов есть регулято ры, например, гормон поджелудочной железы, инсулин, регулирующий концентрацию глюкозы в крови. У неко торых организмов белки могут откладываться в запас, как у бобовых в семенах, или у птиц и пресмыкающихся в яйцах.
Белок
Многие знают, что спортсмены должны употреблять в пищу белок – есть мясо, рыбу, яйца, и даже принимать специальные протеиновые добавки. Но зачем нужен белок, да еще в таких количествах? Разве вегетарианцы не доказали своим примером, что можно обходиться без белка? Давайте разбираться.
Что такое белок?
Белок – это большая группа сложных химических соединений. Видов белка существует очень много и каждый в организме выполняет свои функции. Из белков строятся ткани организма, белки переносят питательные вещества, включают и выключают различные реакции, ускоряют или замедляют те или иные обменные процессы. Без белков само существование нашего организма было бы невозможно.
Структура белков
Белки (полипептиды, протеины) — своего рода биологические полимеры природного происхождения. Они образованы из множества (более 50) молекул альфа-аминокислот, объединенных пептидными связями (-CONH-). В синтезе белков в живых организмах принимают участие всего 20 различных аминокислот, называемых протеиногенными (глицин, лейцин, изолейцин, валин, глютамин, аргинин и т.п.).
Молекулы белков очень сложны, они нередко закручены в пространственные спирали, которые в свою очередь, тоже переплетаются, образуя сложнейшие структуры. Таковы, к примеру, молекулы одного из самых распространенных белков – коллагена – составляющего основу кожи, сухожилий, сосудов, хрящей и т.д. Именно благодаря такой сложной структуре белков кожа, сухожилия и сосуды являются эластичными и упругими.
Зачем белок организму?
Из белковых молекул в организме состоит решительно все — они составляют основу мышечных, нервных волокон, сосудов, кожи, ногтей, зубов, волос, крови и т.д. Белки — это и строительные кирпичики организма, и такие важные для его функционирования вещества как гормоны, ферменты, антитела. Роль белков в существовании живых организмов настолько велика, что Энгельс даже жизнь назвал «способом существования белковых тел».
Организм строит белки сам, но ему требуется большое количество материала для этого – именно поэтому в пище должно быть достаточно белка: это облегчает организму работу, а кроме того, некоторые аминокислоты, называемыми незаменимыми (лейцин, изолейцин, валин, метионин, триптофан и др.) организм не может создать сам, их требуется получать из пищи, а без них синтез белков невозможен.
Функции белков
Чтобы четко и полно ответить на вопрос, зачем белок организму, можно кратко перечислить задачи, выполняемые в нашем организме белками:
Уже из этого краткого списка хорошо видно, что функции белков поистине всеобъемлющи, и что белки являются одним из самых важных классов веществ, определяющих само существование организма.
Синтез белков в организме
Как мы уже говорили, наш организм сам синтезирует все необходимые белки. Но для синтеза белков, который обеспечит потребности организма, нужны строительные материалы, которые дают белки из состава пищи. И важнейшими являются 8 незаменимых аминокислот, которые больше неоткуда получить, кроме как из пищи. Поэтому неправильно думать, что, к примеру, вегетарианцам не нужен белок. Белок нужен всем, просто вегетарианцы предпочитают получать его из растительных источников.
А растительные белки в большинстве случаев обладают более низкой пищевой ценностью, чем животные – просто потому, что они имеют другую природу. Из-за этого у них аминокислотный состав, хуже подходящий человеку, а также их труднее усваивать. Но тем не менее, комбинируя растительные белки, можно повысить их ценность и усваиваемость.
Для синтеза белков (который активизируется в периоды восстановления после болезней, травм и спортивных тренировок) нужны все незаменимые аминокислоты, но, к примеру, для роста мышц важнее всего BCAA – лейцин, изолейцин и валин.
А для восстановления суставов и сохранения здоровья кожи очень важен белок коллаген, необходимая скорость синтеза которого обеспечивается в том числе поступлением его вместе с пищей.
Какой белок лучше употреблять при тренировках?
Раз уж мы затронули вопрос об усвоении белков и о возрастающих потребностях в белке при спортивных тренировках, то можно вспомнить, что в магазинах спортивного питания представлены белки самых разных видов.
Для спортсмена белок — это, во-первых, основной субстрат его мышечной ткани, которую он старается всячески совершенствовать, а, во-вторых, источник питания той самой ткани. По-другому белок называется протеин. И, собственно, протеин и есть первый и основной компонент спортивного питания. По сырью из которого он изготовлен, различают сывороточный протеин, казеин, яичный, соевый, мясной и т.д. По степени очистки — концентрат (ок. 80 % белка), изолят (более 85 % белка) и гидролизат. Но гидролизат — скорее уже не столько степень очистки, сколько частично разрушенный ферментами изолят протеина, который состоит уже не из цельных молекул белка, а из фрагментов по 2-3 связанные аминокислотные молекулы. Усваивается он быстрее всего, зато и самый дорогой.
Сырье, из которого получают протеин, определяет его аминокислотный состав, от чего зависит скорость усвоения данного вида белка и другие особенности. Кроме того, важны цели, которые ставит перед собой атлет и личные особенности его организма — кто-то лучше усваивает молочный протеин, а кто-то — соевый.
Белок, получаемый из обычной пищи (творог, мясо, рыба, орехи, горох и фасоль) является основным питательным сырьем для организма. И только когда его перестает хватать — при усиленных тренировках и стремлении увеличить достигнутые результаты (силовые показатели или рельеф) — можно принимать протеин дополнительно. О спортивном питании для набора массы, а также о видах протеина читайте в других наших статьях.
Какой белок лучше выбрать, зависит от индивидуальных особенностей и задач. Например, для быстрого усвоения перед тренировкой и подавления катаболизма мышц сразу после обычно выбирают сывороточный протеин. Для питания мышц в течение длительных перерывов (например, ночью или в дороге) – хорошо подходит казеин. Вегетарианцы выбирают соевый, гороховый или рисовый протеин. Комплексный протеин обеспечивает равномерное поступление аминокислот в организма в течение долгого времени.
По цене самым демократичным является концентрат, изолят содержит больше белка, но небольшая разница в содержании белка не всегда покрывается существенной разницей в цене. Гидролизат усваивается быстро и легко, но стоит весьма дорого.
Сколько в сутки нужно употреблять белков?
Обычно медицинская норма для среднего человека находится в пределах 0,7-1 г на каждый килограмм собственного веса. Тем, кто занят тяжелым физическим трудом или интенсивными спортивными тренировками, рекомендуют увеличить норму до 1,5-2 г на кг и даже более. Для спортсмена массой 90 кг это составляет 135-180 г белка в сутки. Конечно же, желательно получить это количество из обычной пищи, но, к сожалению, это не всегда возможно. Например, в мясных продуктах содержание белка редко превышает 20 %, а в крупах – 10 %. Орехи содержат больше белка, но они также богаты жирами, поэтому употреблять их в больших количествах не стоит. В бобовых белок менее полноценный, поэтому его требуется больше. Учитывая все это, хорошим выходом становится употребление белковой добавки, дозировку которой рассчитывают, исходя из разницы между требуемым количеством белка и тем количеством которое вы реально можете получить из пищи. Например, спланировав рацион, вы понимаете, что он дает вам 150 г белка, а вам нужно 180 г. Добавив между основными приемами пищи порцию протеинового коктейля, вы легко доберете оставшиеся 30 г.
Те, кто не знает, сколько в сутки употреблять белков, могут воспользоваться простейшей формулой БЖУ 30-20-50. То есть в суточной калорийности доля белков должна составлять не менее 30 %. Если вам приходится урезать суточный калораж, например, при расчете диеты для похудения – старайтесь делать это не за счет белков и жиров, а за счет углеводов. Урезать белки не следует потому, что иначе пострадают ваши мышцы. Для их поддержания требуется определенное количество белка, и если его будет меньше – организм просто сократит мышечную массу до приемлемого (для него) уровня. Ну а потеря мышц обернется физической слабостью, а также плоским костлявым видом фигуры. Если вы этого не хотите – сохраняйте максимальное количество белков в рационе.
Есть ли вред от белка?
Иногда приходится слышать, что белок засоряет организм шлаками, нагружает печень и почки и т.д. Все это не совсем верно. Сам по себе белок – хорошо знакомый для организма тип веществ и нормально переваривается. Необходимо лишь поддерживать разумное количество его в рационе, и если вы употребляете много белка (например, из-за тренировок), то пейте больше воды, чтобы продукты его распада не накапливались, а легко выводились из организма.
Никаких данных о том, что нормальное количество белка как-то особенно вредит внутренним органам не существует. Напротив, есть масса научных исследований, подтверждающих необходимость употребления нормативного количества белка – для сохранения здоровья и роста спортивных показателей.
Строение и функции белков. Денатурация белка
Перед тем, как начать разбираться со строением белка и его функциями нужно кое-что прояснить. А что вообще такое белок? Как организм создает такое многообразие белков, если имеет ограниченный запас аминокислот?
Белок — это полимерная молекула, которая состоит из молекул поменьше — мономеров. Мономеры для белка — аминокислоты, которые соединяются между собой пептидными связями. Но здесь появляется вопрос, а сколько аминокислот нужно соединить между собой для того, чтобы получить белок? Больше 50. Если их будет меньше, то такая молекула называется пептид.
Все аминокислоты соединяются друг с другом в определенной последовательности, которая уникальна для каждого белка. Кто это контролирует? ДНК — ведь она и кодирует все эти аминокислоты. Ну а теперь можем начинать разбираться со структурой.
Первичная структура белка
Представляем себе огромную цепь, которая состоит из кучи звеньев. Такой же вид у первичной структуры белка — это просто полипептидная цепь, которая включает в себя аминокислоты. Их всего 20 штук. Но представьте себе сколько комбинаций можно сделать с этими 20 аминокислотами, соединяя их в разных последовательностях? Правильно, бесконечное множество.
Теперь посмотрим на молекулу поближе. Можно увидеть, что у этой большой молекулы есть свободная аминогруппа — N-конец, и свободная карбоксильная группа — C-конец. Молекулу всегда рисуют с N-конца и заканчивают C-концом.
Все остальные аминокислоты связаны друг с другом пептидной связью. Сумма всех пептидных связей — это пептидный остов. В него не входят радикалы, N-концы и C-концы. Будет понятнее, если я нарисую всё в одну линию.
В первичной структуре есть только пептидные связи
Важный момент! Первичная структура определяет какими будет вторичная, третичная и четвертичная (если такая есть) структуры. Это как мини-ДНК для белковой молекулы. Но я об этом еще напомню, даже несколько раз, вот такая я зануда.
Вторичная структура белка
Ну что, а теперь давайте усложнять все! Что можно сделать с цепью, которую мы рассмотрели до этого? Может закрутим цепь вокруг чего-то? Или просто растянем ее вдаль? Можно даже растянуть цепь и повернуть ее обратно, чтобы начало и конец были в одном месте. Что вам больше нравится?
Какой бы вариант не выбрали — он верный, но все зависит от того, какой тип вторичной структуры будет у белка. Напоминаю, что это определяется первичной :]
1. Альфа-спираль
Это для ребят, которые выбрали закрутить цепь вокруг чего-то. Правда закручивается она вокруг самой себя. В этой цепи происходит образование водородной связи между кислородом (карбоксильного атома углерода) и водородом (связан с азотом).
Далековато как-то. Как так выходит? Все из-за того, что происходит закручивание пептидного остова. Сделаем такую же картинку как сверху, но в виде атомов. Не забудем крутануть её немного…
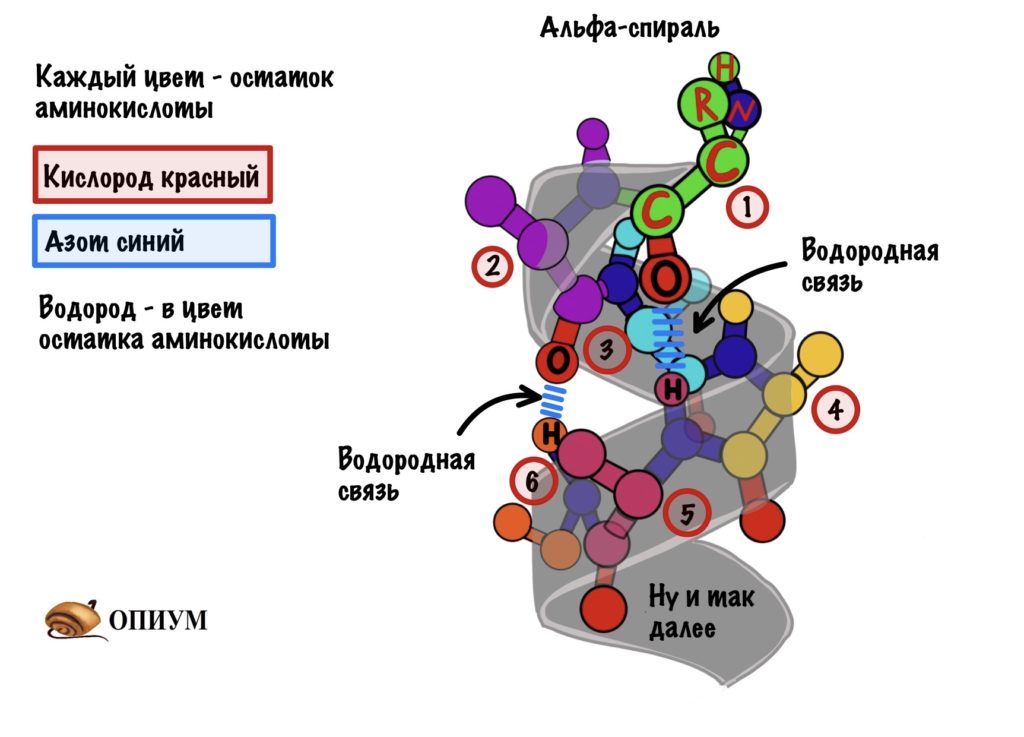
Каждый цвет — это остаток аминокислоты, только азоты и кислороды я оставил одного цвета, а то запутаемся ещё. Ещё альфа-углерод тут трех валентный и все атомы отмечать не стал, а то слишком громоздко получается. Думаю, что смысл понятен.
Какой сделаем вывод? Альфа-спираль похожа на корсет. Правда вместо него — водородные связи, которые стягивают её. Если присмотреться к радикалам, то они выглядывают как иголки из ёлки в разные стороны. Вот рисунок попроще.
Ой, а вы, наверное, ждали какой то супер крутой рисунок? А я тут такое подсунул, ладно держите вот немного получше. Правда он без радикалов и водородных связей. Но здесь лучше видно, что на один виток спирали приходится 3,6 аминокислотных остатка.
Альфа-спираль, конечно, очень красивый вариант, но он не всегда образуется. Есть аминокислоты, которые могут помешать этому:
Пролин. В его молекуле находится жесткое кольцо, которое всегда вызывает поворот. Такая уж у него структура. Если вставить его в альфа спираль, то произойдет поворот на 180 градусов. Ещё у пролина нет свободного водорода у азота. Получается, что он не может образовывать водородную связь, которая так важна для альфа-спирали.
Глицин. Если пролин слишком жесткий, то глицин, наоборот, очень гибкий. У него ведь нет радикала, поэтому если вставить слишком много глицинов, то прощай альфа-спираль. Иногда из-за него тоже происходит поворот молекулы на 180 градусов — прямо как на картинке выше.
Аминокислоты с большими радикалами. Большие радикалы круто, но если они будут расположены рядом, то это может помешать формированию альфа-спирали. Они просто мешают друг другу.
И последнее, одинаково заряженные аминокислоты. При одинаковом заряде они отталкиваются допустим: рядом расположены лизин и аргинин, или аспартат и глутамат. Ну и другие комбинации.
Если в полипептидной цепи много включений с такими радикалами, то чаще всего образуется…
2. Бета-складчатый слой
Здесь молекула будет похожа на лист, который состоит из нескольких тяжей. А они похожи на горки из игры Gravity defied. Хотя кому я это говорю….
Ладно, давайте просто посмотрим на рисунок, а лучше на два — один сбоку, а другой сверху. Что видим? Один тяж с горками, которые идут то вверх, то вниз. Радикалы аминокислот расположены над или под плоскостью листа.
Теперь можно составить из тяжей бета-складчатый слой. Здесь, как всегда, несколько вариантов. Первый вариант — параллельный лист, тогда направление тяжей одинаковое. Если оно разное, то он антипараллельный. Стабилизируется этот лист тоже с помощью водородных связей, прямо как альфа-спираль. Только вот есть один нюанс. Если в альфа-спирали есть четкая зависимость образования связей — через 4 аминокислотных остатка, то здесь такого нет. Например, водородными связями могут соединяться 5 остаток и 22.
Когда мы разбирали альфа-спираль, то сказали что пролин и иногда глицин вызывают поворот на 180 градусов. У этого есть свое название: бета-поворот.
3. Беспорядочный клубок
Это последний вариант. Здесь нет никаких спиралей или бета-складчатости, просто получается вот такая белиберда.
Что общего у всех вторичных структур? В их образовании участвует только пептидный остов. Радикалы пока что отдыхают. Ну и второе:
Водородные связи стабилизируют вторичную структуру
Ой, а от чего зависит какую вторичную структуру примет молекула?
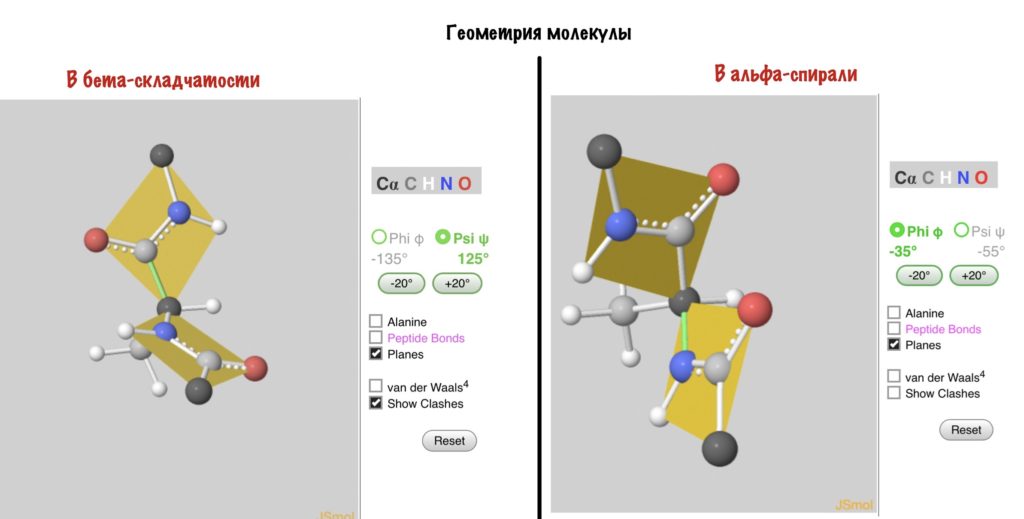
А действительно, почему какая-то молекула принимает форму альфа-спирали, а другая бета-складчатости? Хороший вопрос, и у меня есть ответ на него: от торсионных углов. Я разбирал это в прошлой статье — кликай сюда, а потом возвращайся. Так, мы говорили о том, что углы бывают разными, но для каждой вторичной структуры характерны строго определенные углы. Есть специальные карты Рамачандрана, на которых указаны эти углы — все данные получены экспериментально.
Здесь можно посмотреть как будут выглядеть молекулы аминокислот с такими углами. Но вот вам фоточка, если лень.
Надеюсь, что теперь понятно почему и как формируется вторичная структура. Ах да, конечно же, все эти углы определяются первичной структурой!
Супервторичная
структура белка
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Третичная структура белка
Вот этот уровень уже повыше, на нем белок начинает выполнять свою функцию — впахивать, как проклятый. Но сначала нужно остановиться ненадолго и поговорить. Спокойно, я же сказал — ненадолго.
Согласитесь, что у белков очень много функций. Какой-то переносит кислород, а другой входит в состав кости и обеспечивает ее прочность. Белки мышечной ткани вообще обеспечивают движение. Давайте попробуем выделить две глобальные, но не совсем верные, функции: структурная и связывания. Одни белки входят в структуру мышц, костей, волос и так далее. А другие что-то связывают: ферменты связываются с субстратом, а гемоглобин с кислородом. А где-то бравое антитело падает на амбразуру для того, чтобы не пропустить бактерию в организм. Это конечно все очень грубо, но пусть будет так.
И все это я к чему. Существует два больших класса белков: фибриллярные — коллаген, эластин, кератин. Эти ребята занимаются поддержкой, такие вот суппорты. Фибрилла — это нить. Так что они очень длинные, а когда огромное количество нитей связывается в одну, то они становятся очень прочными. Фибриллярные белки — это атланты, которые держат наш организм на своих плечах. А мы не особо благодарные ребята, потому что забьем на них. Но только в этой статье.
В основном биохимия занимается другим классом — глобулярными белками. Эти ребята не только связывают — у них огромное количество функций. С этими функциями и пытается разобраться биохимия. Глобула — шар. Вроде это все, теперь можем приступать.
На прошлом этапе мы собрали разные вторичные структуры в мотивы, ну а дальше то что? Теперь нам нужно скрутить все это в компактный шарик — глобулу. Здесь, наконец-то, пригодятся наши лентяи — радикалы. Вспоминаем, что радикалы бывают полярные и неполярные. Когда глобула скручивается, то она прячет гидрофобные остатки аминокислот внутрь этого шарика, а гидрофильные выставляет наружу. Оно и понятно, все-таки глобулы находятся в организме, а у нас почти везде вода.
Скручивание — удивительный процесс. Здесь начинают взаимодействовать очень (очень-очень!) отдаленные аминокислотные остатки. Представьте, что тридцатый остаток взаимодействует с триста семидесятым. При этом все настолько предопределено первичной структурой, что радикалы взаимодействуют максимально точно. А взаимодействий ведь не мало!
Кстати о них, какими они бывают:
Про все эти связи у меня есть статейка ;] Ещё раз сказу, что здесь взаимодействуют только радикалы.
Когда глобула сложилась в пространстве, то всю эту сложную структуру называют конформацией (получается, что конформация — это положение атомов друг относительно друга в пространстве). Есть еще кое-что интересное: посмотрите на связи, которые образуют эту структуру. Большая часть из них — это силы слабого взаимодействия между молекулами. Это значит, что они очень легко рвутся, даже простого повышения температуры на несколько градусов хватит для того, чтобы эти связи разорвались. Как выйти из такого положения такой большой молекуле? Дело в том, что таких связей настолько много, что существует конформационная лабильность. По сути это означает, что некоторые связи могут рваться, а другие тут же образовываться.
Какой можно сделать вывод из всего этого? Не стоит думать о третичной структуре белка, как о чем-то статичном. Представьте ее как дом, который меняет свой цвет при повышении или понижении температуры, еще он может менять свой размер в зависимости от того идет дождь или нет. Какой странный дом…. В таком долго не проживешь.
Некоторые участки глобулы такие чсвшники, что собираются отдельно от всей остальной молекулы. Эти части называются доменами. Домен собирается в мини-третичную структуру самостоятельно, их даже может быть несколько. Чаще всего они имеют какую-то важную задачу, например, входят в состав активного центра.
Строение активного центра
Стоп-стоп-стоп. Это тиво еще такое? Ты про это ничего не говорил. Точно, помните мы сказали, что с этого уровня белок начинает пахать? А задача глобулы — это связать что-то, опять же грубо. Так вот, как она все это делает? Да-да, через активный центр, такие вы умные конечно… В чем прикол активного центра? Он должен соответствовать молекуле, с которой будет взаимодействовать. Это называется комплементарностью. Не путать с комплиментами.
Активный центр — это замок, а другая молекула — ключ, которые должны подходить друг другу. Такие вот соулмейты. Хотя к некоторым активным центрам могут подходить много ключиков. Связи, которые образуются в активном центре — слабые: чаще всего ионные, водородные и Ван-дер-Вальсовы. Но иногда могут быть и ковалентными, но не будем забегать вперёд — об этом мы поговорим, когда будем разбирать ферменты.
Ну а теперь, как все это работает. В активном центре располагается уникальная последовательность аминокислот, допустим там будет две положительнозаряженных и две отрицательнозаряженных аминокислоты. А у молекулы, с которой происходит взаимодействие, будет: две отрицательных группы и две положительных. Форма молекулы совпадает с формой активного центра. Кстати, у молекулы, которая взаимодействует с активным центром тоже есть свое название — лиганд. Надоели уже эти названия? Мне тоже…
Ах, да — вся третичная структура определяется первичной…. Я знаю, что вы запомнили, но хочу немного понадоедать.
5 типов связей стабилизируют третичную структуру: водородные, гидрофобные, Ван-дер-Вальсовы, ионные и дисульфидные. Эти связи образуются между радикалами.
Четвертичная структура белка
Последняя, но самая большая! Не пугайтесь, только по размеру. Она есть не у всех белков, некоторые прекрасно работают в виде третичной структуры и не парятся. Но представьте, что мы возьмем несколько третичных структур и как соединим их вместе. Пусть их будет 4 штуки, берем 4 шарика и соединяем их. Получаем четвертичную, но не из-за того, что мы взяли 4 шарика….
Эти шарики комплементарны друг другу в участках связывания — не активный центр, но чем-то похоже. Таких участков связывания много, поэтому ошибиться и не узнать своего товарища очень трудно.
Каждая глобула, которую мы взяли — это отдельная полипептидная цепь. Прочитай это еще раз. До этого все касалось только одной полипептидной цепи, а теперь их несколько. Такая цепь называется мономером (или субъединицей), а при соединении мономеров образуется олигомер. Так что вся большая молекула — это олигомер.
Какие связи все это стабилизируют? Чаще всего это водородные, ионные и Ван-дер-Вальсовы, так как каждый мономер прячет свои гидрофобные остатки вглубь молекулы, то они образуются редко. Получается, что четвертичную структуру стабилизируют силы слабого взаимодействия, ковалентных связей здесь почти никогда не бывает — очень редко могут быть дисульфидные. Поэтому можем спокойно забить на них.
В чем отличие четвертичной структуры от третичной? Ну кроме того, что тут объединено несколько полипептидных цепей. А вот какое — у олигомерных белков есть не только активный центр, но и другой — аллостерический центр. К этому замку не подойдут лиганды от активного центра, у него есть свои собственные ключики. Это очень важно, нужно запомнить! Господи, я превращаюсь в препода….
Проведем аналогию с нашим домиком, только теперь их будет несколько. У каждого будет по главному и черному входу! Главный вход — активный центр, а черный ход — это аллостерический центр.
Аллострические центры дают кое-что важное — регуляцию. Маленькая молекула, которая соединится с аллостерическим центром может остановить работу целого огромного белка. Круто? Получается, что размер не важен — не удержался.
Но каким образом одна молекула останавливает работу целого белка? Очень просто — хотел бы я так сказать. Присоединение молекулы к мономеру изменяет его конформацию. А это ведет к тому, что мономер изменяет конформацию других мономеров — происходят конформационные изменения всей структуры белка. В результате этих изменений закрывается активный центр — лиганд не может к нему подойти. У всех этих изменений есть, как и всегда, свое название — кооперативный эффект.
И опять я про дом, если открыть черный ход, то нельзя открыть главный вход, ну и наоборот. Не всегда регуляция работает в таком ключе: черный ход может, наоборот, открывать парадную дверь. Но сейчас это не суть, главное понять смысол. Кстати, на самом деле чаще одна субъединица несет на себе аллостерический центр, а другая активный. Я решил запихнуть все в одну — думаю, что так будет нагляднее.
Кроме этого, присоединение к активному центру также изменяет конформацию остальных мономеров, что приводит к облегченному присоединению лигандов. Хоть на картинке этого и не видно, но поверьте на слово!
В четвертичной структуре взаимодействуют несколько полипептидных цепей!
Стабилизируется молекула силами слабого взаимодействия.
Давайте заканчивать уже со строением.
Простые и сложные белки
До этого мы говорили, что белок — это полипептидная цепь, которая что-то там делает. Иногда даже несколько цепей соединяются и образуют олигомер. Но мы кое-что упускали все это время. Ведь не все белки состоят только из полипептидных цепей. У гемоглобина есть гем, а это не белковая часть, ого! Белки, которые располагаются на поверхности мембран соединяются с углеводами, которые спасают их от разрушения.
Получается, что у некоторых белков есть дополнительные компоненты. Есть простые белки — они состоят только из аминокислотных остатков, а есть белки сложные. Они включают в себя белковую часть (апопротеин), и небелковую (простетическая группа). Простетические группа связана с белком с помощью ковалентных связей — просто так её не оторвёшь. Она очень важна, потому что белки без неё уже не могут работать. Простетических групп очень много — это могут быть металлы, углеводы, гем, липиды и еще куча всего. Но это так, для общего развития.
У нас осталось последнее.
Денатурация белка
Так долго мы добирались до четвертичной структуры, но теперь время все УНИЧТОЖИТЬ. Денатурация — это потеря функции белка, через разрушение его четвертичной, третичной и вторичной структуры. Но не первичной! Процесс может остановиться и раньше, не дойдя до первичной. Но самое важное — белок перестает работать. Это значит вот что: если у белка есть только третичная структура, то её потеря приведёт к потере функций. Тоже самое касается белков с четвертичной структурой.
Денатурирующие факторы делятся на физические и химические.
Физические факторы
У всех этих факторов общий механизм действия. Они вносят в систему дополнительное количество энергии. Это вызывает увеличение амплитуды колебательных движений фрагментов полипептидной цепи. Из-за этого рвутся слабые связи, стабилизирующие белковую молекулу — водородные, гидрофобные и Ван-дер-Вальсовы. Вот некоторые из этих факторов:
Химические факторы
Химические денатурирующие факторы различаются по механизму действия. Так что разбираемся с каждым отдельно. Представим, что мы рвём каждую связь:
1) Добавим кислоту или щелочь в раствор, где находится белок — произойдет изменение заряда некоторых аминокислот. Раз изменился заряд, то происходит разрушение водородных и ионных связей.
2) Детергенты — это вещества, у которых есть гидрофобные и гидрофильные участки. Если засунуть их внутрь молекулы, то гидрофобное взаимодействие нарушится. Примеры детергентов — фенолы, додецилсульфат.
3) С помощью тяжелых металлов мы порвем дисульфидные мостики в третичной структуре. Такими тяжелыми металлами будут: свинец, медь и ртуть.
4) Восстанавливающие агенты — восстанавливают дисульфидные связи. Смысл такой же, как и с тяжелыми металлами: разрушение дисульфидных мостиков. Пример — меркаптоэтанол.
5) Вещества, образующие водородные связи — мочевина. Это ужасная воровка, она перетягивает водородные связи с белка на себя.
Но, мы сказали, что это разрушает вторичную, третичную и четвертичную структуры, но не первичную. Она остается целой. А так как она отвечает за формирование всех остальных, то при удалении денатурирующего фактора белок может снова стать работоспособным, восстановив свою структуру. Это процесс называется ренативация белка. Для этого нужны определённые условия, но они не всегда достижимы в клетке. Поэтому для большинства белков денатурация — это необратимый процесс.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.