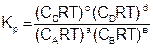что такое константа химического равновесия
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Константа химического равновесия



Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
Перенесем константы скорости в одну сторону, а концентрации в другую:
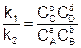
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
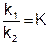
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
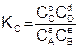
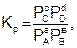
где РС, РD, РА и РВ – равновесные давления участников реакции.
Перенесем объем в правую сторону
р = 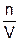
Подставим уравнение (6.9) в (6.7), для каждого реагента и упростим
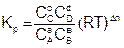
где Dn – изменение числа молей газообразных участников реакции
Dn = (с + d) – (а + в) (6.11)
Из уравнения (6.12) видно, что KР = КС, если не меняется количество молей газообразных участников реакции (Dn = 0) или газы в системе отсутствуют.
Необходимо отметить, что в случае гетерогенного процесса концентрацию твердой или жидкой фазы в системе не учитывают.
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
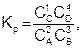
а если D – твердое, то
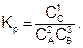
Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической возможности и глубине протекания химической реакции.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции).
Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884): если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается.
Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида:
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CАили CВ ®; CСили CD ¬; ¯ CАили CВ ¬; ¯ CСили CD ®).
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Dn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Dn = 0, то давление не влияет на смещение химического равновесия; если Dn 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. (Схематично можно записать: при Dn = 0 Р не влияет; при Dn 0 Р ¬, ¯Р ®). Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Константа равновесия химической реакции – формула с примерами
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
Рис. 1. Образование осадка BaSO4.
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
Рис. 2. График зависимости скорости реакции от времени.
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Kp = kпр / kобр = const.
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакции будут равны:
kпр ∙ [A]pa ∙ [B]pb = kобр ∙ [C]pc ∙ [D]pd.
Отсюда можно выразить соотношение констант:
kобр / kпр = [C]pc ∙ [D]pd / [A]pa ∙ [B]pb.
Это соотношение равно константе равновесия:
Kp = [C]pc ∙ [D]pd / [A]pa ∙ [B]pb.
Рис. 3. Формула константы равновесия.
Величина показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции.
Что мы узнали?
Реакции в зависимости от конечных продуктов классифицируются на обратимые и необратимые. Обратимые реакции протекают в обе стороны: исходные вещества образуют конечные продукты, которые разлагаются на исходные вещества. В ходе реакции скорости прямой и обратной реакций уравновешиваются. Такое состояние называется химическим равновесием. Оно может быть выражено как соотношение произведения равновесных концентраций продуктов реакции к произведению разновесных концентраций исходных веществ.
Константа равновесия химической реакции

Всего получено оценок: 124.
Всего получено оценок: 124.
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
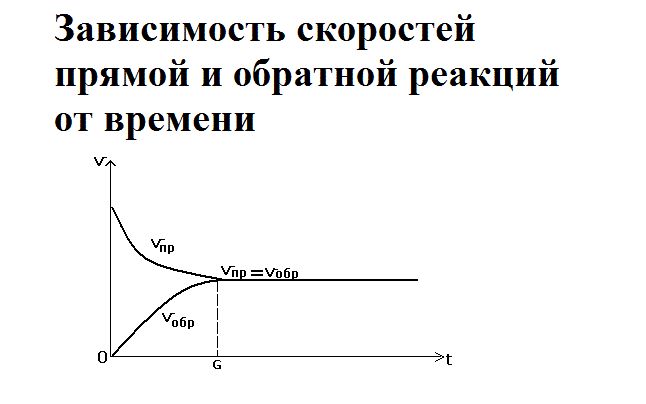
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакции будут равны:
Что такое константа химического равновесия
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
1.7 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Как было показано выше, протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG 2 Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала :
Изобарно-изотермические (P = const, T = const):
Изохорно-изотермические (V = const, T = const):
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Учение о равновесных состояниях – один из разделов термодинамики. Далее мы будем рассматривать частный случай термодинамического равновесного состояния – химическое равновесие. Как известно, многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне.
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
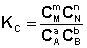
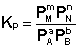
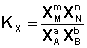
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества А и В. Скорость прямой реакции V1 в этот момент максимальна, а скорость обратной V2 равна нулю:
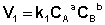
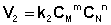
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V1 = V2, можно записать:
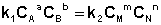
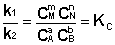
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
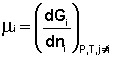
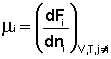
Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
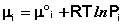
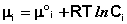
Здесь μ°i – стандартный химический потенциал компонента (Pi = 1 атм., Сi = 1 моль/л.). Очевидно, что изменение свободной энергии системы можно связать с изменением состава системы следующим образом:
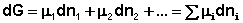
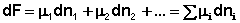
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
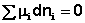
В закрытой системе изменение числа молей одного компонента сопровождается эквивалентным изменением числа молей остальных компонентов; т.е., для приведенной выше химической реакции имеет место соотношение:
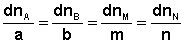
Отсюда можно получить следующее условие химического равновесия в закрытой системе:
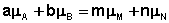
В общем виде условие химического равновесия можно записать следующим образом:
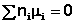
Выражение (I.94) носит название уравнения Гиббса – Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
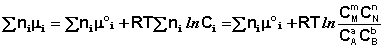
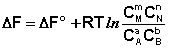
Для изобарно-изотермического процесса аналогичным образом можно получить:
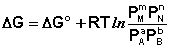
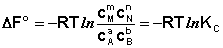
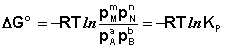
Здесь сi и рi – равновесные концентрации и парциальные давления исходных веществ и продуктов реакции (в отличие от неравновесных Сi и Рi в уравнениях I.96 – I.97).
Поскольку для каждой химической реакции стандартное изменение термодинамического потенциала ΔF° и ΔG° есть строго определенная величина, то произведение равновесных парциальных давлений (концентраций), возведенных в степень, равную стехиометрическому коэффициенту при данном веществе в уравнении химической реакции (стехиометрические коэффициенты при исходных веществах принято считать отрицательными) есть некоторая константа, называемая константой равновесия. Уравнения (I.98, I.99) показывают связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической реакции связывает величины реальных концентраций (давлений) реагентов в системе, стандартного изменения термодинамического потенциала в ходе реакции и изменения термодинамического потенциала при переходе из данного состояния системы в равновесное. Знак ΔG (ΔF) определяет возможность самопроизвольного протекания процесса в системе. При этом ΔG° (ΔF°) равно изменению свободной энергии системы при переходе из стандартного состояния (Pi = 1 атм., Сi = 1 моль/л) в равновесное. Уравнение изотермы химической реакции позволяет рассчитать величину ΔG (ΔF) при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
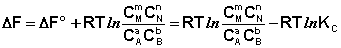
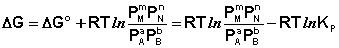
Если изменение термодинамического потенциала меньше нуля, процесс в данных условиях будет протекать самопроизвольно.
1.7.1 Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
1.7.2 Влияние давления и концентрации
Рассмотрим несколько возможных случаев смещения равновесия.
1. В систему добавлено исходное вещество. В этом случае
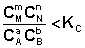
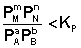
По уравнению изотермы химической реакции (I.100 – I.101) получаем: ΔF 0; ΔG > 0. Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
3. Изменено общее давление (для реакций в газовой фазе).
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δn.
Учитывая, что парциальное давление газа в смеси равно общему давлению, умноженному на мольную долю компонента в смеси (Рi = РХi), изотерму реакции можно переписать в следующем виде (здесь Δn = Σ(ni) прод – Σ(ni) исх):
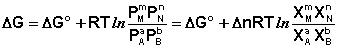
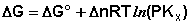
Примем, что Р2 > Р1. В этом случае, если Δn > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ (Δn изобару Вант-Гоффа :
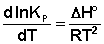
Рассуждая аналогичным образом, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа :
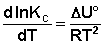
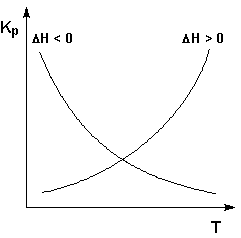
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции: ΔH° 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. I.4.
Рис. 1.4 Зависимость константы равновесия от температуры.
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.