Цветовые локусы на узи что это
Цветовое допплеровское картирование в диагностике опухолей матки
Диагностическое значение цветового допплеровского картирования (ЦДК) трудно переоценить. Сущность этого метода состоит в возможности визуализации всех движущихся жидкостей организма в режиме реального времени и проведении анализа их движения. Исследование кровотока в сосудах новообразований, которые имеют свои характерные особенности, позволяет считать этот метод важным в дифференциальной диагностике доброкачественных и злокачественных опухолей матки [5].
ЦДК позволяет оценить три параметра кровотока одновременно: направление, скорость и характер (однородность и турбулентность). В силу высокой разрешающей способности применяемой в настоящее время аппаратуры возможна визуализация и идентификация мельчайших сосудов вплоть до системы микроциркуляторного русла, невидимых при сканировании в В-режиме [3,4].
Система васкуляризации опухоли, как правило, представлена множеством мелких, очень тонких, аномальных по форме и расположению сосудов, хаотично разбросанных в пределах опухолевых тканей. Кровоток в этих сосудах характеризуется крайне низким сосудистым сопротивлением, высокой скоростью и разнообразным направлением. Изображение кровотока при этом отличается выраженной яркостью цветового сигнала, а в «окраске» опухолевых тканей могут преобладать как основные цвета, так и «мозаичная» форма картирования. Эти особенности кровотока обусловлены наличием большого количества артериовенозных анастомозов среди новообразованных сосудов, которые обеспечивают высокую кинетическую энергию кро-вотока и объясняют широкую вариабельность его направления [5].
Метод ЦДК обладает высокой чувствительностью, специфичностью и точностью в ранней диагностике опухолевых заболеваний внутренних половых органов и их диф-ференцировке по степени злокачественности. Оцененный с помощью ЦДК уровень васкуляризации позволяет прогнозировать быстроту роста выявленного образования [4, 5].
Миома матки. Исследования, выполненные A. Kuljak и I. Zalud [18], показали, что из 291 наблюдения доброкачественных онколей матки в 157 (54%) случаях отмечались признаки васкуляризации опухоли, о чем свидетельствует обнаружение цветовых сигналов в ткани новообразования. Из 17 случаев злокачественных опухолей матки интенсивная васкуляризация выявлена в 16 (94%) наблюдениях, что подтверждено последующими морфологическими исследованиями.
Анализ кривых скоростей кровотока при миоме матки позволил установить следующие особенности. У всех пациенток отмечалось снижение резистентности в обеих маточных артериях. Диастолический кровоток всегда обнаруживался в основных артериях, кровоснабжающих миоматозные узлы. Cреднее значение индекса резистентности на уровне кровотока миометрия составило 0,54. Степень васкуляризации больше зависела от размеров опухоли, нежели от ее локализации. Численные значения индекса резистентности в маточных артериях в среднем составили 0,74+/-0,09 при васкуляризированных узлах и 0,80+/-0,10 при аваскуляризированной миоме матки (контроль 0,84+/-0,09) [5, 18-20].
Установлено, что рост миоматозных узлов напрямую зависит от увеличения кровотока в сосудистой системе матки. Кровоснабжение миоматозных узлов осуществляется из сосудов, представляющих собой ответвления терминальных отделов маточной артерии. Миоматозные узлы растут за счет пролиферации гладких мышечных клеток и фиброзной соединительной ткани, образуя псевдокансулу. Поэтому при ЦДК чаще видны сосуды, располагающиеся на периферии миоматозного узла. Расширенные сосуды, просматриваемые в наружной трети миоматозного узла, чаще всего представлены расширенными венами и артериями. Плотность расположения сосудов зависит от гистологического строения узла и от его локализации. Большее количество артерий отмечается но периферии узла, так как они являются продолжением аркуатных сосудов матки. В центральной части сосуды визуализируются в очень небольшом количестве. В этих случаях при морфологическом исследовании отмечаются некротические, дегенеративные и воспалительные изменения миоматозного узла [5, 16, 18-20].
Частота визуализации сосудов внутриопухолевого кровотока, но данным различных авторов, характеризуется большим разбросом (54-100%). Это обусловлено использованием различных доступов (трансвагинальное и трансабдоминальное сканирование). Установлено, что степень васкуляризации миоматозных узлов зависит не только от их размеров, но и от локализации [5,13,16,18-20].
По данным F. Aleem и М. Predanic [12], наиболее васкуляризованы субсерозные миоматозные узлы. При изучении показателей кровотока в этих узлах отмечены наиболее низкие численные значения индекса резистентности (ИР 0,43), что, по-видимому, зависит от крупного сечения артерии, проходящей через ножку субсерозного миоматозного узла. Интерстициальные и субмукозные миоматозные узлы характеризуются более высокой сосудистой резистентностью (ИР 0,59 и 50 соответственно).
Отмечается также снижение показателей сосудистой резистентности в маточных артериях и артериях неизмененного миометрия.
По данным S.E. Huang [17], внутриопухолевые значения пульсационного индекса пропорциональны размерам матки. Однако они не выявили зависимости показателей пульсационного индекса от клеточной пролиферации и ангиогенеза.
Принимая во внимание значительный разброс численных значений индекса резистентности в разных зонах миоматозного узла, авторы рекомендуют проводить регистрацию кривых скоростей внутриопухолевого кровотока как минимум в 3 участках узла. Измерения проводятся в подозрительных зонах узла (участки сниженной эхогенности, кистозные полости), которые, как правило, располагаются в центре узла опухоли [5, 16, 18, 19].
Карцинома эндометрия. Рак эндометрия является довольно частой патологией и занимает второе место среди всех злокачественных заболеваний женских половых органов. Статистические данные последних лет свидетельствуют о существенном увеличении заболеваемости раком эндометрия. В нашей стране она ежегодно увеличивается приблизительно на 6% [2].
Многочисленные исследования свидетельствуют о том, что основное внимание при диагностике рака эндометрия отводится определению толщины М-эха [10]. В менопаузе этот показатель, превышающий 5 мм, рассматривается как ведущий эхографический признак данной патологии, что требует комплексного обследования для уточнения диагноза (раздельное диагностическое выскабливание).
С точки зрения В.Н. Демидова [1, 2], наиболее характерными признаками рака эндометрия являются следующие:
— неоднородность внутренней структуры образования;
— неровность контуров;
— более высокая эхогенность но сравнению с мышцей матки;
— большие размеры образования, составляющие половину толщины матки или более;
— повышенная звукопроводимость;
— наличие жидкостных включений неправильной формы и различной величины;
— заметное увеличение размеров образований при динамическом наблюдении;
— отсутствие четкого изображения контуров матки вследствие перехода опухолевого процесса на смежные органы.
В настоящее время известно, что в большинстве случаев рак эндометрия возникает на фоне предраковых заболеваний. Г.М. Савельева и В.Н. Серов [7] наблюдали переход доброкачественных неопластических процессов в рак у 79% больных. К предраковым заболеваниям относят атипическую гиперплазию, аденоматозные полипы, железисто-кистозную гиперплазию в менопаузе (особенно рецидивирующую) или развивающуюся на фоне нейроэндокринных нарушений. Другие виды патологии эндометрия переходят в рак крайне редко.
Однако применение ЦДК с анализом кривых скоростей кровотока является более точным методом диагностики карциномы эндометрия, так как в подавляющем болыиинстве случаев заболевания отмечаются патологические кривые скорости кровотока, характерные для сосудов со сниженной резистентностью.
Однако более оправдано оценивать кривые скоростей кровотока в специфических сосудах (внутри- и периопухолевых). Пульсациоиный индекс является менее чувствительным критерием, чем индекс резистентности сосудов [20].
С. Ракиц и соавт. [6] провели проспективный анализ 64 случаев патологии эндометрия с использованием классической серой шкалы в сочетании с цветовым допплеровским картированием для диагностики рака эндометрия. Патологический кровоток, неоваскуляризация характеризовались присутствием «горячих точек» в эндометрии. «Горячие точки» заметно отличались от окружающих кровеносных сосудов. «Горячие точки» представляют собой последовательность вновь образованных хаотичных шунтов и альтернативных изменений в кровотоке. Индексы резистентности и пульсации измерялись в отдельных кровеносных сосудах, что позволило доказать отсутствие мышечной оболочки в стенке артериальных сосудов в бассейне неоваскуляризации. В случае патологии диастолический кровоток был ускорен, но индексы оставались низкими. Границы объемов для ИР 0,4 и ИП 1 в исследовании не отличались от общепринятых.
Л.Е. Терегулова [9], обследуя 218 пациенток с гистологически подтвержденным раком эндометрия, пришла к выводу, что ультразвуковое исследование позволяет определить степень развития рака эндометрия, глубину инвазии и распространенность процесса, так как с ростом аденокарциномы эндометрия вначале становятся доступными для регистрации венозные, а затем артериальные сосуды с характерным для злокачественных опухолей низким индексом резистентности: ИР
Цветовые локусы на узи что это
а) Аутокорреляция. В силу необходимости одновременного анализа сигналов из множества контрольных объемов расчет скоростей основан на ином принципе, чем при спектральной допплерографии: вместо быстрого преобразования Фурье (FFT) используется аутокорреляция. В этом случае, в отличие от спектральной допплерографии, высчитывается только среднее смещение частот в одном контрольном объеме. Крайне упрощенно это можно описать так: полученный импульс одной из линий сканирования подвергается сравнению («корреляции») с непосредственно предшествовавшим ему импульсом.
Если отраженный импульс имеет смещение по фазе по сравнению с предыдущим сигналом, то это означает, что движущийся объект переместился в промежутке между этими двумя импульсами. Смещение по фазе можно представить в виде смещения частот, что, в свою очередь, позволяет определить скорость движения объекта. Эта операция одновременно производится для многих линий сканирования и различных глубин измерения.
В зависимости от прибора высокоскоростные компоненты (как, например, в турбулентном потоке) изображаются в виде светлого мозаичного узора или как бирюзовая примесь к основному рисунку.
в) Частота кадра. Обычно максимальная скорость движения крови при недостаточности клапана, выраженном стенозе или дефекте межжелудочковой перегородки в несколько раз превышает скорость Найквиста. Частота кадра для цветовой допплерографии ниже, чем для обычного двумерного эхоизображения. Она обратно пропорциональна ширине цветового сектора и его глубине, а также точности и разрешению при измерении скоростей (т.е. числу импульсов, участвующих в аутокорреляции). Увеличение одного из этих параметров (например, ширины сектора цветовой допплерографии) приводит к снижению частоты кадра или снижению одного из других параметров.
г) Величина струи и скорость потока. По многим причинам двумерная ширина потока при цветовой допплерографии («величина струи») клинически лишь слабо коррелирует с реальным потоком крови (в мл/с). Наряду с эксцентриситетом, трехмерностью, адгерентностью стенок, факторами обработки изображения, усилением, частотой повторения импульсов и другими факторами, это связано с тем физическим обстоятельством, что величина струи пропорциональна сумме импульсов частичек жидкости, участвующей в потоке.
— масса струи зависит от потока (в мл/с) и
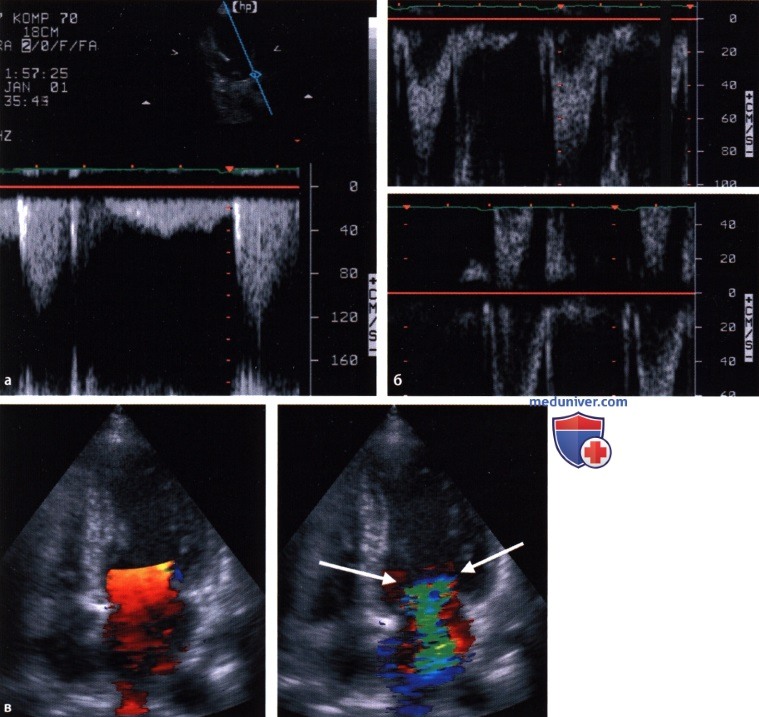
а. Непрерывноволновая допплерограмма при локализации контрольного объема в области выносящего тракта и аортального отверстия, зарегистрированная из верхушечного доступа (норма). Максимальная систолическая скорость составляет 130 см/с.
б. Импульсно-волновая допплерограмма области выносящего тракта левого желудочка и аортального клапана, зарегистрированная из верхушечного доступа (норма). Максимальная систолическая скорость составляет 80 см/с. Вверху: смещение нулевой линии с целью отображения всего систолического сигнала. Внизу: при центрально расположенной нулевой линии скорость искажения, или скорость Найквиста, составляет ±50 см/с. В нижней части картинки систолический сигнал обрезан (искажение, aliasing), и пики допплеровского сигнала отображаются в верхней половине картинки и поэтому с ложным знаком.
в. Цветовая допплерограмма левого предсердия, зарегистрированная из апикальной четырехкамерной позиции. Слева: диастолическое ламинарное течение из легочных вен через левое предсердие в левый желудочек (норма). Красно-желтые оттенки обозначают скорости потока, направленного к датчику, причем максимальная скорость (желтый цвет) определяется в области диастолического трансмитрального потока, входящего в левый желудочек. Справа: изображение митральной недостаточности (в систолу). Зеленый цвет кодирует турбулентный высокоскоростной поток регургитации из левого желудочка в левое предсердие.
В начале струи регургитации в области митрального клапана со стороны желудочка можно увидеть проксимальную зону конвергенции (стрелки). Синий цвет ее внешней оболочки указывает на ламинарный поток крови по направлению к митральному клапану.
Видео урок основы допплер-ЭхоКГ (допплерографии при эхокардиографии)
— Вернуться в оглавление раздела «Кардиология.»
Редактор: Искандер Милевски. Дата публикации: 15.12.2019
Роль допплеровских методов в дифференциальной диагностике опухолей матки и яичников
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
С внедрением в клиническую практику новых неинвазивных методов исследования, в том числе цветового допплеровского картирования (ЦДК), стало возможным более раннее выявление опухолей 4. Этот метод является простым, доступным, высокоинформативным, позволяющим провести эхографическую дифференциальную диагностику опухолей и опухолевидных образований яичников, а также различных видов онкопатологии матки 7.
A. Kurjak [11], Т. Bourne [12] одними из первых сообщили, что при проведении трансвагинальной цветовой допплерографии была обнаружена выраженная разница допплерометрических показателей в доброкачественных и злокачественных новообразованиях. Данные об информативности пороговых значений индексов при проведении дифференциального диагноза доброкачественного и злокачественного новообразования остаются противоречивыми. Одни авторы [5, 10, 11] высоко оценивают их диагностические возможности, не признавая эффективности показателей скорости, другие предлагают все делать наоборот [12]. Большая группа исследователей склоняется к тому, что только комплексное использование анамнестических данных, различных ультразвуковых методов, а также биохимических онкомаркеров и маркеров ангиогенеза приводит к реальному повышению точности диагностики [7-10, 13, 14]. Тем не менее исследование кровотока в сосудах новообразований имеет свои характерные особенности, что позволяет считать метод ЦДК важным в дифференциальной диагностике доброкачественных и злокачественных опухолей [15].
ЦДК позволяет оценить три параметра кровотока одновременно: направление, скорость и характер потока (однородность и турбулентность). Высокая разрешающая способность современных аппаратов дает возможность в режиме энергетического допплера визуализировать кровоток в мельчайших сосудах вплоть до системы микроциркуляторного русла, невидимых при сканировании в В-режиме [4, 8, 9]. Исследование характера васкуляризации опухолей внутренних половых органов допплеровскими методами открывает большую перспективу в их неинвазивной дифференциальной диагностике по степени злокачественности, а также в прогнозировании быстроты роста опухоли [9, 10, 14].
Материалы и методы
Основными клиническими проявлениями заболевания были болевой синдром у 41 (20,5%) женщины, нарушение менструальной функции у 38 (19,0%), нарушение функции соседних органов у 5 (2,5%), и бесплодие у 8 (4%) пациенток.
Результаты исследования

Рис. 1. Значения ИР (а) и МАС, см/с (б), в маточной артерии и внутриопухолевом образовании при миоме, саркоме и карциноме шейки матки.
Дифференциальным диагностическим критерием между саркомой и миомой матки в режиме ЦДК является визуализация нерегулярных, тонких, хаотично разбросанных сигналов от сосудов с показателями низкой резистентности как внутри, так и вокруг опухоли. Предлагается использовать пороговое значение ИР внутриопухолевого кровотока, равное 0,4, а максимальная систолическая скорость более 45 см/с.
Как и при саркоме матки у больных с раком шейки матки значения ИР в ветви маточной артерии и внутри опухоли были достоверно ниже (0,57 ± 0,14 и 0,37 ± 0,05 соответственно) как по отношению к контролю, так и к значениям, полученным при миоме матки. Скорость кровотока внутри опухоли недостоверно превышала скорость в маточной артерии (58,8 ± 8,64 против 51,9 ± 7,17 и см/с).
Сравнительная характеристика резистентности и скорости кровотока у больных с доброкачественными и злокачественными новообразованиями на уровне эндометрия представлена на рис. 2а,б. Рак эндометрия является довольно частой патологией и занимает второе место среди всех злокачественных заболеваний женских половых органов [2]. Многочисленные исследования свидетельствуют о том, что основное внимание при диагностике рака эндометрия отводится определению толщины М-эхо [6].

Рис. 2. Значения ИР (а) и МАС, см/с (б), в маточной артерии и внутриопухолевом образовании при гиперплазии, полипе и карциноме эндометрия, а также в трофобластических опухолях.
В менопаузе этот показатель, превышающий 5 мм, рассматривается как ведущий эхографический признак данной патологии, что требует комплексного обследования для уточнения диагноза.
Таким образом, применение допплеровских методов позволяет выявить вполне отчетливую зависимость опухолевого кровотока от клеточной пролиферации и ангиогенеза при доброкачественных и злокачественных новообразованиях матки. Однако требуется дальнейшее изучение зависимости показателей кривых скоростей кровотока от гистологического строения и степени дифференцировки опухолей.
При допплерографической оценке патологических состояний яичников имеют большое значение такие особенности нормального интраовариального кровотока в репродуктивном возрасте, как значительное повышение скорости и снижение резистентности в фазу расцвета желтого тела [8].
Рис. 3. Допплерометрические показатели (ИР, ПИ, МАС) внутриопухолевого кровотока в опухолевидных образованиях, доброкачественных и злокачественных опухолях яичников.
У женщин с фолликулярными кистами (15 наблюдений) визуализировался достаточно бедный сосудистый рисунок в стенках кисты, напоминающий интраовариальный кровоток в среднюю и позднюю фолликулярную фазу менструального цикла. Полученные значения MAC, ПИ и ИР составили 12,4 ± 3,67 см/с, 0,76 ± 0,07 и 0,52 ± 0,04 соответственно. Надежных эхографических дифференциальнодиагностических критериев между фолликулярными кистами и однокамерными гладкостенными цистаденомами при помощи допплеровских методов получено не было.
Значение допплерографии в дифференциации эндометриоидных кист или кист желтого тела и злокачественных новообразований яичников очевидно.
Эхографически опухоли представляли собой кистозно-солидные образования с множественными перегородками различной толщины и плотным компонентом средней или повышенной эхогенности (папиллярные разрастания по внутренней поверхности опухоли и на ее перегородках). Во всех наблюдениях образования содержали мелкодисперсную взвесь.
Цветовое допплеровское картирование в диагностике рака эндометрия
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Стандартным методом дифференциальной диагностики злокачественных и доброкачественных изменений является гистопатологическое исследование ткани, полученной при раздельном диагностическом выскабливании матки с гистероскопическим контролем. Сегодня актуален вопрос изыскания возможностей неинвазивной типизации тканей с помощью цветового допплеровского картирования, энергетического допплера, импульсной допплерометрии. Согласно данным литературы, систематическое использование эхографии способствует более ранней диагностике рака эндометрия, повышению частоты встречаемости рака I стадии на 50% и уменьшению заболеваемости раком III-IV стадий в 1,5 раза [7,8].
По мнению большинства авторов, применение комплексного ультразвукового исследования с анализом кривых скоростей кровотока является высокоинформативным методом неинвазивной диагностики карциномы эндометрия, так как в подавляющем большинстве случаев заболевания отмечаются патологические кривые скоростей кровотока, характерные для сосудистой сети с низким уровнем периферического сопротивления. Индексы резистентности и пульсации позволили доказать отсутствие мышечной оболочки в стенке артериальных сосудов в бассейне неоваскуляризации при злокачественном росте опухоли. Индекс резистентности (RI) при карциноме эндометрия составляет 0,42+0,02, тогда как в норме, при атрофии эндометрия и при простой гиперплазии, эндометриальный кровоток не регистрируется [9,10-14]. Однако ультразвуковых исследований, позволяющих выявить возможности цветовой допплерографии в диагностике рака эндометрия, крайне недостаточно.
Материалы и методы
| Морфологическая форма | Количество | % |
|---|---|---|
| Гиперпластические процессы | 17 | 42,5 |
| Железисто-кистозная гиперплазия Железисто-фиброзные полипы Атрофический эндометрий Атипическая гиперплазия | 9 4 1 3 | 22,5 10 2,5 7,5 |
| Злокачественная патология | 23 | 57,5 |
| Аденокарцинома Плоскоклеточный рак Аденоакантома Сочетание аденокарциномы и эндометриальной стромальной саркомы | 17 3 2 1 | 42,5 7,5 5 2,5 |
| Итого | 40 | 40 |
У 10 (58,8%) больных с гиперпластическими процессами и у 14 (60,9%) больных с аденокарциномой эндометрия наблюдалась сопутствующая миома матки небольших размеров (5-9 недель беременности). Длительное существование миомы матки (6-10 и более 10 лет) отмечено у всех пациентов с аденокарциномой.
Ультразвуковое исследование в сочетании с цветовым допплеровским картированием, энергетического допплера и импульсной допплерометрии выполнены всем пациентам на современных ультразвуковых аппаратах трансабдоминальным (конвексным датчиком с частотой 3,5 МГц) и трансвагинальным (конвексным датчиком с частотой 6,5 и 7 МГц) доступом. При эхографии оценивали размеры матки, величину, структуру, состояние полости матки и яичников. Допплеровский анализ включал определение: характера кровотока (артериальный или венозный), количества цветовых сигналов от сосудов в каждой опухоли, локализации внутриопухолевого кровотока (центральная или периферическая), наименьшего и среднего индекса резистентности (RImin и RImed) в маточных, аркуатных и опухолевых сосудах, максимальной скорости артериального (VAmax) и венозного кровотока (VVmax).
Для исключения субъективизма в оценке интенсивности внутриопухолевого кровотока нами предложена шкала. В 5-6 стопкадрах регистрировали количество цветовых сигналов от сосудов новообразования:
Для маточных артерий использовался частотный фильтр 100 и 50 Гц, для аркуатных и внутриопухолевых сосудов при размере «пробного объема» допплеровского луча 4 и 2 мм соответственно.
Результаты и их обсуждение
Цветовая допплерография не зарегистрировала внутриопухолевый кровоток у 23,5% больных: при атрофическом эндометрии и в 3 случаях железисто-кистозной гиперплазии. У 76,5% пациенток обнаружен различной интенсивности периферический кровоток со средними значениями индекса резистентности. При железисто-кистозной гиперплазии отмечались единичные цветовые сигналы от сосудов, расположенные по периферии, со средними и высокими значениями индекса резистентности. При фиброзно-железистых полипах визуализировался умеренно выраженный венозный и артериальный периферический кровоток со средними показателями периферического сосудистого сопротивления. При атипической гиперплазии регистрировался интенсивный центральный и периферический внутриопухолевый кровоток со средним уровнем резистентности сосудов.
Определение стадии рака осуществлено согласно Международной классификации рака тела матки (FIGO,1988). Сопоставление стадии и гистотипа представлено в табл. 2.
| Стадия | Аденокарцинома | Другие* | Всего | |
|---|---|---|---|---|
| высоко- дифферен- цированная | умеренно-дифферен- цированная | |||
| Ia | 4 | — | 1 | 5 |
| Ib | 4 | 4 | 4 | 12 |
| Ic | — | — | — | — |
| II | — | 2 | 1 | 3 |
| III | — | 2 | — | 2 |
| IVc | — | 1 | — | 1 |
| Итого: | 8 | 9 | 6 | 23 |
Ультразвуковыми признаками злокачественной патологии эндометрия были: неоднородость внутренней структуры образования, более высокая эхогенность по сравнению с миометрием, повышенная звукопроводимость ткани, неровный, «изъеденный» контур, проникающий в миометрий на различную глубину, наличие гипоэхогенного ободка вокруг новообразования.
У 30,4% больных с карциномой эндометрия при трансвагинальной эхографии обнаруживались локальные гиперэхогенные образования неоднородной внутренней структуры с преимущественной инвазией в определенном направлении одной из стенок матки или локализация в области дна либо одного из трубных углов. При морфологическом исследовании выявлена экзофитная форма роста опухоли I стадии. В остальных 69,6% клинических наблюдениях отмечалась эндофитная форма роста с равномерной инвазией в миометрий. У этих больных обнаружены неровные, «изъеденные» контуры опухоли, проникающей в миометрий на различную глубину, стертая граница между новообразованием и миометрием. Некроз опухоли с деформацией полости матки и наличие некоторого количества жидкости выявлены при III и IV стадиях процесса.
Неоваскуляризация эндометрия имела место у 91,3% (21) больных. Из них «бедный» и умеренно выраженный кровоток с низкими цифрами индекса резистентности наблюдался в 13% наблюдений высокодифференцированной аденокарциномы Ia стадии. Такой тип неоваскуляризации отмечен при экзофитной форме роста опухоли.





