Цитоморфологический диагноз что такое
Цитологическое исследование и его значение в онкологии
Что такое цитологическое исследование
Цитологическое исследование — одно из самых востребованных в онкологии. С его помощью врач оценивает состояние клеточных элементов и делает заключение о злокачественной или доброкачественной природе новообразования. Изучаются особенности строения клеток, клеточный состав органов, тканей, жидкостей организма человека. Цитологическое исследование применяется при диагностике предраковых заболеваний и злокачественных новообразований различных органов: шейки и тела матки, молочной железы, щитовидной железы, легких, кожи, мягких тканей и костей, желудочно-кишечного тракта, лимфатических узлов и др. Для цитологического исследования берут мазки свода влагалища и шейки матки, мокроту, мочу, экссудаты из полостей и т.д.
Когда назначается цитологическое исследование?
В большинстве случаев врачи – терапевты, гинекологи, онкологи и другие специалисты — прибегают к цитологической диагностике при подозрении на опухолевое заболевание.
Цитологический метод применяется для исследования новообразований в различных органах – кожа, молочная железа, лёгкие, средостение, печень, почки, забрюшинные образования, щитовидная железа, предстательная железа, яичко, яичники, лимфатические узлы, миндалины, слюнные железы, мягкие ткани, кости и др.
Наибольшее распространение цитологические исследования получили в области гинекологии. Это доступный и быстрый метод скрининга, доказавший свою эффективность в диагностике предраковых заболеваний и раннего рака шейка матки.
Нередки случаи, когда цитологическое исследование помогало обнаружить рак желудка, легкого, мочевого пузыря и др. на самых ранних стадиях, когда рентгенологические и эндоскопические исследования не выявили изменений.
В период лечения опухолевого заболевания необходимо постоянно контролировать эффективность проводимой терапии. Для этого необходимы быстрые и эффективные методы диагностики. Цитологическое исследование в этих случаях позволяет оперативно получить ответы на большинство возникающих у врачей вопросов по поводу течения болезни. Цитологическое исследование широко используется также и после окончания специализированного (хирургического, химиотерапевтического или лучевого) лечения для контроля течения заболевания и раннего выявления возможного рецидива или прогрессирования опухоли (исследование лимфатических узлов, плеврального экссудата и т.д.).
Основные области применения цитологических исследований в онкологии:
В чем отличие цитологии от гистологического исследования?
Отличие цитологического исследования от гистологического, в первую очередь, заключается в том, что изучаются именно клетки, а не срезы тканей. Для гистологического исследования требуется либо операционный материал, либо забор материала методом трепан-биопсии. Для цитологического же исследования достаточно мазка со слизистой оболочки, соскоба с поверхности опухоли или материала, полученного тонкой иглой.
Подготовка гистологического препарата требует больше усилий и времени, нежели подготовка для цитологического анализа.
Как выполняется цитологическое исследование?
Для анализа используют различный биоматериал.
Эксфолиативный материал, то есть полученный методом «слущивания»:
Пункционный материал:
Операционный материал:
Эндоскопический материал:
Цитологическое исследование — наиболее щадящий метод диагностики. Обычно забор материала для анализа протекает безболезненно, в амбулаторных условиях, без травматического воздействия на органы и ткани.
Взятый для анализа клеточный материал в цитологической лаборатории переносят на предметные стекла, окрашивают и исследуют под микроскопом.
Цитоморфолог использует в своей работе совокупность признаков атипии клетки, критически оценивая их наличие и степень выраженности. Результат анализа напрямую зависит от профессионализма специалиста, проводящего исследование: как в части подготовки материала, так и в части его исследования под микроскопом.
На поверхности опухолевых клеток есть особые белки – антигены. Причем, каждая опухоль экспрессирует свой собственный набор антигенов. При необходимости с помощью специальных реактивов для иммуноцитохимического исследования врач-цитолог может не только установить наличие злокачественно трансформированных клеток в исследуемом образце, но и определить гистотип опухоли, ее органную принадлежность, факторы прогноза и чувствительность к лечению.
Достоинства цитологического метода:
Обычно для проведения исследования требуется несколько часов. Интраоперационное цитологическое исследование может быть выполнено в течение 10 минут.
За счет его безвредности, цитологический метод незаменим для оценки динамики морфологических изменений в клетках опухоли во время лечения, для определения терапевтического эффекта проводимого лечения. Для таких пациентов он имеет несомненные преимущества перед другими, более инвазивными методами исследования.
Методы цитологических исследований постоянно совершенствуются. Развитие эндоскопической техники позволяет целенаправленно получать материал для исследования из внутренних органов, ранее недоступных для морфологического анализа без оперативного вмешательства.
Таким образом, цитологическое исследование, благодаря сочетанию высокой информативности, безвредности для пациента и скорости проведения, при отсутствии травматизации тканей, имеет огромное значение в онкологии.
Авторская публикация:
Михетько Андрей Александрович
заведующий лабораторией цитологии НМИЦ онкологии им.Н.Н. Петрова,
врач клинической лабораторной диагностики (цитолог) высшей квалификационной категории, кандидат медицинских наук.
Морфологические методы исследования
Морфологические методы исследования
Для чего необходимо морфологическое исследование опухолевой ткани?
Практически во всех случаях точный диагноз онкологического заболевания может быть установлен только на основании результатов исследования образца опухолевой ткани, полученной у пациента. Наиболее часто с этой целью используются следующие методы получения биологического материала:
В большинстве случаев забор опухолевой ткани осуществляется с использованием того или иного метода обезболивания (анестезии).
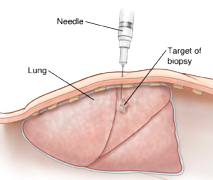
Пункция
Во время пункции возможно получить небольшое количестве клеток для цитологического исследования. Во время выполнения этого вмешательства врач вводит в опухоль тонкую иглу и при помощи шприца забирает небольшое количество материала. После этого полученная ткань (жидкость и содержащиеся в ней клетки) помещается на специальное предметное стекло. Данный метод исследования называется цитологическое исследование (цитология), он дает возможность получить информацию об отдельных клетках, из которых состоит исследованная ткань. Пункция является наименее травматичным методом получения материала для исследования, однако его информативности в некоторых случаях может быть недостаточно. К примеру, отрицательные результаты пункции не всегда означают отсутствие опухолевого роста.
Для цитологического исследования также может быть использована слюна, мокрота, моча, жидкость, скопившаяся в брюшной или плевральной полости (асцит или плеврит), а также мазки или смывы из половых путей, дыхательных путей и т.д. Также используют отпечатки с патологических образований (язв, эрозий). В последнем случае предметное стекло прикладывается к интересующей зоне, после чего изготавливается материал, аналогичным образом может быть взят мазок-отпечаток при котором с патологического образования соскребается материал при помощи шпателя, скальпеля или других инструментов.
Биопсия
В отличие от пункции при проведении биопсии удается получить значительно большее количество опухолевой ткани, данный вид забора материала применяется для получения материала для гистологического исследования материала. В ходе его выполнения можно получить точную информацию о строении опухолевой ткани. В отличие от вышеописанного цитологического исследования результаты данного вида исследования отличаются большей точностью, кроме того, больший объем материала позволяет точнее установить диагноз (например, выявить точный подвид опухолевых клеток), и, в случае наличия необходимости, провести дополнительные иммуногистохимические методы обследования (подробнее описано ниже).
Несмотря на указанные преимущества, выполнение биопсии является более травматичной процедурой для организма, чем выполнение пункции. В некоторых случаях проведение данного исследования может быть невозможно вследствие наличия высокого риска травматического повреждения близко расположенных к опухоли сосудов, например, при опухолях расположенных в области поджелудочной железы, в связи с чем пункция может быть единственным доступным методом получения материала для исследования.
Виды биопсии
Биопсия может осуществляться как под контролем зрения врача («на ощупь») так и под контролем специального оборудования, например ультразвукового аппарата или компьютерной томографии. В наиболее сложных случаях, например, при биопсии новообразований, расположенных в головном мозге, используются специальные методы фиксации пациента, препятствующие смещению опухоли при заборе материала (стереотаксическая биопсия). Существуют следующие основные виды биопсии:
В зависимости от расположения опухоли биопсия может быть выполнена как снаружи через кожу, так и изнутри организма. С этой целью в организм могут вводиться эндоскоп, который представляет собой тонкую гибкую трубку, оснащенную видеокамерой и различными манипуляторами. При помощи эндоскопических методов может быть осуществлена биопсия новообразований, расположенных в просвете желудочно-кишечного тракта (гастроскопия и колоноскопия), например, полипов толстой кишки, бронхов (бронхоскопия), мочевыводящих путей (цистоскопия), грудной клетки (торакоскопия) и брюшной полости (лапароскопия).
Выполнение гистологического исследования
Гистологическому исследованию в обязательном порядке подвергается любой удаленный материал, в том числе – после хирургического удаления опухоли в ходе оперативного этапа лечения. Изучение послеоперационного материала позволяет уточнить диагноз, распространенность процесса и его стадию, оценить наличие вовлечения в болезнь лимфатических узлов и т.д.
После получения материала для исследования любым из вышеуказанных способов он отправляется на исследование к специалисту по морфологическому изучению опухолей – патологоанатому (или патоморфологу), который обрабатывает полученную ткань необходимым образом и проводит её исследование. Так как ткань опухоли подвержена естественным процессам разрушения, необработанный материал может стать непригодным для дальнейших исследований. В первую очередь с целью обеспечения сохранности ткани проводится её обработка специальным фиксирующим раствором, например формалином.
После этого ткань запечатывается в парафин (воскоподобный материал) в результате чего образец опухолевой ткани становится пригодным для исследования и хранения в течение длительного времени. Таким образом создаются так называемые «опухолевые блоки». Опухолевый блок – кусочек опухолевой ткани, запечатанный в парафин. Как правило, изготавливается множество блоков, содержащих разные участки опухолевой ткани.
После этого с части или со всех или с части изготовленных блоков делаются тонкие срезы, пригодные для исследования под световым микроскопом («опухолевые стекла»). Эти стекла врач-патоморфолог изучает под микроскопом, в некоторых случаях – после специальной окраски, которая позволяет лучше оценить те или иные детали строения опухоли. В ходе изучения опухолевой ткани врач старается установить наличие или отсутствие признаков злокачественности опухоли, степень её злокачественности, вид клеток, из которых она возникла и т.д.
Иногда, в тех случаях, когда необходимо получение максимально быстрого ответа вместо запечатывания опухолевой ткани в парафин, применяется её быстрая заморозка с последующей «нарезкой» и изучением под микроскопом. Этот процесс занимает около 15-20 минут. Данный метод применяется при необходимости интраоперационного исследования материала, когда непосредственно в процессе выполнения оперативного вмешательства хирургу необходимо получить гистологическую информацию, например, о наличии или отсутствии опухолевых клеток по краю резекции (отреза) для того, чтобы убедиться в радикальности выполненного вмешательства.
Результаты морфологического исследования
По результатам исследования врач-патоморфолог составляет цитологическое или гистологическое заключение, в котором отражаются результаты изучения образца опухолевой ткани под микроскопом, а также результаты гистохимических и молекулярных исследований, если они проводились. Как правило, гистологическое заключение может содержать следующую информацию:
Как правило, проведение гистологического исследования занимает до 10 дней. Обязательно сохраните у себя копию гистологического заключения, а также убедитесь в сохранности стекол и блоков
Дополнительные методы исследования
В ряде случаев для установления точного диагноза может понадобиться определение подвида опухоли, а также наличия в ней экспрессии (выработки) определенных белков, которые могут быть использованы в качестве «мишеней» для противоопухолевой терапии.
С этой целью врач-патоморфолог может дополнительно провести иммуногистохимическое исследование (ИГХ). Суть ИГХ исследования заключается в обработке опухолевой ткани специальными антителами, которые связываются со своими белками-мишенями на поверхности опухолевых клеток. После выполнения определенных процедур это приводит к тому, что эти белки становятся видны при микроскопическом исследовании опухоли, если они ей продуцируются.
Врач-патоморфолог может оценить «набор» белков, которые вырабатываются опухолью, а также степень экспрессии того или иного белка. ИГХ является незаменимым методом в следующих случаях:
ИГХ очень широко применяется при обследовании больных раком молочной железы. Всем пациенткам с этим диагноз проводится определение наличия в опухоли экспрессии рецепторов гормонов, эстрогена и прогестерона, а также скорости деления клеток (индекс Ki-67) и выраженности экспрессии белка HER2-neu. Это необходимо для того, чтобы понять, какие именно механизмы запускают процессы деления опухолевых клеток. Избирательно подавляя эти механизмы можно блокировать процессы роста и деления опухолевых клеток. Например, если установлено, что процессы роста опухолевых клеток стимулируют эстрогены и/или прогестерон, лишив злокачественные клетки «доступа» к ним можно добиться выраженного противоопухолевого эффекта.
Наличие в опухоли повышенной экспрессии белка HER2-neu ассоциировано с высокой её агрессивностью и быстрым ростом. Это требует применения специальных препаратов, избирательно воздействующих на этот сигнальный путь. Наиболее часто с этой целью применяется трастузумаб – моноклональное антитело, связывающее HER2-neu.
В отдельных случаях применяются дополнительные молекулярные методы изучения опухоли. В этом случае проводится дополнительное изучение генома злокачественных клеток. При некоторых заболеваниях это может дать ценную информацию для лечения. К молекулярным методам исследования относится флюоресцентная гибридизация in situ (FISH) и полимеразная цепная реакция (ПЦР). Эти методы исследования являются наиболее точными, но их проведение может потребовать дополнительного времени, кроме того они являются достаточно дорогостоящими.
Получение второго мнения
В некоторых случаях, особенно при лечении редкого заболевания, полезным может оказаться получение второго мнения (консультации другого специалиста) по результатам гистологического исследования. Для этого вам понадобиться получить изготовленные стекла и опухолевые блоки и предоставить их на консультацию в выбранное вами учреждение. Дополнительно следует предоставить актуальную выписку из вашей истории болезни и результаты предыдущих гистологических исследований, так как это может дать врачу ценную информацию.
Обратите внимание: проведение дополнительных исследований с целью получения второго мнения может быть платным.
Внимание! Информация в данном разделе не является заменой квалифицированного мнения врача, представлена исключительно в образовательных целях и не является руководством к действию.
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
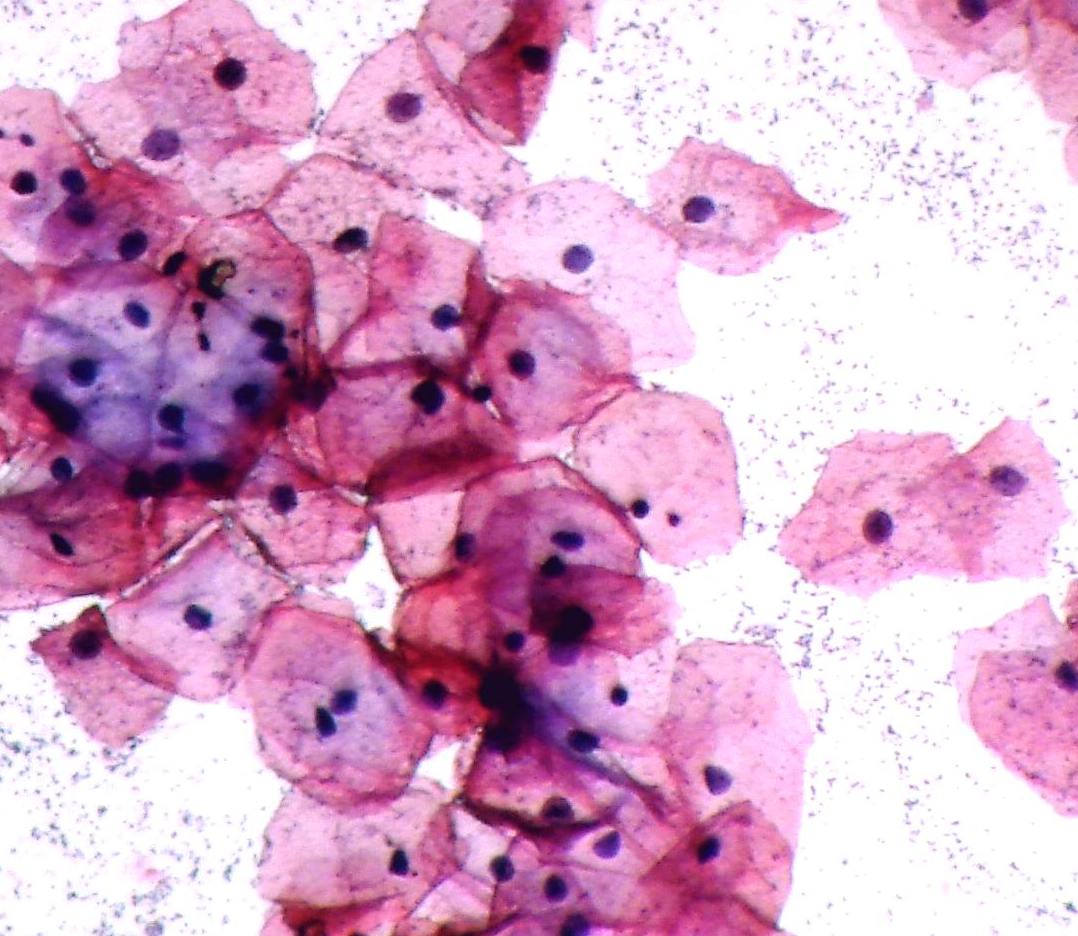
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
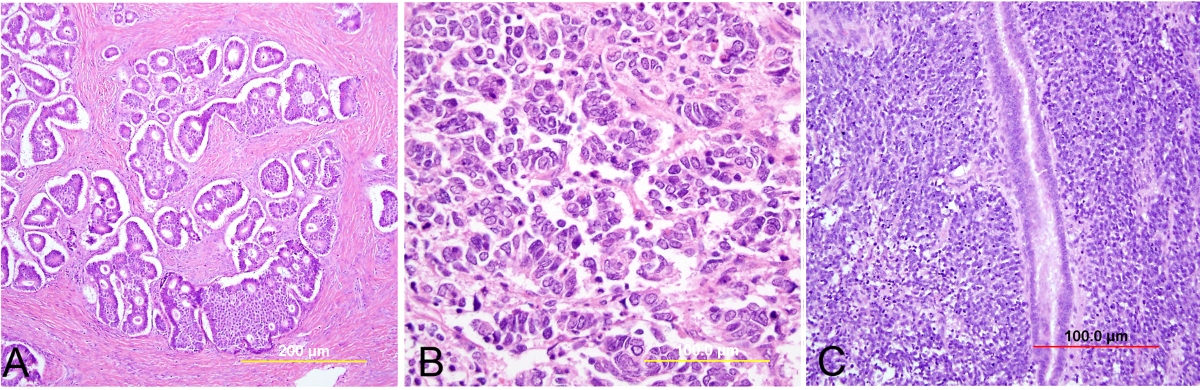
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
Цитологическое заключение до лечения включает:
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) | 90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком. Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена