Ципрофлоксацин или норфлоксацин что лучше при простатите
Ципрофлоксацин в урологической практике: современное значение и новые возможности
Опубликовано в журнале «Фарматека»
И.И. Деревянко
НИИ урологии МЗ РФ, Москва
Синтез соединений из группы фторхинолонов, осуществляемый в широких масштабах с целью поиска новых антимикробных препаратов, проводится свыше 15 лет. За указанный период в этом ряду химических веществ были разработаны высокоэффективные лекарственные средства, которые с успехом применяются для лечения различных бактериальных заболеваний, хламидиозов, микоплазменной инфекции.
В настоящее время фторхинолоны рассматриваются как важная самостоятельная группа химиотерапевтических препаратов в составе класса хинолонов – ингибиторов ДНК-гиразы, которые характеризуются высокой клинической эффективностью (в т.ч. при пероральном использовании), широкими показаниями к применению и составляют серьезную альтернативу b-лактамным антибиотикам широкого спектра действия.
Особенно большой клинический опыт накоплен в отношении применения ципрофлоксацина – одного из первых и наиболее активных препаратов этой группы, в настоящее время применяемых в клинике. Ципрофлоксацин очень широко используется в клинической практике в различных регионах мира, превосходя по частоте назначений все остальные фторхинолоны со сходным механизмом действия. В целом ципрофлоксацин был применен у 340 млн., офлоксацин – у 170 млн., левофлоксацин – у 150 млн., ломефлоксацин – у 15 млн., моксифлоксацин – у 10 млн. и спарфлоксацин – у около 5 млн. пациентов (Материалы компании Байер, 2002 г.).
К настоящему времени разработано более 15 фторхинолонов. Несколько новых активных соединений этого класса проходят расширенную клиническую апробацию, поэтому целесообразно привести общие сведения, характеризующие лекарственные препараты указанной группы.
Основные характеристики действия фторхинолонов состоят в следующем (В.П. Яковлев и соавт., 2000):
Ципрофлоксацин или норфлоксацин что лучше при простатите
Препараты класса хинолонов, используемые в клинической практике с начала 60-х годов, по механизму действия принципиально отличаются от других АМП, что обеспечивает их активность в отношении устойчивых, в том числе полирезистентных, штаммов микроорганизмов. Класс хинолонов включает две основные группы препаратов, принципиально различающихся по структуре, активности, фармакокинетике и широте показаний к применению: нефторированные хинолоны и фторхинолоны. Хинолоны классифицируют по времени введения в практику новых препаратов с улучшенными антимикробными свойствами. Согласно рабочей классификации, предложенной R. Quintiliani (1999), хинолоны разделяют на четыре поколения:
Классификация хинолонов
Пипемидовая (пипемидиевая) кислота
Перечисленные препараты зарегистрированы в России. За рубежом применяются и некоторые другие препараты класса хинолонов, главным образом фторхинолоны.
Хинолоны I поколения преимущественно активны в отношении грамотрицательной флоры и не создают высоких концентраций в крови и тканях.
Фторхинолоны, разрешенные для клинического применения с начала 80-х годов (II поколение), отличаются широким спектром антимикробного действия, включая стафилококки, высокой бактерицидной активностью и хорошей фармакокинетикой, что позволяет применять их для лечения инфекций различной локализации. Фторхинолоны, введенные в практику с середины 90-х годов (III-IV поколение), характеризуются более высокой активностью в отношении грамположительных бактерий (прежде всего пневмококков), внутриклеточных патогенов, анаэробов (IV поколение), а также еще более оптимизированной фармакокинетикой. Наличие у ряда препаратов лекарственных форм для в/в введения и приема внутрь в сочетании с высокой биодоступностью позволяет проводить ступенчатую терапию, которая при сопоставимой клинической эффективности существенно дешевле парентеральной.
Высокая бактерицидная активность фторхинолонов позволила разработать для ряда препаратов (ципрофлоксацин, офлоксацин, ломефлоксацин, норфлоксацин) лекарственные формы для местного применения в виде глазных и ушных капель.
Механизм действия
Спектр активности
Нефторированные хинолоны действуют преимущественно на грамотрицательные бактерии семейства Enterobacteriaceae
(Е.coli, Enterobacter spp., Proteus spp., Klebsiella spp., Shigella spp., Salmonella spp.), а также Haemophillus spp. и Neisseria spp. Оксолиновая и пипемидовая кислоты, кроме того, активны в отношении S.aureus и некоторых штаммов P.aeruginosa, но это не имеет клинического значения.
Фторхинолоны имеют значительно более широкий спектр. Они активны в отношении ряда грамположительных аэробных бактерий (Staphylococcus spp.), большинства штаммов грамотрицательных, в том числе Е.coli (включая энтеротоксигенные штаммы), Shigella spp., Salmonella spp., Enterobacter spp., Klebsiella spp., Proteus spp., Serratia spp., Providencia spp., Citrobacter spp., M.morganii, Vibrio spp., Haemophilus spp., Neisseria spp., Pasteurella spp., Pseudomonas spp., Legionella spp., Brucella spp., Listeria spp.
Кроме того, фторхинолоны, как правило, активны в отношении бактерий, устойчивых к хинолонам I поколения. Фторхинолоны III и, особенно, IV поколения высокоактивны в отношении пневмококков, более активны, чем препараты II поколения, в отношении внутриклеточных возбудителей (Chlamydia spp., Mycoplasma spp., M.tuberculosis, быстрорастущих атипичных микобактерий (M.avium и др.), анаэробных бактерий (моксифлоксацин). При этом не уменьшается активность в отношении грамотрицательных бактерий. Важным свойством этих препаратов является активность в отношении ряда бактерий, устойчивых к фторхинолонам II поколения. В связи с высокой активностью в отношении возбудителей бактериальных инфекций ВДП и НДП их иногда называют “респираторными” фторхинолонами.
В различной степени к фторхинолонам чувствительны энтерококки, Corynebacterium spp., Campylobacter spp., H.pylori, U.urealyticum.
Фармакокинетика
Все хинолоны хорошо всасываются в ЖКТ. Пища может замедлять всасывание хинолонов, но не оказывает существенного влияния на биодоступность. Максимальные концентрации в крови достигаются в среднем через 1-3 ч после приема внутрь. Препараты проходят плацентарный барьер, и в небольших количествах проникают в грудное молоко. Выводятся из организма преимущественно почками и создают высокие концентрации в моче. Частично выводятся с желчью.
При нарушении функции почек выведение хинолонов значительно замедляется.
Фторхинолоны, в отличие от нефторированных хинолонов, имеют большой объем распределения, создают высокие концентрации в органах и тканях, проникают внутрь клеток. Исключение составляет норфлоксацин, наиболее высокие уровни которого отмечаются в кишечнике, МВП и предстательной железе. Наибольших тканевых концентраций достигают офлоксацин, левофлоксацин, ломефлоксацин, спарфлоксацин, моксифлоксацин. Ципрофлоксацин, офлоксацин, левофлоксацин и пефлоксацин проходят через ГЭБ, достигая терапевтических концентраций.
Период полувыведения у различных фторхинолонов колеблется от 3-4 ч (норфлоксацин) до 12-14 ч (пефлоксацин, моксифлоксацин) и даже до 18-20 ч (спарфлоксацин).
При нарушении функции почек наиболее значительно удлиняется период полувыведения офлоксацина, левофлоксацина и ломефлоксацина. При тяжелой почечной недостаточности необходима коррекция доз всех фторхинолонов. При тяжелых нарушениях функции печени может потребоваться коррекция дозы пефлоксацина.
Нежелательные реакции
Общие для всех хинолонов
ЖКТ: изжога, боль в эпигастральной области, нарушение аппетита, тошнота, рвота, диарея.
ЦНС: ототоксичность, сонливость, бессонница, головная боль, головокружение, нарушения зрения, парестезии, тремор, судороги.
Аллергические реакции: сыпь, зуд, ангионевротический отек; фотосенсибилизация (наиболее характерна для ломефлоксацина и спарфлоксацина).
Характерные для хинолонов I поколения
Печень: холестатическая желтуха, гепатит.
Характерные для фторхинолонов (редкие и очень редкие)
Опорно-двигательный аппарат: артропатия, артралгия, миалгия, тендинит, тендовагинит, разрыв сухожилий.
Почки: кристаллурия, транзиторный нефрит.
Сердце: удлинение интервала QT на электрокардиограмме.
Показания
Хинолоны I поколения
Инфекции МВП: острый цистит, противорецидивная терапия при хронических формах инфекций. Не следует применять при остром пиелонефрите.
Кишечные инфекции: шигеллез, бактериальные энтероколиты (налидиксовая кислота).
Фторхинолоны
Инфекции ВДП: синусит, особенно вызванный полирезистентными штаммами, злокачественный наружный отит.
Инфекции НДП: обострение хронического бронхита, внебольничная и нозокомиальная пневмония, легионеллез.
Кишечные инфекции: шигеллез, брюшной тиф, генерализованный сальмонеллез, иерсиниоз, холера.
Менингит, вызванный грамотрицательной микрофлорой (ципрофлоксацин).
Бактериальные инфекции у пациентов с муковисцидозом.
Туберкулез (ципрофлоксацин, офлоксацин и ломефлоксацин в комбинированной терапии при лекарственноустойчивом туберкулезе).
Норфлоксацин, с учетом особенностей фармакокинетики, применяется только при кишечных инфекциях, инфекциях МВП и простатите.
Противопоказания
Для всех хинолонов
Аллергическая реакция на препараты группы хинолонов.
Дополнительно для хинолонов I поколения
Тяжелые нарушения функции печени и почек.
Тяжелый церебральный атеросклероз.
Дополнительно для всех фторхинолонов
Предупреждения
Аллергия. Перекрестная ко всем препаратам группы хинолонов.
Беременность. Достоверных клинических данных о токсическом действии хинолонов на плод нет. Имеются единичные сообщения о гидроцефалии, повышении внутричерепного давления и выбухании родничка у новорожденных, матери которых во время беременности принимали налидиксовую кислоту. В связи с развитием в эксперименте артропатий у неполовозрелых животных применение всех хинолонов при беременности не рекомендуется.
Кормление грудью. Хинолоны в небольших количествах проникают в грудное молоко. Есть сообщения о гемолитической анемии у новорожденных, матери которых принимали налидиксовую кислоту в период кормления грудью. В эксперименте хинолоны вызывали артропатии у неполовозрелых животных, поэтому при назначении их кормящим матерям рекомендуется перевести ребенка на искусственное вскармливание.
Фторхинолоны не рекомендуется назначать детям и подросткам. Однако имеющийся клинический опыт и специальные исследования применения фторхинолонов в педиатрии не подтвердили риск повреждения костно-суставной системы, в связи с чем допускается назначение фторхинолонов детям по жизненным показаниям (обострение инфекции при муковисцидозе; тяжелые инфекции различной локализации, вызванные полирезистентными штаммами бактерий; инфекции при нейтропении).
Гериатрия. У пожилых людей увеличивается риск разрыва сухожилий при применении фторхинолонов, особенно в сочетании с глюкокортикоидами.
Заболевания ЦНС. Хинолоны оказывают возбуждающее действие на ЦНС, поэтому их не рекомендуют применять пациентам с судорожным синдромом в анамнезе. Риск развития судорог повышается у больных с нарушениями мозгового кровообращения, эпилепсией и паркинсонизмом. При использовании налидиксовой кислоты возможно повышение внутричерепного давления.
Нарушения функции почек и печени. Хинолоны I поколения нельзя применять при почечной и печеночной недостаточности, так как вследствие кумуляции препаратов и их метаболитов повышается риск токсических эффектов. Дозы фторхинолонов при тяжелой почечной недостаточности подлежат коррекции.
Острая порфирия. Хинолоны не следует применять пациентам с острой порфирией, так как в эксперименте на животных они оказывают порфириногенный эффект.
Лекарственные взаимодействия
При одновременном применении с антацидами и другими препаратами, содержащими ионы магния, цинка, железа, висмута, может снижаться биодоступность хинолонов вследствие образования невсасывающихся хелатных комплексов.
Пипемидовая кислота, ципрофлоксацин, норфлоксацин и пефлоксацин могут замедлять элиминацию метилксантинов (теофиллин, кофеин) и повышать риск их токсических эффектов.
Риск нейротоксических эффектов хинолонов повышается при совместном применении с НПВС, производными нитроимидазола и метилксантинами.
Хинолоны проявляют антагонизм с производными нитрофурана, поэтому следует избегать комбинаций этих препаратов.
Хинолоны I поколения, ципрофлоксацин и норфлоксацин могут нарушать метаболизм непрямых антикоагулянтов в печени, что приводит к увеличению протромбинового времени и риску кровотечений. При одновременном применении может понадобиться коррекция дозы антикоагулянта.
Следует с осторожностью назначать фторхинолоны одновременно с препаратами, удлиняющими интервал QT, так как увеличивается риск развития сердечных аритмий.
При одновременном применении с глюкокортикоидами повышается риск разрыва сухожилий, особенно у пожилых людей.
При использовании ципрофлоксацина, норфлоксацина и пефлоксацина совместно с препаратами, ощелачивающими мочу (ингибиторы карбоангидразы, цитраты, натрия бикарбонат), увеличивается риск кристаллурии и нефротоксических эффектов.
При одновременном применении с азлоциллином и циметидином в связи с понижением канальцевой секреции замедляется элиминация фторхинолонов и повышаются их концентрации в крови.
Информация для пациентов
Препараты хинолонов при приеме внутрь следует запивать полным стаканом воды. Принимать не менее чем за 2 ч до или через 6 ч после приема антацидов и препаратов железа, цинка, висмута.
Строго соблюдать режим и схемы лечения в течение всего курса терапии, не пропускать дозу и принимать ее через равные промежутки времени. В случае пропуска дозы принять ее как можно скорее; не принимать, если почти наступило время приема следующей дозы; не удваивать дозу. Выдерживать длительность терапии.
Не использовать препараты с истекшим сроком годности.
В период лечения соблюдать достаточный водный режим (1,2-1,5 л/сут).
Не подвергаться прямому воздействию солнечных и ультрафиолетовых лучей во время применения препаратов и в течение не менее 3 дней после окончания лечения.
Проконсультироваться с врачом, если улучшение не наступает в течение нескольких дней или появляются новые симптомы. При появлении боли в сухожилиях следует обеспечить покой пораженному суставу и обратиться к врачу.
Современные подходы к терапии хронического бактериального простатита
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
На долю хронического бактериального простатита (ХБП) приходится 5–15% случаев заболевания [6]. Наиболее распространенными, по мнению большинства исследователей, этиологическими агентами ХБП являются такие грамотрицательные бактерии семейства Enterobacteriaceae, как Escherichia coli, которые обнаруживаются в 65–80% случаев инфекций. Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
В настоящее время обсуждается роль грамположительных бактерий — коагулазо-негативных стафилококков и стрептококков в развитии ХБП [5, 6, 7]. По нашим данным (Е. Б. Мазо и соавт., 2003, 2004) [1], основанным на результатах микробиологического исследования, которое проводилось в виде четырехстаканного теста Meares–Stamey у 70 больных с ХБП с 2002 г., именно коагулазо-негативные стафилококки играют ведущую роль (66%), если говорить об этиологии ХБП. Между тем на долю грамотрицательных патогенов приходится 19% случаев ХБП, а 15% составляют больные с Enterococcus faecalis. Аналогичными данными располагают М. Ф. Трапезникова и соавторы (2004), суммировавшие результаты идентификации 662 штаммов микроорганизмов у 264 больных ХБП, за которыми велось наблюдение в течение последних 13 лет. При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
К предрасполагающим факторам развития ХБП относятся: уретропростатический рефлюкс; фимоз; анально-генитальные сношения без предохранения; инфекции мочевых путей; острый эпидидимит; постоянные уретральные катетеры и проведение трансуретральных операций у мужчин с инфицированной мочой без предшествующей антимикробной терапии [1]. У пациентов с ХП может быть выявлено нарушение секреторной функции простаты, характеризующееся изменением состава секрета, т. е. снижением уровней фруктозы, лимонной кислоты, кислой фосфатазы, катионов цинка, магния и кальция; цинксодержащего антибактериального фактора простаты. При этом увеличиваются такие показатели, как рН, отношения изоферментов лактатдегидрогеназы-5 к лактатдегидрогеназе-1, белков воспаления — церулоплазмина и компонента комплемента С3. Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции (см. табл. 1).
| Таблица 1 Симптомы хронического простатита | ||
| Локализация боли в тазовой области | Расстройство мочеиспускания | Расстройство эякуляции |
| В промежности В половом члене В яичках В паховой области Над лоном В прямой кишке В крестце | Учащенное мочеиспускание Неполное опорожнение мочевого пузыря Слабая или прерывистая струя мочи Боль или ее усиление во время мочеиспускания | Боли во время или после эякуляции Гемоспермия |
Ведущее место в лабораторной диагностике ХБП принадлежит микробиологическому исследованию — четырехстаканному локализационному тесту, предложенному в 1968 г. Meares и Stamey [8]. Он состоит в получении, после тщательного туалета наружных половых органов (во избежание контаминации поверхностными бактериями), первой (10 мл) и второй (средней) порций мочи для бактериологического исследования, массажа предстательной железы (ПЖ) со взятием секрета для микроскопии и посева, а также третьей порции мочи (после взятия секрета) для посева (рис. 1). Количественные посевы первой и второй порций мочи выявляют бактерии в уретре и мочевом пузыре, в то время как при посевах секрета простаты и порции мочи после взятия секрета (третьей порции мочи) выявляют флору простаты. ХБП характеризуется воспалительной реакцией в секрете (при микроскопии определяется более 10 лейкоцитов в поле зрения при большом увеличении). После инкубации посевов подсчитывают количество колониеобразующих единиц (КОЕ).
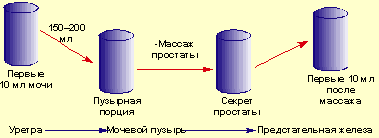 |
| Рисунок 1. Четырехстаканный локализационный тест Meares–Stamey |
Бактериологическое подтверждение ХБП мы проводим на основании, по крайней мере, одного из следующих критериев, предложенных K. G. Naber (2003):
Характерное для ХБП содержание патогенов в образцах примерно следующее:
первая порция мочи 3 КОЕ/мл;
вторая порция мочи 3 КОЕ/мл;
секрет простаты ≥ 10 4 КОЕ/мл;
третья порция мочи ≥ 10 3 КОЕ/мл.
Четкое соблюдение правил микробиологической диагностики и вышеуказанных критериев интерпретации результатов локализационного теста Meares — Stamey на большом количестве наблюдений позволят более точно определить частоту встречаемости истинных патогенов ХБП.
Антимикробная терапия. После идентификации этиологического агента и определения антибиотикорезистентности возникает необходимость назначения больному с ХБП антимикробной терапии. К факторам, оказывающим влияние на выбор антимикробного препарата для лечения ХБП, относятся: чувствительность идентифицированного микроорганизма к антибиотику, его способность в достаточной концентрации проникать через гематопростатический барьер и накапливаться в ткани и секрете простаты, сперме, а также способность препарата преодолевать экстрацеллюлярную полисахаридную оболочку, формируемую микроколониями бактерий, и хорошая переносимость при длительном пероральном приеме. Идеальный антибактериальный препарат для лечения ХБП должен быть жирорастворимым, слабощелочным, с коэффициентом диссоциации, способствующим максимальной концентрации препарата в простате [2]. Антимикробные средства из группы фторхинолонов на сегодняшний день отвечают вышеперечисленным требованиям и являются препаратами выбора для лечения ХБП. Особенностью антибактериального действия фторхинолонов является наличие двух мишеней действия в бактериальной клетке, каковыми являются ферменты (топоизомеразы II типа), ответственные за изменения пространственной конфигурации бактериальной ДНК: ДНК-гираза и топоизомераза IV. ДНК-гираза осуществляет суперспирализацию бактериальной ДНК, а топоизомераза IV — разделение дочерних хромосом в процессе репликации. Ключевым моментом в действии фторхинолонов является образование трехкомпонентного комплекса (бактериальная ДНК–фермент–фторхинолон). Указанный комплекс предотвращает репликацию бактериальной ДНК. Благодаря тому, что топоизомеразы обладают расщепляющей активностью, происходит разрушение молекулы ДНК (С. В. Сидоренко, 2002).
 |
| Рисунок 2. Классификация фторхинолонов (по K.G. Naber,1998) |
В настоящее время в практическое здравоохранение внедрены новые антимикробные препараты из группы фторхинолонов III и IV поколений, которые проявляют активность в отношении как грамотрицательных и грамположительных бактерий, так и атипичных внутриклеточных микроорганизмов, а также обладают способностью воздействовать на бактерии в биологических пленках (см. рис. 2). Антимикробная активность in vitro фторхинолонов III поколения — спарфлоксацина и левофлоксацина, а также фторхинолона IV поколения — моксифлоксацина наглядно представлена в таблице 2.
| Таблица 2 Антимикробная активность in vitro спарфлоксацина, левофлоксацина и моксифлоксацина (МПК90, мкг/мл) [4] | |||
| Микроорганизмы | Спарфлоксацин | Левофлоксацин | Моксифлоксацин |
| Acinetobacter spp. | 0,25 | 16 | 0,5 |
| Citrobacter freundii | 0,25 | 0,5 | 0,5 |
| Enterobacter cloacae | 0,5 | 0,5 | 0,5 |
| Escherichia coli | 0,12 | 0,12 | 0,5 |
| Klebsiella pneumoniae | 0,25 | 0,25 | 0,5 |
| Proteus mirabilis | 0,5 | 0,25 | 0,12 |
| Pseudomonas aeruginosa | 8 | 4 | 16 |
| Staphylococcus epidermidis | 1 | 1 | 2 |
| Staphylococcus saprophyticus | 0,25 | — | 0,5 |
| Enterococcus faecalis | 2 | 16 | 4 |
В 2004 г. мы сравнили чувствительность 25 различных штаммов коагулазо-негативных стафилококков — наиболее распространенных, по нашим данным (Е. Б. Мазо и соавт., 2003, 2004), этиологических агентов ХБП — к левофлоксацину, спарфлоксацину и моксифлоксацину. Бактериологическое исследование проводили классическим методом: выполняли посев мочи и секрета простаты на питательные среды с выделением чистой культуры и идентификацией выделенных штаммов при помощи полуавтоматического микробиологического анализатора Sceptor (Becton Dickinson, USA). Чувствительность выделенных микроорганизмов к левофлоксацину, спарфлоксацину и моксифлоксацину определяли дискодиффузионным методом на среде Мюллера–Хинтона. Результаты оценивали по значениям диаметров зон задержки роста. Всего было изучено 25 штаммов коагулазо-негативных стафилококков (21 — Staphylococcus haemolyticus, 3 — Staphylococcus epidermidis, 1 — Staphylococcus warnerii), выделенных в диагностическом титре из секрета простаты и мочи у больных ХБП при четырехстаканном тесте Meares–Stamey. Проведенный нами анализ чувствительности коагулазо-негативных стафилококков к фторхинолонам III и IV поколений показал наиболее высокую чувствительность этих бактерий к моксифлоксацину — у 24 (96%) штаммов. К левофлоксацину оказались чувствительны 21 (84%), а к спарфлоксацину 20 (80%) штаммов коагулазо-негативных стафилококков. Пять резистентных к спарфлоксацину штаммов были выделены нами у больных после длительной антимикробной терапии этим препаратом. Был выделен также штамм гемолитического стафилококка, резистентный ко всем фторхинолонам III и IV поколений у больного, ранее принимавшего в течение 6 нед моксифлоксацин. Проведенное исследование продемонстрировало высокую чувствительность коагулазо-негативных стафилококков, выделенных от больных ХБП, к фторхинолонам III и IV поколений. Чувствительность исследованных бактерий к моксифлоксацину оказалась наиболее высокой, в то время как к левофлоксацину и спарфлоксацину была практически одинаково ниже. Таким образом, длительная антимикробная терапия моксифлоксацином может привести к селекции устойчивых штаммов и развитию перекрестной резистентности к фторхинолонам III и IV поколений.
На сегодняшний день проведено ограниченное количество клинических исследований применения фторхинолонов в лечении ХБП. Результаты таких исследований, с периодом наблюдения не менее 6 мес, представлены в таблице 3.
Как видно из данных, приведенных в таблице 3, несмотря на существенные различия в количестве больных, принимавших участие в исследованиях, бактериальная эрадикация при различной длительности терапии фторхинолонами, наблюдалась более чем у 60% пациентов. Проведение подобных исследований в будущем, с соблюдением стандартов микробиологической диагностики, позволит выработать единый подход к рациональной антимикробной терапии ХБП.
Согласно актуальным на сегодняшний день рекомендациям Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин, принятым в 2001 г., длительность антимикробной терапии ХБП фторхинолонами или триметопримом должна составлять 2 нед (после установления предварительного диагноза). После повторного обследования больного антимикробную терапию рекомендуют продолжать суммарно в течение 4–6 нед только при положительном результате микробиологического исследования секрета простаты, взятого до начала лечения, или в случае, если у больного улучшилось состояние после приема антимикробных препаратов [2].
Антимикробные препараты, используемые для лечения ХБП, а также способы их применения приведены в таблице 4.
| Таблица 4 Способы применения антимикробных препаратов для лечения хронического бактериального простатита | ||
| Группа препаратов | Препараты | Способ применения |
| Фторхинолоны | Ципрофлоксацин (сифлокс, ципролет, цифран) | По 500 мг 2 раза в сутки |
| Офлоксацин (джеофлокс, заноцин, офлоксин 200) | По 400 мг 2 раза в сутки | |
| Ломефлоксацин (ксенаквин, ломфлокс, максаквин) | По 400 мг 1 раз в сутки | |
| Левофлоксацин (таваник) | По 500 мг 1 раз в сутки | |
| Спарфлоксацин (спарфло) | Первый прием 400 мг, затем по 200 мг 1 раз в сутки | |
| Моксифлоксацин (авелокс) | По 400 мг 1 раз в сутки | |
| Триметоприм/ сульфаметоксазол | Ко-тримоксазол (бикотрим, бисептол) | По 960 мг 2 раза в сутки |
Следует отметить, что больные с ХБП должны принимать антибиотик фторхинолонового ряда в течение длительного периода (от 4 до 6 нед) для предотвращения рецидива инфекции нижних мочевых путей. Продолжительная терапия антибиотиками в низких профилактических дозах или супрессивная антимикробная терапия могут применяться в случаях рецидивирующего или невосприимчивого к лечению простатита.
Литература
С. В. Попов
А. К. Чепуров, доктор медицинских наук, профессор
В. И. Карабак, кандидат медицинских наук
РГМУ, Москва
