Цикл кребса что это такое
Цикл Кребса простым языком
Что такое цикл Кребса
Функции цикла Кребса:
Атомы водорода, высвобождающиеся в окислительно-восстановительных реакциях, доставляются в цепь переноса электронов при участии НАД- и ФАД- зависимых дегидрогеназ, в результате чего происходит образование 12 высокоэнергетических фосфатных связей: синтез 12 молекул аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной кислоты (АДФ).
Как работает цикл Кребса?
В организме аминокислоты, жирные кислоты и пируват образуют ацетил-КоА.
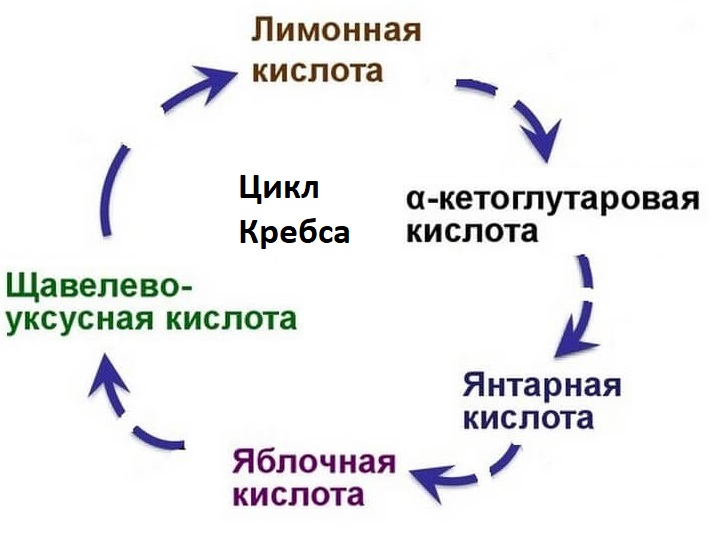
Когда ацетил-КоА попадает в митохондриальный матрикс, он связывается с молекулой оксалацетата и превращается в лимонную кислоту (цитрат). Цитрат, в свою очередь, под действием фермента аконитазы превращается в цис-аконитат, оставляя молекулу воды.
В свою очередь цис-аконитат превращается в изоцитрат под действием фермента изоцитратдегидрогеназы. Изоцитрат превращается в альфа-кетоглутарат под действием изоцитратдегидрогеназы.
Альфа-кетоглутарат превращается в сукцинил-КоА альфа-кетоглутаратдегидрогеназой и добавлением ацетил-КоА. Он подвергается сукцинату под действием сукцинат-тиокиназы. Сукцинатдегидрогеназа превращает его в фумарат. Фумарат превращается в L-малат через фумаразу. L-малат под действием фермента малатдегидрогеназы восстанавливает оксалацетат, который может снова вступать в реакцию с молекулой ацетил-КоА и повторять цикл.
Стадии цикла Кребса
Окисление ацетильного остатка происходит в несколько стадий, образующих циклический процесс из 8 основных этапов:
Основные этапы цикла Кребса
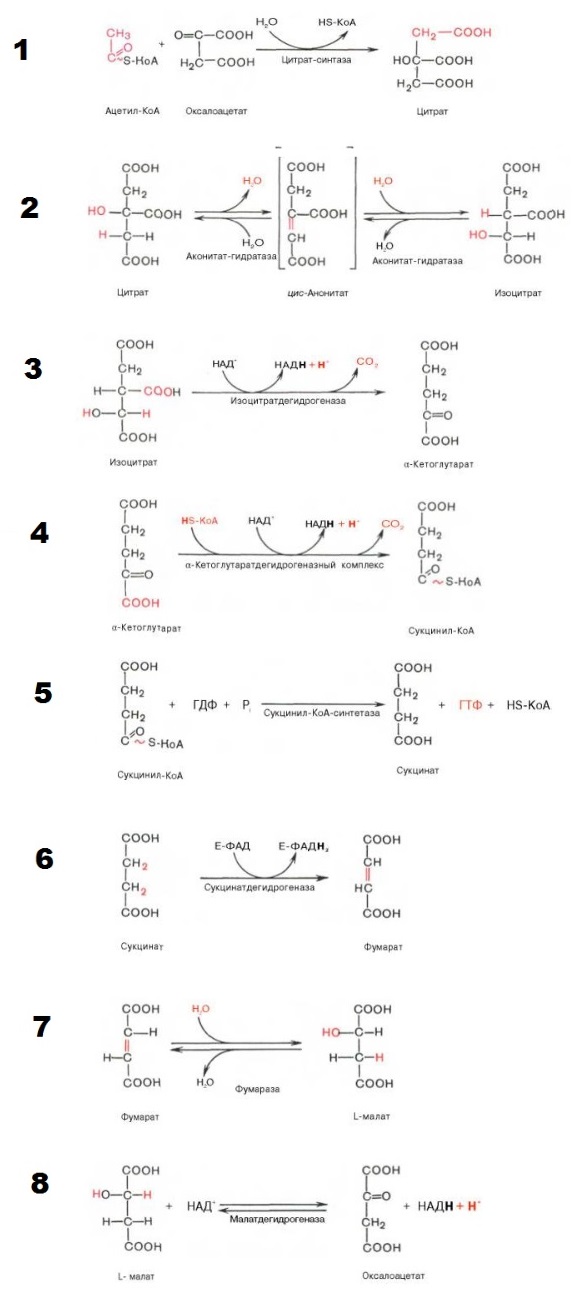
I этап
Конденсация ацетил-КоА и оксалоацетата с образованием цитрата.
Происходит реакция отщепление карбоксильной группы аминокислот, в процессе которой образуется ацетил-КоА
При соединении с молекулой щавелевой кислоты получается цитрат
*фигурирует в буферных обменах.
На данном этапе кофермент А полностью высвобождается, и получаем молекулу воды.
Данная реакция необратима.
II этап
Превращение цитрата в изоцитрат.
III этап
Превращение изоцитрата в а-кетоглутарат.
*Альфа-кетоглутарат участвует в регуляции всасывания аминокислот, нормализует метаболизм и положительно влияет на антистрессорные процессы.
Также образуется NADH ( аллостерический фермент)
IV этап
Окисление α-кетоглутарата до сукцинил-КоА
V этап
Превращение сукцинил-КоА в сукцинат.
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту ( сукцинат ). Так же происходит образование высокоэргической фосфатной связи ГТФ за счет тиоэфирной связи сукцинил-КоА.
VI этап
Дегидрогенирование сукцината. Образование фумарата.
VII этап
Образование малата из фумарата.
Под влиянием фермента фумаратгидратазы ( фумаразы ). Образовавшаяся при этом фумаровая кислота гидратируется,
VIII этап
Превращение малата в оксалоацетат.
Под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат.
Происходит полное «сгорание» одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА. А коферменты (НАД + и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться.
Реакции цикла Кребса по стадиям
Для облегчения запоминания ферментативных реакций цикла:
ЩУКа съела ацетат, получается цитрат
через цис-аконитат будет он изоцитрат
водороды отдав НАД, он теряет СО2
этому безмерно рад альфа-кетоглутарат
окисление грядёт: НАД похитит водород
В1 и липоат с коэнзимом А спешат,
отбирают СО2, а энергия едва
в сукциниле появилась сразу ГТФ родилась
и остался сукцинат. вот добрался он до ФАДа,
водороды тому надо водороды потеряв,
стал он просто фумарат. фумарат воды напился,
и в малат он превратился тут к малату НАД пришёл,
водороды приобрёл ЩУКа снова объявилась
и тихонько затаилась Караулить ацетат…
Цикл Кребса (цикл трикарбоновых кислот)
Углекислый газ стимулирует дыхание, в то время как АТФ обеспечивает клетки энергией, необходимой для синтеза белков из аминокислот и репликации дезоксирибонуклеиновой кислоты (ДНК); оба жизненно важны для снабжения энергией и для продолжения жизни. По сути, цикл Кребса “отвечает” за основной источник энергии во всех живых организмах.
Углекислый газ стимулирует дыхание, в то время как АТФ обеспечивает клетки энергией, необходимой для синтеза белков из аминокислот и репликации дезоксирибонуклеиновой кислоты (ДНК); оба жизненно важны для снабжения энергией и для продолжения жизни. По сути, цикл Кребса “отвечает” за основной источник энергии во всех живых организмах.
Роль цикла трикарбоновых кислот
Цикл Кребса, также известный как цикл трикарбоновых кислот (TCA), был впервые обнаружен в 1937 году немецким биохимиком Гансом Адольфом Кребсом. Его весьма подробные и обширные исследования в области клеточного метаболизма и других научных исследований принесли ему Нобелевскую премию по физиологии и медицине в 1953 году. Помимо цикла лимонной кислоты, Кребс также идентифицировал цикл мочевины в 1932 году.
Цикл Кребса также известен как цикл лимонной кислоты, потому что лимонная кислота является самым первым продуктом, генерируемым этой последовательностью химических превращений, и она также регенерируется в конце цикла.
Цикл Кребса, вероятно, является наиболее важной частью процесса аэробного дыхания, поскольку он стимулирует образование переносчиков электронов. Они важны, поскольку несут энергию, используемую для создания большого количества АТФ.
Как работает цикл Кребса?
Цикл трикарбоновых кислот происходит только в митохондриальном матриксе, во внутренней части митохондрий.
Цикл Кребса, также называемый циклом лимонной кислоты, является вторым важным этапом окислительного фосфорилирования. После того, как гликолиз расщепляет глюкозу на более мелкие 3-углеродные молекулы, цикл Кребса передает энергию от этих молекул переносчикам электронов, которые будут использоваться в цепи переноса электронов для производства АТФ.
Большинство организмов используют глюкозу в качестве основного источника топлива, но должны расщеплять ее и накапливать энергию в АТФ и других молекулах. Цикл Кребса содержится в митохондриях. Внутри митохондриальной матрицы реакции цикла Кребса добавляют электроны и протоны к ряду электронных носителей, которые затем используются цепочкой переноса электронов для производства АТФ.
Цикл Кребса начинается с продуктов гликолиза, которые представляют собой две трехуглеродные молекулы, известные как пируват. Эта молекула является кислой, поэтому цикл Кребса также называют циклом трикарбоновых кислот. В ходе ряда реакций эти молекулы далее распадаются на диоксид углерода. Энергия от молекул передается другим молекулам, называемым переносчиками электронов. Эти молекулы переносят накопленную энергию в цепь переноса электронов, которая, в свою очередь, создает АТФ.
Первый этап использования глюкозы, гликолиз, производит небольшое количество АТФ, а также молекулы, которые будут обрабатываться с помощью цикла Кребса. Во время гликолиза одна молекула глюкозы расщепляется на две более мелкие трехуглеродные молекулы, пируват. Затем он превращается в ацетил-КоА. Затем ацетил-КоА используется в цикле Кребса для производства нескольких основных продуктов. В свою очередь, эти продукты стимулируют образование АТФ, основного источника энергии клетки.
Подробный расклад цикла Кребса и его взаимодействие с различными процессами организма доступны в первом модуле Школы Anti-Age Expert.
Регуляция гликолиза и цикл Кребса
Содержание
Регуляция гликолиза [ править | править код ]
В разных тканях гликолиз выполняет разные функции. В белых мышцах, сетчатке и эритроцитах в процессе гликолиза осуществляется анаэробный синтез АТФ, а в качестве побочного продукта образуется молочная кислота. При аэробном гликолизе в мышцах образуется пируват, который окисляется в цикле Кребса. Продукты цикла Кребса поступают в дыхательную цепь, и уже в ней синтезируется АТФ. В печени и жировой ткани в ходе аэробного гликолиза и пентозофосфатного пути образуется пируват, используемый для синтеза жирных кислот. Помните, что регуляция метаболических путей всегда имеет свою логику, именно функция процесса определяет способы его регуляции.
На стадии поступления глюкозы в клетку процесс гликолиза регулируется транспортерами глюкозы (ГЛЮТ), глюкокиназой или гексокиназой, фосфофруктокиназой-1, пируваткиназой и пируватдегидрогеназой.
Транспортеры глюкозы ГЛЮТ [ править | править код ]
Глюкоза поступает в клетку с помощью транспортеров глюкозы (ГЛЮТ). Существует несколько типов транспортеров глюкозы — ГЛЮТ1, ГЛЮТ2 и т.д. Все они расположены в плазматической мембране, кроме ГЛЮТ4, который регулирует поступление глюкозы в клетку и тем самым регулирует гликолиз в мышцах и жировой ткани. При голодании молекулы ГЛЮТ4 располагаются во внутриклеточных везикулах. После приема пищи под действием сигнала инсулина происходит перемещение ГЛЮТ4 в плазматическую мембрану, и клетка начинает интенсивно поглощать глюкозу.
Глюкокиназа и гексокиназа [ править | править код ]
Эти ферменты катализируют первую реакцию гликолиза — фосфорилирование глюкозы до глюкозо-6-фосфата. Гексокиназа содержится во многих тканях; у этого фермента низкое значение Km (т.е. высокое сродство к глюкозе). Гексокиназа по принципу обратной связи ингибируется продуктом реакции — глюкозо-6-фосфатом. Глюкокиназа содержится в печени и р-клетках поджелудочной железы. У глюкокиназы, напротив, высокое значение Km (т.е. низкое сродство к глюкозе). В печени она активна при высоких концентрациях глюкозы (до 15 ммоль/л), которая после приема углеводсодержащей пищи поступает из кишечника в печень по воротной вене печени. <Важно: глюкокиназа находится в печени.)
Фосфофруктокиназа-1 [ править | править код ]
Активация фосфофруктокиназы-1. Этот фермент активируется фруктозо-2,6-бисфосфатом (Ф-2,6-бисФ). Кроме того, АМФ также активирует фосфофруктокиназу-1. Высокие концентрации АМФ говорят о том, что клетка испытывает недостаток в энергии и требуется усилить синтез АТФ. Поэтому АМФ способствует интенсификации гликолиза.
(В печени образование фруктозо-2,6-бисфосфата активируется под действием инсулина и ингибируется под действием глюкагона. В скелетных мышцах образование этого вещества стимулируется высокой, а ингибируется низкой концентрацией фруктозо-6-фосфата.)
Ингибирование фосфофруктокиназы-1. Высокая концентрация АТФ ингибирует фосфофруктокиназу-1, и интенсивность гликолиза снижается. Кроме того, этот фермент ингибируется цитратом.
Пируваткиназа [ править | править код ]
Ингибирование пируваткиназы. В печени пируваткиназу ингибируют аланин и циклический АМФ. Эти вещества образуются при голодании. При голодании секретируется глюкагон, который стимулирует синтез циклического АМФ. Аланин же образуется при распаде мышечных белков при голодании и используется для синтеза глюкозы в процессе глюконеогенеза. При ингибировании пируваткиназы блокируется использование фосфоенолпирувата в гликолизе, и в клетке интенсифицируется глюконеогенез.
Активация пируваткиназы. В печени пируваткиназа активируется фруктозо-1,6-бисфосфатом (активация по принципу прямой связи). Этот процесс особенно важен при переходе от периода голодания к липогенезу. При голодании пируваткиназа неактивна, и в клетке интенсивно идет глюконеогенез, а при липогенезе пируваткиназа активируется.
Пируватдегидрогеназа [ править | править код ]
Пируватдегидрогеназа — комплекс из трех ферментов, который расположен в митохондриях. Он контролирует скорость поступления пирувата в цикл Кребса.
Активация пируватдегидрогеназы. После приема богатой углеводами пищи под действием инсулина происходит активация пируватдегидрогеназы в печени и жировой ткани, где пируват требуется для синтеза жирных кислот. Фермент также активируется своим субстратом (пируватом) и коферментами КоА и НАД+. Наконец, повышение концентрации АДФ также активирует пируватдегидрогеназу. Уровень АДФ повышается, когда клетка испытывает недостаток в энергии. Повышение концентрации АДФ свидетельствует о необходимости активации цикла Кребса и дыхательной цепи для синтеза АТФ.
Ингибирование пируватдегидрогеназы. Высокие концентрации АТФ ингибируют пируватдегидрогеназу, и окисление пирувата в цикле Кребса приостанавливается. Кроме того, активность фермента ингибируют продукты пируватдегидрогеназной реакции — ацетил-КоА и НАДН. Такая ситуация создается при голодании, когда в качестве источника энергии используются жирные кислоты, из которых образуется ацетил-КоА. В этом случае ингибирование пируватдегидрогеназы способствует сохранению пирувата для синтеза глюкозы. [Примечание: во время голодания пируват образуется из резервных запасов, т.е. из глюкозы, образующейся из гликогена и аминокислот, образующихся при распаде белков мышц.]
Регуляция цикла Кребса [ править | править код ]
В разных тканях цикл Кребса выполняет разные функции. Так, в мышцах и головном мозге в цикле Кребса ацетил-КоА окисляется с образованием НАДН и ФАДН2, которые используются для синтеза АТФ в дыхательной цепи. В печени при голодании ацетил-КоА не окисляется в цикле Кребса. Вместо этого цикл Кребса используется для синтеза малата из некоторых аминокислот, который превращается в оксалоацетат и вступает в глюконеогенез. После приема пищи ацетил-КоА в печени и жировой ткани поступает в цикл Кребса на очень короткий период. В первой реакции цикла он преобразуется в цитрат, затем экспортируется в цитозоль и используется для биосинтеза жирных кислот.
Изоцитратдегидрогеназа [ править | править код ]
Изоцитратдегидрогеназа ингибируется при высокой концентрации НАДН. Кофермент изоцитратдегидрогеназы — НАД+. Когда НАД+ восстанавливается до НАДН, изоцитратдегидрогеназа инактивируется, поскольку ее кофермент отсутствует.
Нарушения активности пируватдегидрогеназы [ править | править код ]
Недостаточность тиамина [ править | править код ]
В нервной ткани ведущую роль в синтезе АТФ играют гликолиз и дальнейший синтез ацетил-КоА в пируватдегидрогеназной реакции, который затем окисляется в цикле Кребса. Для нормального функционирования пируватдегидрогеназы необходим тиамин. При недостаточности тиамина активность фермента снижается, и нервная ткань испытывает недостаток в производимой энергии. Развиваются гиперлактатемия, заболевания нервной системы; в тяжелых случаях — болезнь Вернике, психоз Корсакова. Недостаточность тиамина наблюдается при хроническом алкоголизме, из-за плохого питания.
(Запомните, что, хотя ацетил-КоА может образовываться из жирных кислот независимо от пируватдегидрогеназной реакции, головной мозг не может использовать жирные кислоты в качестве источника энергии, поскольку они не проходят через гематоэнцефалический барьер.)
Болезнь Ли [ править | править код ]
Некоторые формы болезни Ли вызываются дисфункцией пируватдегидрогеназы.
Метаболизм. Центральные метаболические пути. Цикл Кребса
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Метаболизм. Центральные метаболические пути. Цикл Кребса
Метаболизм — совокупность химических реакций, протекающих в клетках организма с момента поступления пищевых веществ в организм до образования конечных продуктов обмена.
Функции метаболизма:
Метаболический путь — последовательность химических превращений вещества. Метаболические пути многоэтапны, взаимосвязаны, регулируемы, скоординированы в пространстве. Они бывают линейными (распад и синтез гликогена, гликолиз и др.) и циклическими (цикл трикарбоновых кислот, орнитиновый цикл):
— пример линейного метаболического пути, где S — исходный субстрат, Р — конечный продукт, А, В, С, D — метаболиты (промежуточные продукты).
Ферменты (фермент), которые определяют скорость всего процесса в целом, называются ключевыми, катализируют необратимые реакции, имеют четвертичную структуру и легко регулируются.
2 стороны метаболизма
Анаболизм и катаболизм тесно взаимосвязаны:
Прямое преобразование химической энергии субстратов в энергию макроэргических связей АТФ невозможно. Этот процесс разбит на две стадии:
Рассмотрим 1 этап — высвобождение энергии на примере общей схемы катаболизма.
Конечные продукты обмена:
этап катаболизма происходит в желудочно-кишечном тракте и сводится к реакциям гидролиза пищевых веществ. Химическая энергия рассеивается в виде тепла.
этап (внутриклеточный катаболизм) происходит в цитоплазме и митохондриях. Химическая энергия частично рассеивается в виде тепла, частично накапливается в виде восстановленных коферментных форм, частично запасается в макроэргических связях АТФ (субстратное фосфорилирование).
заключительный этап катаболизма протекает в митохондриях и сводится к образованию конечных продуктов обмена СО2 и Н2О. Химическая энергия частично рассеивается в виде тепла, 40–45 % ее запасается в виде АТФ (окислительное фосфорилирование).
Общая схема катаболизма пищевых веществ
АТФ и адениловая система клетки
В энергетическом обеспечении клетки важнейшую роль играет адениловая система, которая включает АМФ, АДФ, Н4Р2О7 (пирофосфат), Н3РО4 (неорганический фосфат) и цАМФ (циклический АМФ). Вопрос об адениловой системе сводится к процессам распада, синтеза АТФ и ее значению для процессов жизнедеятельности клетки. Главным компонентом адениловой системы клетки является АТФ. Это макроэргическое соединение. Как известно, к макроэргическим относятся соединения, при гидролизе которых высвобождается не менее, чем 5 ккал/моль. В ряду макроэргов клетки АТФ отводится главная роль.
Две фосфоангидридные связи в молекуле АТФ являются макроэргическими. Свободная энергия гидролиза каждой из них равна 7,3 ккал/моль (32 кДж/моль). АТФ обладает высоким потенциалом переноса фосфатных групп на другие вещества (глюкоза, глицерол), тем самым активируя их. С другой стороны, макроэрги, которые имеют больший энергетический потенциал, чем АТФ (например, креатинфосфат), могут переносить свою фосфатную группу на АДФ с образованием АТФ. Таким образом, АТФ занимает центральное положение в ряду других фосфорилированных соединений клетки и является универсальным макроэргом клетки. Это так называемая клеточная энергетическая валюта.
АТФ используется клетками для процессов биосинтеза (анаболические реакции), активации многих молекул (глюкоза, глицерол), выполнения механической работы, переноса веществ через мембраны, обеспечивает точную передачу генетической информации и др. При этом АТФ может гидролизоваться двумя способами:
Синтез АТФ носит название фосфорилирования и описывается уравнением:
Эта реакция происходит при условии обеспечения энергией в количестве не менее
32 кДж/моль.
Если источником этой энергии является транспорт электронов по дыхательной цепи внутренней мембраны митохондрий, говорят об окислительном фосфорилировании. Это главный путь синтеза АТФ в аэробных клетках.
Если источником энергии является гидролиз макроэргической связи субстрата, говорят о субстратном фосфорилировании. Такой механизм имеет место в цитозоле и митохондриях и может происходить в анаэробных условиях.
У растений существует фотосинтетическое фосфорилирование в хлоропластах. Источником энергии в данном случае являются кванты солнечного света.
Следует особо подчеркнуть, что процесс окислительного фосфорилирования тесно связан (сопряжен) с окислительно-восстановительными реакциями (ОВР), а именно с реакцией окисления водорода кислородом до воды — тканевым дыханием. Реакция образования воды in vitro (в пробирке) сопровождается одномоментным выделением около 230 кДж /моль энергии и описывается как реакция взрыва гремучего газа. В живой клетке такой путь термодинамически невозможен, поэтому окисление водорода до воды in vivo (в организме) характеризуется двумя важными особенностями.
Во-вторых, выделение энергии происходит постепенно, порциями, для чего процесс окисления водорода осуществляется в несколько стадий с участием ферментов дыхательной цепи. Часть этой энергии запасается в виде АТФ в реакции окислительного фосфорилирования.
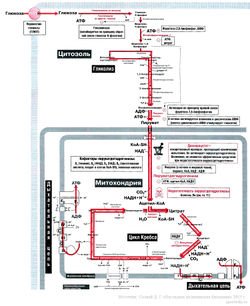
Восстановленные субстраты, поставляющие атомы водорода для дыхательной цепи, это небольшие молекулы (карбоновые кислоты, кетокислоты, аминокислоты и др.). Основными поставщиками восстановленных субстратов являются центральные метаболические пути — окислительное декарбоксилирование пировиноградной кислоты и цикл лимонной кислоты. Оба локализованы в матриксе митохондрий, в ходе этих процессов происходят реакции декарбоксилирования (большая часть всей углекислоты, образующейся в клетках, образуется именно здесь). Кроме того, как уже говорилось, в ходе этих процессов происходят реакции дегидрирования субстратов, образуются восстановленные коферментные формы НАДН·Н + и ФАДН2, водород которых поступает в дыхательную цепь внутренней мембраны митохондрий, где происходит его окисление кислородом до воды и синтез АТФ.
Переходим к рассмотрению центральных метаболических путей.
Окислительное декарбоксилирование пирувата
Осуществляется при участии набора ферментов, объединенных в пируватдегидрогеназный комплекс (ПВДГК). Это мультиферментная система, которая включает 3 фермента и 5 коферментов (все они являются водорастворимыми витаминами).
Е1 — пируватдекарбоксилаза. Коферментом является активная форма витамина В1, тиамина — ТПФ (тиаминпирофосфат).
Е2 — дигидролипоилацетилтрансфераза. Коферментом является витаминоподобное вещество — липоевая кислота (липоил), которая может временно превращаться в дигидролипоил, присоединив 2 атома водорода. Липоил может также переносить ацетильные остатки.
С этим ферментом также работает активная форма пантотеновой кислоты — КоА-SH, которая принимает ацетильный остаток от липоевой кислоты.
Е3 — дигидролипоилдегидрогеназа. Коферментом является ФАД — активная форма витамина В2, рибофлавина. С работой этого фермента связан также кофермент НАД + — активная форма витамина РР, никотиновой кислоты.
Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
Таким образом, в результате образуются конечные продукты — СО2, атомы водорода для дыхательной цепи в составе НАДН·Н + и богатое энергией макроэргическое соединение ацетил-КоА. Лимитирующей реакцией в этом процессе является пируватдекарбоксилазная реакция. Поскольку этот фермент в качестве кофермента использует ТПФ, при недостатке тиамина в пище нарушается окисление пирувата — процесса, который поставляет клеткам энергию. Возникает энергодефицит, что требует коррекции нарушения метаболизма с помощью тиамина.
Регуляция пируватдегидрогеназного комплекса
Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (ЦТК)
Цикл лимонной кислоты локализован в матриксе митохондрий. Это циклический процесс из восьми последовательных реакций, в результате которых происходит декарбоксилирование и дегидрирование ацетил-КоА (универсального клеточного топлива).
Схема лимоннокислого цикла Кребса
Ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратдегидрогеназа;
4 — α-кетоглутаратдегидрогеназный комплекс; 5 — сукцинил-КоА синтетаза; 6 — сукцинатдегидрогеназа; 7 — фумаратгидратаза; 8 — малатдегидрогеназа.
Функции цикла Кребса
Регуляция ЦТК
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.