лучистый венец головного мозга за что отвечает
Лучистый венец головного мозга за что отвечает
Клетки яйценосного холмика (cumulus oophorus), или кумулюсные, иногда называемые лучистым венцом (corona radiata), представляют собой специализированные гранулезные клетки, непосредственно примыкающие к ооциту. Кроме участия в созревании цитоплазмы ооцита, они играют важную роль в его развитии, в том числе обеспечении блокады мейотического деления и индукции овуляции. Термин «овуляция» употребляется здесь в широком смысле и включает лютеинизацию и разрыв фолликула, возобновление мейотического деления ооцита.
Важнейший этап ЛГ-индуцируемой овуляции — связанный с кумулюсными клетками рост яйценосного холмика. Пристеночные гранулезные клетки экспрессируют рецептор ЛГ, который делает их чувствительными к ЛГ и благодаря которому они начинают секретировать белки семейства ЭФР — амфирегулин, эпирегулин и бета-целлюлин. Считается, что последние через паракринные механизмы регуляции запускают рост яйценосного холмика.
В это время кумулюсные клетки проникают во внеклеточный матрикс, содержащий гиалуроновую кислоту, ФНО-стимулируемый ген 6 (TSG6) и сывороточный интер-а-ингибитор — вещества, необходимые для разрыва фолликула.
Экспрессия яйценосным холмиком белка Tsg6 и некоторых других белков, участвующих в его росте, регулируется простагландином Е2 (ПГЕ2) через рецептор ЕР2. В подтверждение важной роли ПГЕ2 в росте куму-люса и овуляции показано, что мыши с дефицитом ЕР2 или циклоксигеназы-2 (Сох-2), являющейся лимитирующим ферментом для ПГЕ2, оказались бесплодными из-за имеющихся нарушений овуляции.
Коннексин и щелевые контакты фолликула
Кумулюсные клетки осуществляют многие свои функции за счет межклеточных взаимодействий через щелевые контакты между собой и с оволеммой. Щелевые контакты — межклеточные каналы, формируемые белками из семейства коннексинов и предназначенные для диффузии Сахаров, аминокислот, предшественников липидов, нуклеотидов, метаболитов и сигнальных молекул. У всех представителей этого семейства имеются протеиновые домены: четыре трансмембрапных домена, две внеклеточных петли, цитоплазматическая петля и цитоплазматические N- и С-концевые последовательности.
У мышей имеется по меньшей мере 17 коннексинов, уникальная последовательность, длина цитоплазматических петель и С-терминальпых последовательностей которых, равно как и гетеро-/гомодимерное комбинирование, обеспечивают их функциональное разнообразие.
У мышей коннексины (Сх) 32, 37, 43, 45 и 57 экспрессируются кумулюсно-ооцитарным комплексом и обнаруживаются там между кумулюсными клетками, на чрезоболочечных выпячиваях кумулюсных клеток, обеспечивающих их связь с zp, на микроворсинках либо плазматической мембране ооцита.
Важнейшая роль щелевых контактов в оогенезе продемонстрирована на примере дефицита Сх37, приводящего у мышей к стерильности. Сх37 синтезируется как ооцитом, так и гранулезными клетками, но он, возможно, является единственным представителем семейства коннексинов в кумулюсно-ооцитарных щелевых контактах, который синтезируется ооцитом. В отсутствие Сх37 развитие фолликулов останавливается на переходе из преантральной в антральную стадию, в результате большинство фолликулов остается на первичной стадии и обнаруживают лишь несколько мелких антральных фолликулов. Более того, овуляция не происходит, несмотря на формирование многочисленных желтых тел.
Подобно этому, эксперименты in vitro показали, что Сх43, который также экспрессируется и гранулезными клетками, необходим для фолликулогенеза на стадиях вторичного фолликула и далее. Следует подчеркнуть, что ооциты мышей в экспериментальных моделях (дефицит Сх37 или Сх43) неспособны к мейозу, что может свидетельствовать о необходимости взаимодействия между кумулюсными клетками для достижения ооцитом мейотической компетентности.
Описанные коннексин-дефицитные экспериментальные модели демонстрируют важнейшую роль щелевых контактов в фолликулогенезе, но не объясняют значения клеток кумулюса в регуляции мейоза в ооците. Известны многочисленные модели и гипотезы, объясняющие, каким образом и в какой степени кумулюсные клетки обеспечивают повышение концентрации внутриклеточного цАМФ, необходимое для сохранения задержки мейоза даже после достижения ооцитом мейотической компетентности. И хотя полностью картина еще неясна, несколько ключевых факторов все же удалось выявить.
лучистый венец
Смотреть что такое «лучистый венец» в других словарях:
ЛУЧИСТЫЙ ВЕНЕЦ — Наружная оболочка яйца, состоящая из одного или нескольких слоев клеток колбообразной формы, которые погружены своими оттянутыми концами в прозрачную оболочку. К ним обычно прилипают клетки яйценосного бугорка фолликула; практически бывает трудно … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
лучистый венец — (corona radiata, PNA, BNA, JNA) совокупность проекционных нервных волокон в белом веществе полушарий большого мозга, расположенных веерообразно между корой полушария и внутренней капсулой … Большой медицинский словарь
Венец Лучистый (Corona Radiata) — 1. Совокупность радиальных волокон восходящих проводящих путей, расходящихся в различных направлениях к коре полушария большого мозга; являются частью внутренней капсулы мозга (ред.). 2. Слой фолликулярных клеток, который окружает только что… … Медицинские термины
ВЕНЕЦ ЛУЧИСТЫЙ — (corona radiata) 1. Совокупность радиальных волокон восходящих проводящих путей, расходящихся в различных направлениях к коре полушария большого мозга; являются частью внутренней капсулы мозга (ред.). 2. Слой фолликулярных клеток, который… … Толковый словарь по медицине
Зачатие у человека — Сперматозоид и яйцеклетка в момент оплодотворения. Зачатие (от рус. зачать, то есть начать) возникновение беременности. Согласно энциклопедическому словарю медицинских те … Википедия
Конечный мозг — (telencephalon), который также называется большим мозгом, состоит из двух полушарий и является наиболее крупным отделом головного мозга. Полушария соединяются друг с другом при помощи мозолистого тела (corpus callosum) (рис. 253, 256). Каждое… … Атлас анатомии человека
Бишофф Теодор Людвиг Фон — (1807 – 1882). Немецкий анатом, эмбриолог и физиолог. Основные работы посвящены эмбриологии животных и человека. Изучал ранние стадии развития зародыша. Описал процесс дробления яйцеклетки, определил бластулу как стадию эмбрионального развития.… … Общая эмбриология: Терминологический словарь
Лента Рейля — пучок нервной ткани в головном мозгу, ведущий многие чувствительные волокна через внутреннюю капсулу и лучистый венец в теменную долю мозговой коры, вмещающую психосенсорные и психомоторные центры для конечностей. См. Головной мозг … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Плацента — I Плацента (лат. placenta лепешка; синоним детское место) развивающийся в полости матки во время беременности орган, осуществляющий связь между организмом матери и плодом. В плаценте происходят сложные биологические процессы, обеспечивающие… … Медицинская энциклопедия
Лучистый венец головного мозга за что отвечает
В этой статье на сайте последовательно описаны следующие структуры: таламус, хвостатое и чечевицеобразное ядра, внутренняя капсула; гиппокамп и свод мозга; ассоциативные и комиссуральные волокна; III и боковые желудочки.
а) Таламус, хвостатое и чечевицеобразное ядра, внутренняя капсула. Между дорсальным и вентральным таламусом располагается III желудочек щелевидной формы. В большинстве случаев таламусы соприкасаются, образуя межталамическое сращение. На рисунке ниже показано последовательное расположение таламуса и соседних структур в срединно-боковой проекции. Головка и тело хвостатого ядра соприкасаются с верхней частью таламуса. Хвост хвостатого ядра проходит спереди и снизу от таламуса, не соприкасаясь с ним.
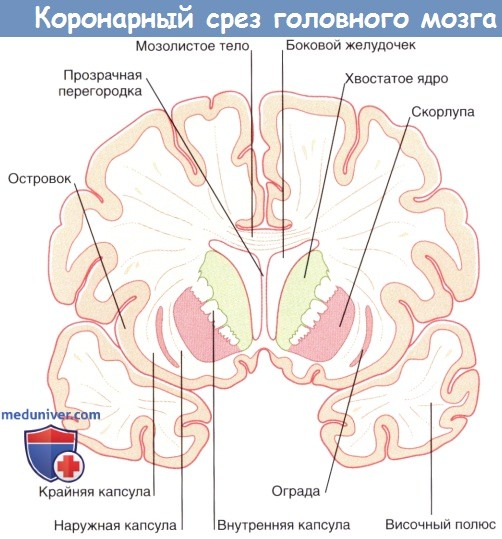
Двояковыпуклое чечевицеобразное ядро состоит из скорлупы и бледного шара. Скорлупа и хвостатое ядро схожи по структуре, и их концы сращены. Эти два образования соединены в задней части пучками серого вещества, располагающимися поперечно по отношению к внутренней капсуле. В связи с этим скорлупа и хвостатое ядро объединены под названием «полосатое тело».
Хвостатое и чечевицеобразное ядра входят в состав базальных ядер. Изначально термин «базальные ядра» применяли к шести скоплениям серого вещества в основании полушарий мозга. В настоящее время это понятие включает четыре ядра, участвующих в обеспечении двигательной иннервации: хвостатое и чечевицеобразное ядра, субталамические ядра промежуточного мозга и черную субстанцию среднего мозга.
На горизонтальном срезе внутренняя капсула имеет зигзагообразную форму. На горизонтальном срезе можно различить пять компонентов внутренней капсулы.
1. Передняя ножка внутренней капсулы, располагающаяся между чечевицеобразным ядром и головкой хвостатого ядра.
2. Колено внутренней капсулы.
3. Задняя ножка внутренней капсулы, располагающаяся между чечевицеобразным ядром и таламусом.
4. Позадичечевичная часть, располагающаяся сзади чечевицеобразного ядра и латерально по отношению к таламусу.
5. Подчечевичная часть (слуховая лучистость).
Через заднюю ножку внутренней капсулы проходит корково-спинномозговой проводящий путь, который также называют пирамидным трактом. Тракт представляет собой пучок волокон, выполняющих одну и ту же функцию. Корково-спинномозговой путь берет начало преимущественно из прецентральной извилины коры. Он спускается и, проходя через лучистый венец, внутреннюю капсулу и ножку среднего мозга (ножку мозга), идет к нижней части ствола мозга, а затем осуществляет перекрест и переходит на противоположную сторону спинного мозга.
Корково-спинномозговой путь — наиболее значимый проводящий путь ЦНС с клинической точки зрения по двум причинам. Во-первых, он обеспечивает все произвольные движения, и повреждения этого пути приводят к ослаблению (парезу) или параличу двигательной мускулатуры. Во-вторых, он удлиняет вертикальную протяженность ЦНС, делая ее уязвимой для заболеваний или травм полушарий и ствола мозга с одной стороны либо для заболеваний или травм спинного мозга с противоположной стороны.
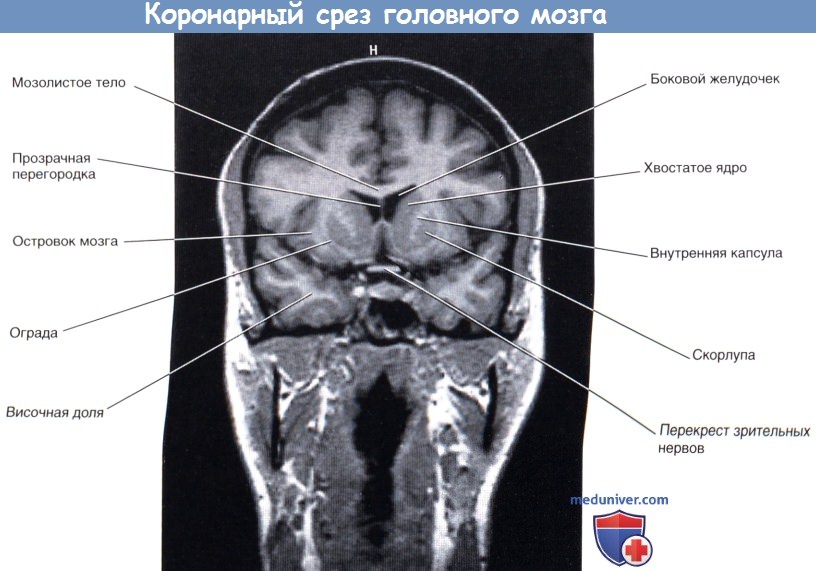
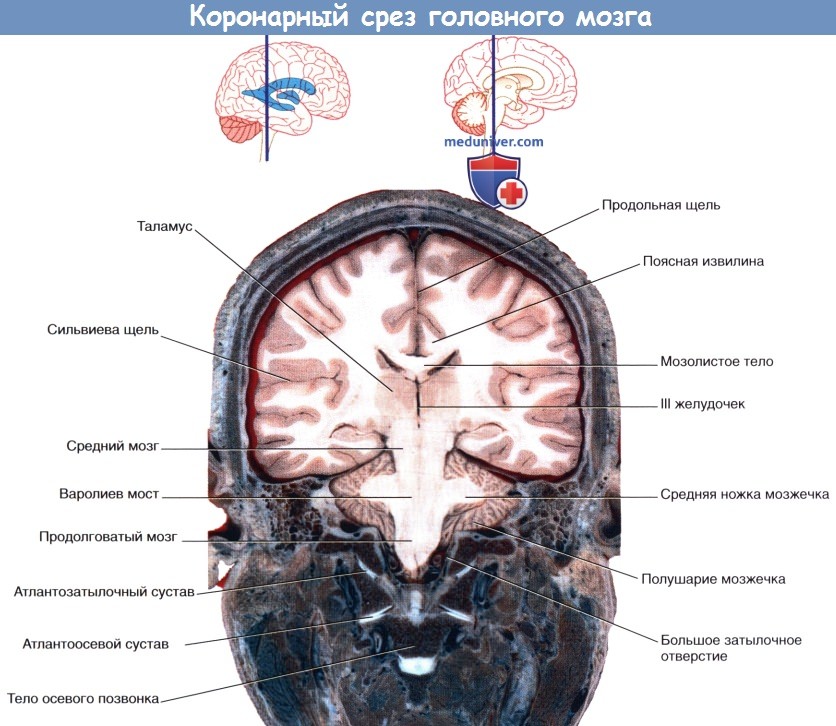
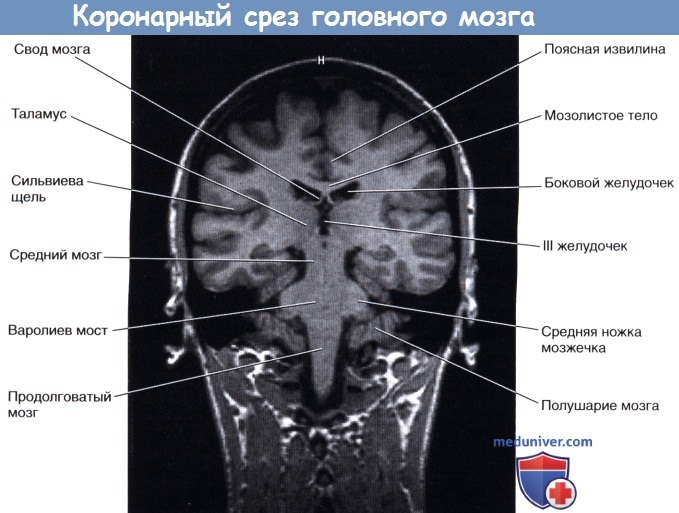
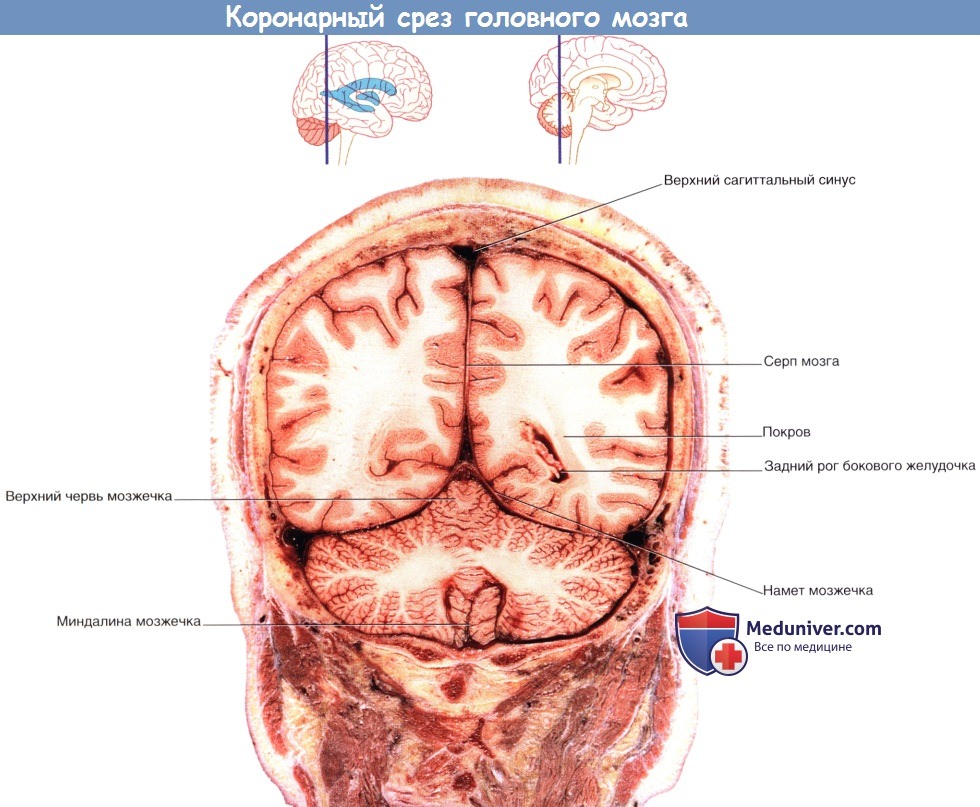
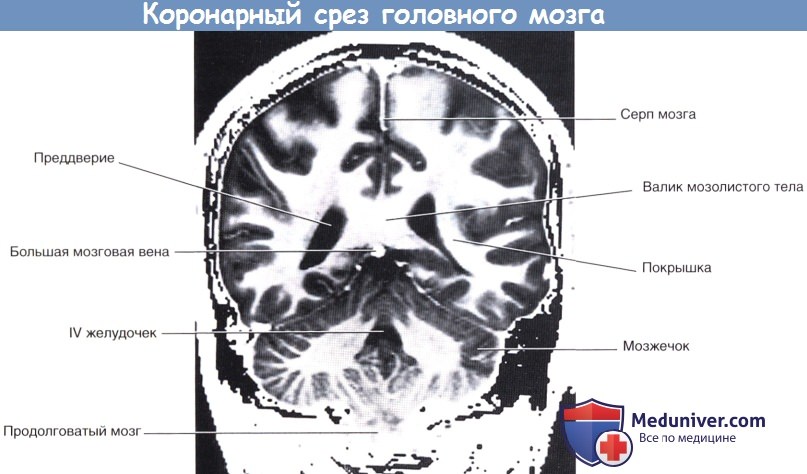
На рисунке ниже изображен коронарный срез передней ножки внутренней капсулы; на рисунке ниже представлена соответствующая МР-томограмма. На рисунке ниже изображен коронарный срез задней ножки внутренней капсулы препарата мозга; на рисунке ниже представлен соответствующая МР-томограмма.
Латеральнее чечевицеобразного ядра расположены наружная капсула, ограда и крайняя капсула.
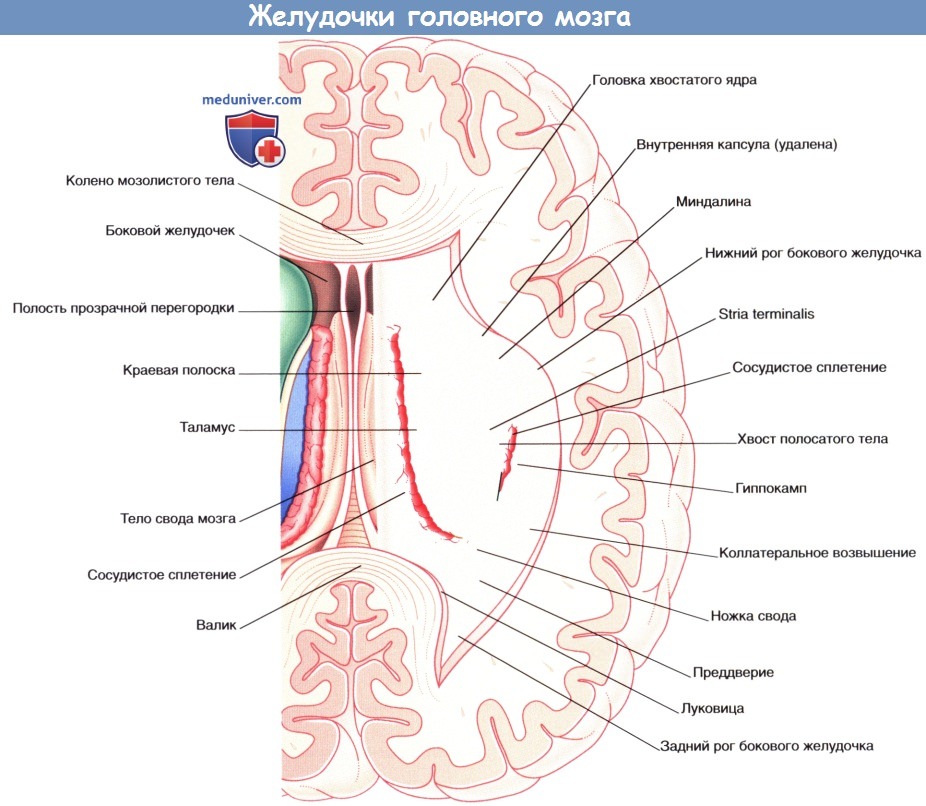
б) Гиппокамп и свод мозга. Во время эмбрионального развития гиппокамп, играющий важнейшую роль в формировании памяти, сначала можно увидеть сверху от мозолистого тела. У низших млекопитающих основная часть гиппокампа сохраняет свое расположение, тогда как у приматов он перемещается в височную долю по мере ее развития, оставляя за собой след, представленный нервными тяжами белого вещества,— свод мозга. Зрелый гиппокамп формирует дно нижнего (височного) рога бокового желудочка. Зрелый свод мозга состоит из тела свода, расположенного под мозолистым телом, ножек свода, начинающихся от гиппокампа, и двух колонн свода, идущих от свода к промежуточному мозгу. С ножкой и телом свода тесно связана сосудистая щель, через которую сосудистое сплетение заходит в боковой желудочек.
в) Ассоциативные и комиссуральные нервные волокна. Нервные волокна, идущие от коры головного мозга, разделяют на три группы.
1. Ассоциативные волокна, обеспечивающие связи внутри одного полушария.
2. Комиссуральные волокна, соединяющие соответствующие части двух полушарий.
3. Проекционные волокна, идущие к подкорковым ядрам полушарий, ствола мозга и спинного мозга.
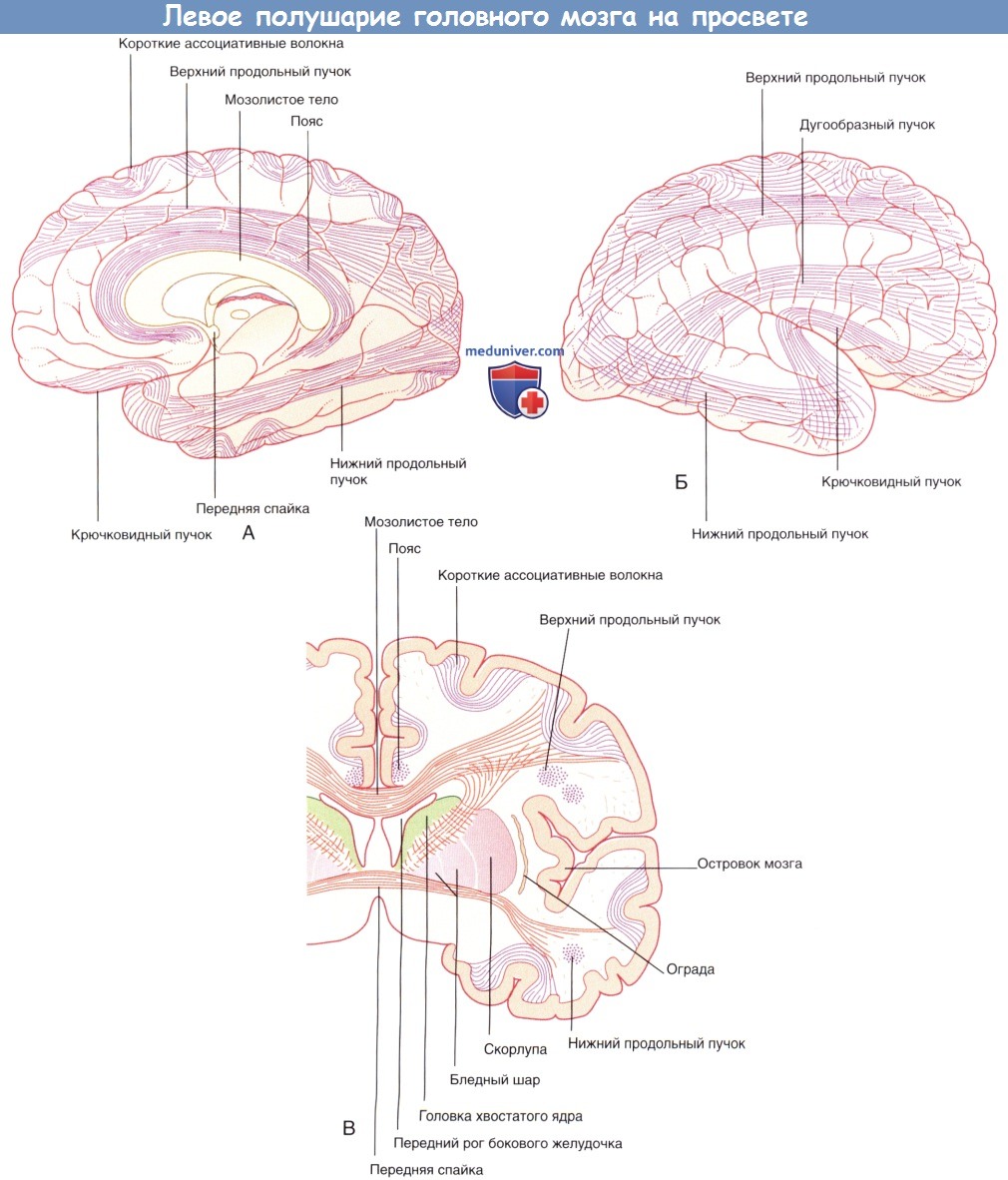
г) Ассоциативные нервные волокна. Извилины в пределах доли соединяются короткими ассоциативными волокнами.
Связи двух долей обеспечивают длинные ассоциативные волокна. К пучкам длинных ассоциативных волокон относят:
• верхний продольный пучок, соединяющий лобную и затылочную доли;
• нижний продольный пучок, соединяющий затылочную и височную доли;
• дугообразный пучок, соединяющий лобную долю и затылочно-височную кору;
• крючковидный пучок, соединяющий лобную и верхнюю височную долю;
• пояс, расположенный под корой поясной извилины.
1. Мозолистое тело. Мозолистое тело представляет собой самую крупную комиссуральную структуру, связывающую соответствующие участки правого и левого полушарий. Часть волокон идет из ствола мозолистого тела латерально и вверх, пересекая лучистый венец. Другая часть волокон проходит латерально и, изгибаясь, спускается вниз в виде тонкой пластинки волокон — покрова — к нижним участкам височной и затылочной долей. Парные волокна, идущие от валика мозолистого тела к медиальной стенке затылочной доли, образуют затылочные (большие) щипцы. Волокна, идущие от обеих сторон колена мозолистого тела к медиальной стенке лобной доли, называют лобными (малыми).
2. Малые комиссуральные структуры мозга. Передняя спайка связывает передние части височных долей с двумя обонятельными путями.
Задняя и поводковая комиссуры располагаются непосредственно перед эпифизом.
Спайка свода состоит из волокон, проходящих в ножках свода и соединяющих правый и левый гиппокампы.
е) Боковые и III желудочки. Боковой (латеральный) желудочек состоит из тела (центральной части), расположенного в пределах теменной доли, и переднего (лобного), заднего (затылочного) и нижнего (височного) рогов. Передняя граница центральной части желудочка представлена межжелудочковым отверстием, расположенным между таламусом и передним столбом свода мозга. Посредством этого отверстия происходит сообщение III и латерального желудочков. Связь центральной части желудочка с задним и нижним рогами осуществляется через преддверие бокового желудочка.
Ниже перечислены связи, в которых участвует боковой желудочек.
• Передний рог. Границы рога формируют головка хвостатого ядра, прозрачная перегородка и структуры мозолистого тела (ствол мозолистого тела образует верхнюю стенку, колено мозолистого тела— переднюю стенку, клюв — нижнюю стенку).
• Тело. Тело бокового желудочка располагается ниже ствола мозолистого тела и выше таламуса и передней части тела свода. Медиально расположена прозрачная перегородка, сужающаяся в месте соединения мозолистого тела и приподнятой части свода. Прозрачная перегородка представляет собой истонченные стенки полушарий мозга. Наличие центральной полости в прозрачной перегородке подтверждает тот факт, что она состоит из двух частей.
• Задний рог. Задний рог располагается ниже валика мозолистого тела и медиальнее покрова мозолистого тела. На медиальной поверхности большие затылочные щипцы образуют луковицу заднего рога.
• Нижний рог. Нижний рог расположен снизу от хвоста хвостатого ядра и в передней части, ниже миндалевидного тела («миндалины»), входящего в состав лимбической системы. Дно рога формируют гиппокамп и соседние структуры.
• На внешней поверхности располагается коллатеральное возвышение, представляющее собой вдавление коллатеральной борозды в нижний рог.
III желудочек — полость промежуточного мозга. Границы желудочка показаны на рисунке ниже. Верхняя стенка желудочка представлена сосудистой оболочкой, от которой отходит сосудистое сплетение. Сосудистая оболочка III желудочка сформирована двойным слоем мягкой мозговой оболочки, сращенным с эпендимным эпителием желудочка. Сверху III желудочек граничит со сводом мозга и мозолистым телом. Боковые границы желудочка образованы таламусом и гипоталамусом. Передняя стенка желудочка представлена передней спайкой, терминальной пластинкой и перекрестом зрительных нервов. В нижней стенке различают воронку гипоталамуса, серый бугор, сосцевидные тела и верхний край среднего мозга. Заднюю стенку образуют эпифиз и прилежащие спайки.
Часто у людей старше 20 лет происходит кальцификация эпифиза и, в некоторых случаях, поводковой комиссуры, в связи с чем эти структуры становятся заметны даже на обзорной рентгенограмме черепа. Иногда происходит смещение эпифиза в полости черепа опухолью, гематомой или другим объемным новообразованием.
Примечание: миндалевидное тело, краевая полоска и хвост хвостатого тела образуют крышу нижнего рога, а гиппокамп образует его дно (сосудистое сплетение удалено для обеспечения обзора). 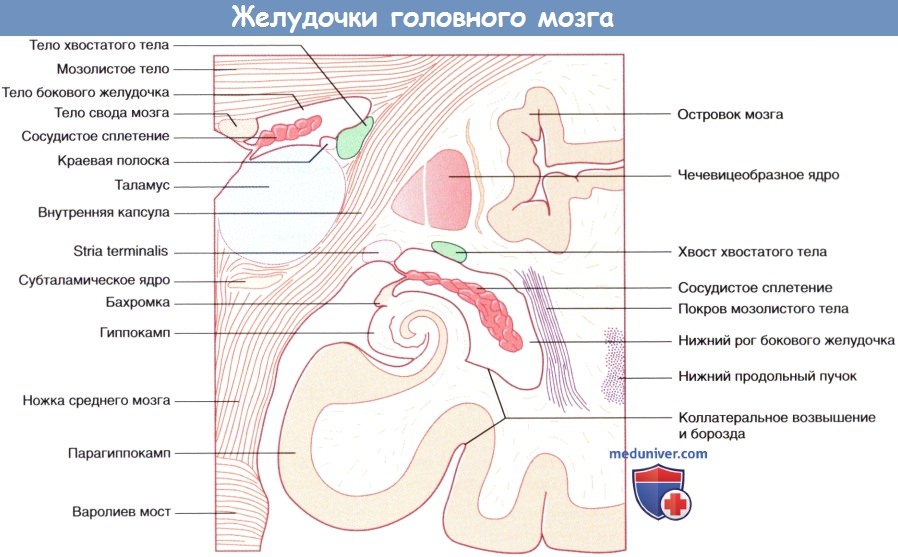
(В) Коронарный срез, демонстрирующий расположение коротких и длинных ассоциативных волокон. 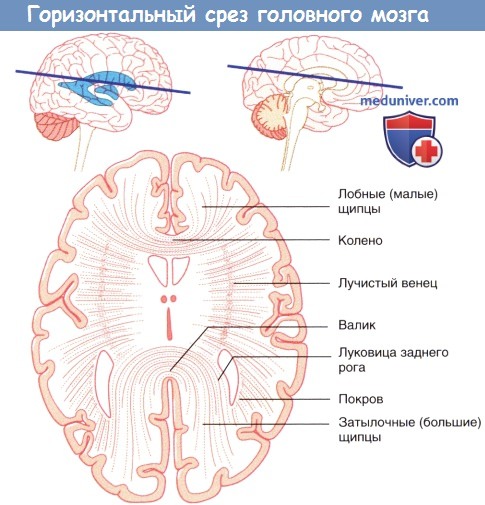
Волокна, идущие из ствола мозга латерально, пересекают лучистый венец. 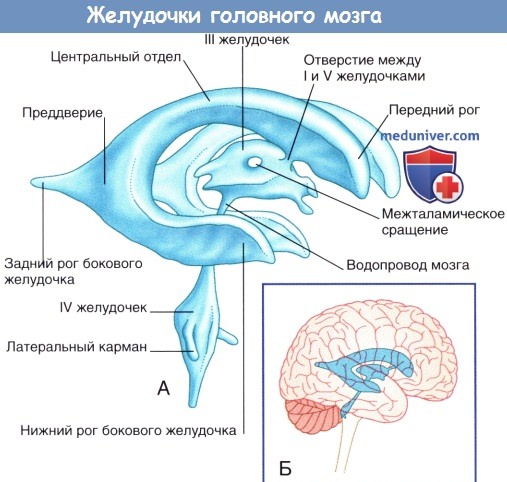
Редактор: Искандер Милевски. Дата публикации: 9.11.2018
Пересадка аутологичных гемопоэтических клеток костного мозга при тяжёлом течении рассеянного склероза
В последние 10-20 лет с появлением иммуномодулирующих препаратов в большинстве случаев удаётся значительно снизить частоту обострений рассеянного склероза (РС), что приводит к замедлению нарастания инвалидизации. Однако в ряде случаев как иммуномодулирующие, так и иммуносупрессивные препараты оказываются неэффективными. Приведены литературные данные по применению трансплантации аутологичных гемопоэтических стволовых клеток при РС и клинический случай успешного использования этого метода у пациента с тяжёлым течением РС, не отвечающего на применение иммуномодуляторов и введение митоксантрона. Ключевые слова: рассеянный склероз, иммуномодуляторы, митоскантрон, трансплантация, аутологичные гемопоэтичные клетки
Т. Е. Шмидт (1), Н. И. Базий (2), Н. Н. Яхно (1), К. Ю. Казанцев (1), П. А. Коваленко (3), С. В. Шаманский (3), А. Ю. Емельянова (1)
1- Кафедра нервных болезней Первого МГМУ им. И. М, Сеченова, 2- Клиническая б-ца №1 УДП РФ, 3 – ГВКГ им. Н. Н. Бурденко
В последние 10-20 лет с появлением иммуномодулирующих препаратов в большинстве случаев удаётся значительно снизить частоту обострений рассеянного склероза (РС), что приводит к замедлению нарастания инвалидизации. Однако в ряде случаев как иммуномодулирующие, так и иммуносупрессивные препараты оказываются неэффективными. Приведены литературные данные по применению трансплантации аутологичных гемопоэтических стволовых клеток при РС и клинический случай успешного использования этого метода у пациента с тяжёлым течением РС, не отвечающего на применение иммуномодуляторов и введение митоксантрона.
Ключевые слова: рассеянный склероз, иммуномодуляторы, митоскантрон, трансплантация, аутологичные гемопоэтичные клетки
Начиная с 90-х годов прошлого столетия, с введением в повседневную врачебную практику иммуномодулирующих препаратов, в большом числе случаев ремиттирующего рассеянного склероза (РРС) удаётся достичь значительного снижения частоты обострений. Это, в свою очередь, приводит к замедлению нарастания необратимого неврологического дефицита и инвалидизации пациентов. К сожалению, на сегодняшний день предсказать эффективность применения того или иного иммуномодулятора у конкретного больного невозможно. При РРС с частыми и тяжёлыми обострениями, в случае безуспешности лечения иммуномодулирующими препаратами, а также при вторичном прогрессировании заболевания применяют иммуносупрессоры и цитостатики. Одним из методов лечения РС является и пересадка аутологичных гемопоэтических клеток костного мозга. Экспериментальные данные на животных с индуцированным аутоиммунным энцефаломиелитом в качестве модели рассеянного склероза, продемонстрировали, что глубокая и длительная иммуносупрессия (высокие дозы цитостатиков, тотальное облучение лимфоцитов) с последующей трансплантацией стволовых кроветворных клеток может остановить прогрессирование заболевания. Клиническое применение метода трансплантации стволовых кроветворных клеток при РС началось в 1995 году одновременно в США и Европе. В России первая операция трансплантации стволовых кроветворных клеток периферической крови при PC по протоколу Европейской группы трансплантации костного мозга была проведена на кафедре гематологии и клинической иммунологии, совместно с кафедрой нервных болезней Военно-Медицинской Академии под руководством проф. А. А. Новика в 1999 году. В настоящее время в России действует несколько крупных медицинских исследовательских центров, занимающихся трансплантацией стволовых клеток крови при РС. Среди них: ГВКГ им. Бурденко, Москва; ВМА, Санкт-Петербург; НМХЦ им. Пирогова, Москва; ГМУ им. акад. И. П. Павлова, Санкт-Петербург; Калининский региональный центр, Самара; Институт клинической иммунологии, Новосибирск; Свердловский областной гематологический центр, Екатеринбург.
Пересадка стволовых клеток состоит из нескольких этапов. 1 – мобилизация и забор гемопоэтических стволовых клеток костного мозга пациента. На этом этапе проводится введение больших доз циклофосфамида (4 г/м2) с целью усиления выхода гемопоэтических стволовых клеток (ГСК) (CD34+-клеток) из костного мозга в периферическую кровь. Другим обязательным компонентом данного этапа является использование гранулоцитарного-колониестимулирующего фактора (Г-КСФ) для стимуляции гранулоцитопоэза и увеличения количества ГСК в периферической крови. Затем с помощью лейкоцитафереза выделяют мононуклеарную фракцию крови, обогащенную CD34+-клетками. 2 этап – криоконсервация (добавление к лейкоконцентрату криопротекторов, которые необходимы для защиты клеток от разрушения при замораживании) и хранение полученного трансплантата. Замораживание клеток требует специального оборудования для программированного понижения температуры. Затем замороженный трансплантат переносится в пары жидкого азота, где и хранится до момента использования. 3 этап – кондиционирование, то есть собственно высокодозная иммуносупрессия, которая преследует цель уничтожить существующие иммунокомпетентные клетки пациента и подготовить костно-мозговой плацдарм для последующего приживления трансплантата. Кондиционирование представляет собой комбинацию цитостатических препаратов, которые вводятся пациенту в достаточно большой дозе. В Европейских протоколах для кондиционирования принята программа ВЕАМ: кармустин (БикНу, BCNU), этопозид, арабинозида цитозин (цитарабин, цитозар), мелфалан (алкеран). Инфузия размороженного трансплантата осуществляется через 48 часов после введения последней дозы цитостатика для того, чтобы не повредить трансплантат. На второй и третий день после инфузии трансплантата вводится антитимоцитарный глобуллин (АТГ) для уничтожения остающихся лимфоцитов пациента и тех лимфоцитов, которые контаминируют инфузируемый трансплантат.
Приводим клинический случай успешного применения этого метода у пациента с тяжёлым течением РС, не отвечающим на иммуномодулирующую и иммунносупрессивную терапию.
Пациент З., 18 лет, поступил в клинику нервных болезней им. А. Я. Кожевникова Первого МГМУ им. И. М. Сеченова в августе 2010 года с жалобами: на выраженное пошатывание при ходьбе, дрожание в руках, слабость в руках и ногах, изменение речи, неудержание мочи.
Перенесенные заболевания: детские инфекции, ОРВИ, удаление кисты копчика. Отрубевидный лишай, пролапс митрального клапана.
Вредные привычки отрицает. Наследственный анамнез: по заболеваниям нервной системы не отягощен.
Результаты лабораторных и инструментальных методов исследования.
Общий анализ крови, биохимический анализ крови, ревмопробы, анализ мочи – без отклонений от нормы.
Вызванные потенциалы: грубое многоочаговое поражение ЦНС: ствола головного мозга, обоих зрительных путей, быстропроводящих волокон с рук на стволовом и верхнешейном уровне, быстропроводящих волокон с ног.
Нейроофтальмологическое обследование: острота зрения: V OD=0, 7 c cyl+1, 0D=0, 9-1, 0 V OS=0, 7 c cyl+1, 0D=0, 9-1, 0; на глазном дне: OU – побледнение височных половин дисков зрительных нервов, частичная атрофия дисков зрительных нервов.
МРТ головного мозга: атрофия белого вещества. Расширение боковых желудочков и арахноидальных пространств. Резко истончено мозолистое тело. Множественные гиперинтенсивные в Т2 ВИ очаговые изменения белого вещества гемисфер большого мозга, при относительной сохранности гемисфер мозжечка. Очаговые изменения мозолистого тела, ствола. По сравнению с данными от предыдущего исследования от сентября 2009 года имеется отрицательная динамика: увеличение числа очагов, атрофия белого вещества.
За время нахождения в клинике, 12-го и 13-го сентября, у пациента отмечались единичные генерализованные судорожные припадки. В связи с появлением эпилептических приступов пациенту была проведена ЭЭГ: помимо диффузных изменений электрической активности, очаговой эпилептической активности не выявлено. Был назначен финлепсин в дозе 200 мг/сут, после чего приступы больше не возникали.
В течение 5 дней (с 24-го сентября) проводилась пульс-терапия метипредом в дозе 1000 мг/сут с последующим кратковременным курсом перорального приема преднизолона в дозе 80-60-40-20 мг в течение 8 дней. Во время курса гормональной терапии отмечалась кратковременная положительная динамика в виде некоторого уменьшения выраженности атаксии и нарастания силы в руках и ногах. Однако после отмены преднизолона мозжечковая симптоматика и слабость в конечностях вновь наросли.
Учитывая отсутствие значимого эффекта от гормональной терапии было принято решение о проведении лечения Митоксантроном 20 мг в/в 1 раз в 3 месяца. Первое введение было проведено в клинике. Побочных реакций не отмечалось. Неврологический статус при выписке из клиники без динамики – EDSS 6. 5 баллов.
Однако в дальнейшем состояние пациента продолжало ухудшаться – к декабрю 2010 года наросла слабость в конечностях, стала невозможной ходьба даже с поддержкой.
Принимая во внимание неэффективность иммуномодулирующей терапии и продолжающееся нарастание инвалидизации на фоне иммуносупрессивной терапии пациенту, была дана рекомендация обращения в госпиталь им. Н. Н. Бурденко для решения вопроса о целесообразности проведения аутологичной трансплантации гемопоэтических клеток.
При поступлении в Главный военный клинический госпиталь им. Н. Н. Бурденко в конце декабря 2010 года пациент самостоятельно не передвигался и мог обслуживать себя только в пределах кровати из-за выраженного спастического тетрапареза и атаксии, с трудом самостоятельно принимал пищу. Вследствие грубого маятникообразного нистагма не мог читать, работать с компьютером. Балл EDSS в то время составлял – 8, 5 баллов. Учитывая быстрое нарастание инвалидизации пациента до тяжёлой степени и неэффективность проводимой ранее терапии, было принято решение о проведении пересадки аутологичных гемопоэтических клеток костного мозга.
В феврале 2012 года амбулаторно осмотрен в клинике нервных болезней: сила в конечностях – 4, 5 балла, высокие сухожильные рефлексы, 2-сторонний симптом Бабинского. Ведущей была мозжечковая симптоматика: атаксия при ходьбе (ходит с палочкой), горизонтальный нистагм, интенция при выполнении координаторных проб, скандированная речь. Тазовых нарушений нет. EDSS 5, 5
В дальнейшем пациент регулярно – 2 раза в год осматривался неврологом и ежегодно выполнял МРТ головного мозга с внутривенным контрастированием. При МРТ: перивентрикулярно, в зоне лучистых венцов и семиовальных центров определяются множественные очаги повышенного сигнала в Т2 режиме, размерами от 2 мм до 10 мм без признаков перифокального отёка и объёмного воздействия. После внутривенного введения контрастного вещества его накопления в выявленных очагах не отмечается. Субарахноидальное пространство больших полушарий и мозжечка умеренно расширено. Отрицательной динамики относительно предыдущих исследований от 2011 г., 2012, 2014, 2015, 2018 нет.
Таким образом, через 7 лет после проведения аутологичной трансплантации гемопоэтических стволовых клеток у пациента сохраняется достигнутое улучшение состояния, что подтверждается и стабильной нейровизуализационной картиной.
Обсуждение
У представленного пациента заболевание началось в 11-летнем возрасте с появления глазодвигательных нарушений, что является относительным плохим прогностическим признаком. Действительно, несмотря на то, что диагноз РС был поставлен практически сразу же после появления неврологической симптоматики, и была начата иммуномодулирующая терапия интерферонами бета, у пациента отмечались частые обострения, требовавшие применения кортикостероидов, которые не давали заметного эффекта.. Нельзя исключить вероятность того, что в данном случае демиелинизация была представлена 3 или 4 типом.
Пересадка аутологичных гемопоэтичных стволовых клеток костного мозга также рассматривается как один из методов лечения РС, особенно при его агрессивном течении.
Теоретически полное уничтожение аутоагрессивных Т- и В-клеток и замена их новыми приведёт к созданию «новой» иммунной системы гемопоэтичными клетками и может вызвать длительную или даже постоянную ремиссию.
В 2000 году Европейской ассоциацией по трансплантации костного мозга (ЕВМТ) были разработаны показания к трансплантации гемопоэтических стволовых клеток для пациентов с РС. Она может применяться у пациентов в возрасте от 18- 55 лет, при любой форме течения РС, с длительностью достоверного диагноза не менее 1 года и инвалидизацией по шкале EDSS 3. 0- 6. 5 баллов. При этом необходимыми условиями являются: : 1- нарастание инвалидизации по меньшей мере в течение 6 месяцев более чем на 1, 5 балла по ЕDSS ( если до этого было 3. 0-5. 0 баллов) или более чем на 1 балл по EDSS (если до этого было более 5, 5 баллов) ; 2- подтвержденная клиническая активность по данным МРТ за предыдущий год; 3-неэффективность предшествующей иммуномодулирующей терапии; 4-подписание пациентом информированного согласия. В нашем случае степень инвалидизации на момент решения о проведении этой процедуры превышала рекомендуемую и оценивалась в 8, 5 баллов по шкале EDSS. Однако, учитывая быстрое нарастание неврологической симптоматики – за 3 месяца балл инвалидизации возрос с 6, 0 до 8, 5 – было решено провести трансплантацию как «операцию спасения».
Противопоказаниями к проведению трансплантации стволовых клеток при РС являются: беременность, тяжелые сопутствующие заболевания, частые инфекции, тотальное облучение лимфатических узлов или общее облучение организма в анамнезе, лечение иммуносупрессорами за 3 месяца до трансплантации, применение копаксона, интерферонов бета, внутривенного иммуноглобулина за 1 месяц до трансплантации, обострение РС за 1 месяц до начала процедуры трансплантации.
Побочные эффекты трансплантации гемопоэтических стволовых клеток главным образом связаны с проводимой иммуносупрессивной терапией. Их частота зависит от конкретного режима иммуносупрессии и значительно выше при режимах кондиционирования высокой интенсивности. Наиболее серьезным побочным эффектом является возникновение оппортунистических инфекций в связи с полным или частичным подавлением иммунной системы пациента. К наиболее часто встречающимся оппортунистическим инфекциям относятся пневмококковая и гемофильная пневмония, энтерит, ассоциированный с Clostridium difficile, реже инфицирование вирусами Varicella-zoster и вирусом гепатита, сепсис. При использовании тотального облучения организма в качестве режима иммуносупрессии часто возникают миелодиспластические синдромы, лимфопролиферативные заболевания, другие онкологические процессы, выше риск развития оппортунистических инфекций. Наиболее частыми побочными эффектами, возникающими на разных этапах процедуры трансплантации, являются транзиторная лихорадка, аллопеция, транзиторное нарастание неврологического дефицита.
К 2019 году в мире было проведено более 5000 подобных процедур больным с РС. Анализ этих случаев показал, что через 3 года у 63% из них отмечается стабилизация или улучшение состояния. Приобретение достаточного опыта в проведении клеточной трансплантации привело к значительному снижению частоты смертельных исходов, связанных с высокодозной химиотерапией: если в 2004 году летальность при выполнении этой процедуры составляла 6-8%, то в настоящее она не превышает 0, 4%. В значительной степени этот риск зависит от источника стволовых клеток (пересадка аллогенных стволовых клеток от донора с аналогичным HLA- антигеном сопровождается 20-30% летальностью), режима химиотерапии, возраста пациента и наличия сопутствующих заболеваний.
Как уже отмечалось, теоретической предпосылкой проведения пересадки стволовых клеток является полное удаление из организма больного аутоагрессивных Т-лимфоцитов, инициирующих воспалительные изменения в ЦНС, и замена их на «здоровые» клетки. Исходя из этого, лучшие результаты могут быть достигнуты на ранних этапах РС, когда воспалительные изменения в значительной степени преобладают над нейродегенеративными, и аксоны ещё не подверглись необратимым изменениям. Клинические данные противоречивы. Имеется описание более 500 больных РС, подвергшихся пересадке стволовых клеток. 3х-летнее наблюдение за частью из них показало, что при проведении подобной процедуры больным с лёгкой и средней степенью инвалидизации (до 6 баллов по шкале EDSS) дальнейшего прогрессирования заболевания не происходит, тогда как у пациентов с тяжёлой инвалидизацией отмечалось ухудшение состояния. Однако, в другом исследовании показано, что у 74% больных с первично-прогрессирующим РС, при котором преобладают процессы нейродегенерации, не было прогрессирования заболевания в течение последующих 3 лет наблюдения. Авторы полагают, что кандидатами для пересадки стволовых клеток могут быть больные РС с быстрым прогрессированием (не менее 1 балла в год) и сохраняющие способность ходить хотя бы несколько метров с помощью.
Помимо этого, технические трудности, узкие рамки критериев отбора для подобной процедуры, токсичность иммуносупрессии являются причиной того, что в настоящее время большинство специалистов склонны рассматривать пересадку стволовых клеток как «операцию отчаяния», к которой следует прибегать лишь при неэффективности других методов терапии. Наблюдение за представленным пациентом показало, что даже в случае значительной инвалидизации, в отсутствие явных признаков активности воспалительного процесса применение этой процедуры позволяет достичь значительного улучшения состояния. Как долго будет сохраняться полученный положительный эффект покажет планируемое динамическое наблюдение за больным.
La Nassa G., Littera R., Cocco E. Et al. Allogenic hematopoietic stem cell transplantation in patients affected by large granular lymphocyte leukemia and multiple sclerosis/ Ann. Hematol., 2004, v.83, p. 403-405
Saccardi R., Mancardi G., Solari A. Et al. Autologous HSCT for severe progressive multiple sclerosis in a multicenter trial: impact on disease activity and quality of life/ Blood, 2005, v.105, p. 2601-2607
