лимфоцитарная пневмония что это такое
Интерстициальная пневмония
Интерстициальная пневмония объединяет группу патологий, сопровождающихся течением воспалительного процесса в соединительной ткани паренхимы легких и в стенках альвеол с последующим развитием фиброза. Отсутствие терапии из-за несвоевременного выявления этой проблемы становится причиной инвалидности. Поставить правильный диагноз может только опытный специалист на основании результатов точной аппаратной диагностики.
Что такое интерстициальная пневмония
Интерстициальная (идиопатическая интерстициальная) пневмония – это хроническое или первичное острое воспаление межуточной легочной ткани, приводящее к фибропролиферативным изменениям и снижению дыхательных функций. Среди многочисленных пульмонологических заболеваний интерстициальная пневмония занимает особое место из-за продолжительного и тяжелого течения, а также частых неблагоприятных исходах, обусловленных прогрессирующими склеротическими и фиброзными изменениями в легких. Почти в каждом случае интерстициальная пневмония приводит к снижению качества жизни с последующей инвалидизацией.
Выделяют 8 подтипов интерстициальной пневмонии, разделенных на 4 группы:
— неспецифическая интерстициальная пневмония;
— идиопатический лёгочный фиброз;
- — десквамативная интерстициальная пневмония;
- — респираторный бронхиолит;
Чаще всего фиксируются следующие виды заболевания:
Причины возникновения
На данный момент этиология интерстициальной пневмонии еще не изучена. По мнению специалистов, развитие патологии провоцирует проникновение в легкие различных инфекций: вирусов, бактерий. Максимальную подверженность этому заболеванию обуславливают:
Также развитие пневмонии провоцируют некоторые виды пыли.
Симптомы и признаки
Патология сопровождается следующими симптомами:
У большей части пациентов в начале заболевания отмечается гриппоподобный синдром.
Методы диагностики
Постановка точного диагноза невозможна без тщательного обследования, включающего такие процедуры, как:
С этой целью лучше всего записаться в современный диагностический центр, располагающий новейшим оборудованием (МРТ, УЗИ, КТ легких) и штатом опытных специалистов. После исследования пациент может сразу же попасть на прием к эксперту в области лечения данного заболевания, который разработает эффективные методы.
Какой врач лечит
Лечением интерстициальной пневмонии занимается врач-пульмонолог. Также пациент может быть направлен к кардиологу, так как одновременно с легкими страдает и сердце.
Методы лечения
Для лечения интерстициальной пневмонии применяют два вида терапии: медикаментозную и немедикаментозную. В первом случае больному назначают глюкокортикоиды и цитостатические препараты, во втором – вентиляцию легких или кислородотерапию.
Результаты
Своевременная постановка диагноза и эффективный комплекс лечения позволяют значительно улучшить состояние пациента и даже добиться полного выздоровления. В запущенных формах избежать летального исхода поможет только пересадка легких.
Реабилитация и восстановление образа жизни
Реабилитация предполагает следующее:
Образ жизни при интерстициальной пневмонии
Во избежание обострений заболевания, пациентам показаны:
Своевременное лечение и грамотная реабилитация позволяет предотвратить развитие осложнений, и ускорят наступление полного выздоровления.
Интерстициальная пневмония с аутоиммунными признаками (ИПАП): мультидисциплинарный диагноз в пульмонологии и ревматологии
Диагноз идиопатической интерстициальной пневмонии с аутоиммунными признаками (ИПАП) объединяет пациентов с идиопатической интерстициальной пневмонией и рядом клинических, серологических и/или морфологических проявлений, указывающих на наличие системного аутоиммунного процесса, который, однако, не соответствует современным критериям определенного системного заболевания соединительной ткани. Результаты клинических исследований указывают на значительную неоднородность больных данной группы. В обзоре литературы обсуждаются классификационные критерии ИПАП, а также дальнейшие перспективы их применения для улучшения диагностики и лечения пациентов с данной патологией.
Идиопатические интерстициальные пневмонии (ИИП) представляют собой группу диффузных воспалительных и/или фибротических заболеваний легких, объединенных на основании сходных клинических, рентгенологических и гистологических признаков. Диагноз ИИП требует исключения известных причин интерстициальной пневмонии, таких как воздействие экзогенных факторов, токсические эффекты лекарственных препаратов или системное заболевание соединительной ткани (СЗСТ) [1]. Последние представляют собой группу аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, идиопатические воспалительные миопатии, синдром Шегрена, системная склеродермия и смешанное заболевание соединительной ткани. Интерстициальная пневмония (ИП) может быть одним из проявлений СЗСТ, причем в части случаев ее развитие предшествует появлению других симптомов заболевания 3.
У пациентов с ИИП могут наблюдаться отдельные клинические симптомы или серологические маркеры, характерные для аутоиммунной патологии, но не позволяющие установить диагноз какого-либо СЗСТ в связи с отсутствием всех необходимых критериев 8. Ранее исследователи предлагали различные критерии и термины для описания вышеуказанной когорты пациентов 7, в связи с чем длительное время отсутствовала возможность проведения мас штабных исследований, посвященных диагностике и лечению данной патологии.
В 2015 году экспертами Европейского респираторного общества (ERS) и Американского торакального общества (ATS) был предложен термин «интерстициальная пневмонии с аутоиммунными признаками (ИПАП)» [10]. Этим термином обозначают ИИП, сопровождающуюся клиническими, серологическими и/или морфологическими признаками, которые указывают на наличие системного аутоиммунного процесса, но не соответствуют современным критериям конкретного СЗСТ. Следует отметить, что это понятие было введено группой пульмонологов и ревматологов, в первую очередь, для удобства диагностики и унификации критериев включения пациентов в клинические исследовании, однако оно не может служить основанием для выбора метода лечения.
Критерии ИПАП
Классификационные критерии ИПАП распределены на три группы, или домена – клинический, серологический и морфологический (табл. 1) [10]. Для установления диагноза ИПАП 2 необходимы наличие ИП по данным компьютерной томографии органов грудной клетки высокого разрешения (КТВР) и/или хирургической биопсии легкого и тщательное клиническое обследование для исключения известных причин ИП, в том числе СЗСТ. Кроме того, диагноз ИПАП предполагает наличие соответствующих классификационных критериев, относящихся по крайней мере к двум из указанных групп.
| 1. | Наличие интерстициальной пневмонии (по данным КТВР или хирургической биопсии легкого) + |
| 2. | Исключение альтернативных причин ИП + |
| 3. | Несоответствие критериям конкретного СЗСТ + |
| 4. | Наличие по крайней мере одного критерия из 2 или более групп: А) Клинической Б) Серологической В) Морфологической |
| А. | Клиническая группа: |
| 1) | Трещины на коже дистальных фаланг пальцев («рука механика») |
| 2) | Кожные язвы дистальных фаланг пальцев |
| 3) | Артриты или скованность в утренние часы ≥60 мин с поражением нескольких суставов |
| 4) | Телеангиэктазии на коже ладоней |
| 5) | Феномен Рейно |
| 6) | Беспричинный отек пальцев |
| 7) | Беспричинная стойкая сыпь на коже разгибательной поверхности пальцев (симптом Готтрона) |
| Б. | Серологическая группа: |
| 1. | Антинуклеарные антитела (АНА) в титре ⩾1:320 при наличии диффузного, гранулярного или гомогенного паттерна свечения или a) АНА при наличии нуклеолярного паттерна (в любом титре) или б) АНА при наличии центромерного паттерна (в любом титре) |
| 2. | Ревматоидный фактор в титре ⩾2N |
| 3. | Антитела к циклическому цитруллинированному пептиду (АЦЦП) |
| 4. | Антитела к двуспиральной ДНК (анти-дсДНК) |
| 5. | Анти-Ro (SS-A) |
| 6. | Анти-La (SS-B) |
| 7. | Антитела к рибонуклеопротеину |
| 8. | Анти-Smith |
| 9. | Антитела к топоизомеразе (Scl-70) |
| 10. | Антитела к тРНК-синтетазе (Jo-1, PL-7, PL-12 и другие, в том числе EJ, OJ, KS, Zo, tRS) |
| 11. | Анти-PM-Scl |
| 12. | Анти-MDA-5 |
| С. | Морфологическая группа: |
| 1. | Предполагаемый паттерн по данным КТВР: a) Неспецифическая интерстициальная пневмония (НСИП) б) Организующая пневмония (ОП) в) Перекрест НСИП и ОП г) Лимфоцитарная интерстициальная пневмония (ЛИП) |
| 2. | Гистологический паттерн по данным биопсии легкого: a) НСИП б) ОП в) Перекрест НСИП и ОП г) ЛИП д) Интерстициальные лимфоидные узелки с герминативными центрами |
| 3. | Внепаренхиматозные легочные и внелегочные проявления (в сочетании с интерстициальной пневмонией) a) Необъяснимый плевральный выпот или утолщение плевры б) Необъяснимый перикардиальный выпот или утолщение перикарда в) Необъяснимое заболевание дыхательных путей (по данным легочных функциональных тестов визуализационных методов или биопсии) г) Необъяснимая легочная васкулопатия |
В клиническую группу критериев включены симптомы, относительно специфичные для ряда СЗСТ, такие как феномен Рейно, телеангиэктазии кожи ладоней, язвы дистальных фаланг пальцев 11. Тем не менее, сами по себе они не позволяют установить диагноз СЗСТ. В то же время алопеция, фотодерматит, язвы слизистой оболочки полости рта, снижение массы тела, сухой синдром, изолированные миалгия и артралгия не были включены в перечень признаков ИПАП в связи с низкой специфичностью.
Морфологическая группа критериев ИПАП включает в себя такие рентгенологические паттерны ИП, как неспецифическая интерстициальная пневмония (НСИП), организующая пневмония (ОП), перекрест НСИП и ОП, лимфоцитарная пневмония (ЛИП). Данные варианты легочного поражения достаточно часто встречаются при ИП, ассоциированных с СЗСТ (СЗСТ-ИП) 15. Обычная интерстициальная пневмония (ОИП) (рис. 2) также может быть выявлены у пациентов с СЗСТ, хотя и встречается реже [17], поэтому она не является критерием исключения ИПАП. Тем не менее, в отличие от НСИП, ОП и ЛИП, картина ОИП не входит в перечень морфологических признаков ИПАП.
Результаты клинических исследований
С момента введения критериев ИПАП в 2015 г. были опубликованы результаты ряда клинических исследований, в основном ретроспективных, в которых изучались проявления, течение и исходы этого заболевания. Хотя основной целью разработки классификационных критериев ИПАП было выделение относительно однородной группы пациентов, тем не менее, в проведенных исследованиях выборки характеризовались значительной вариабельностью [18].
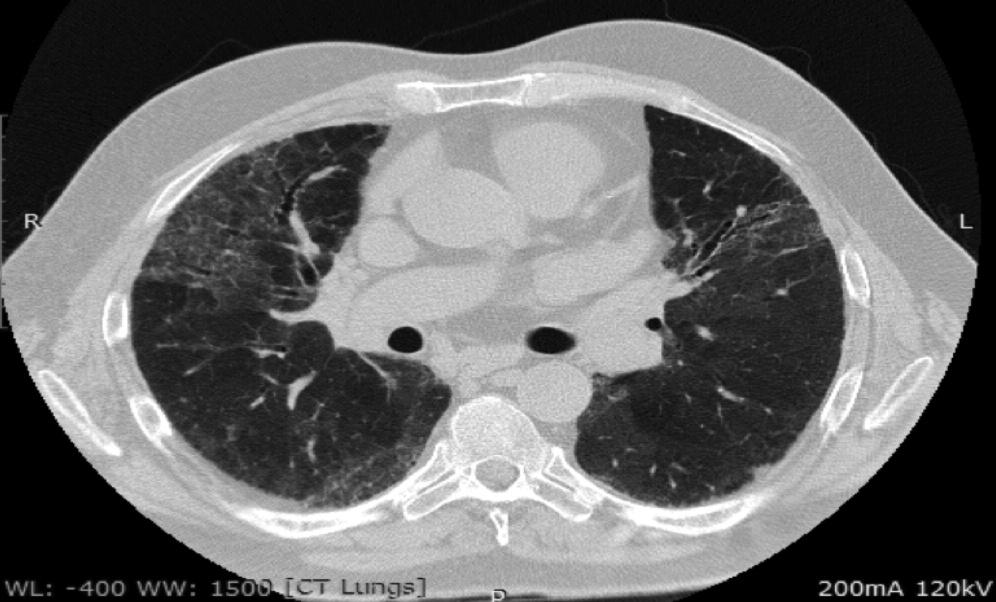
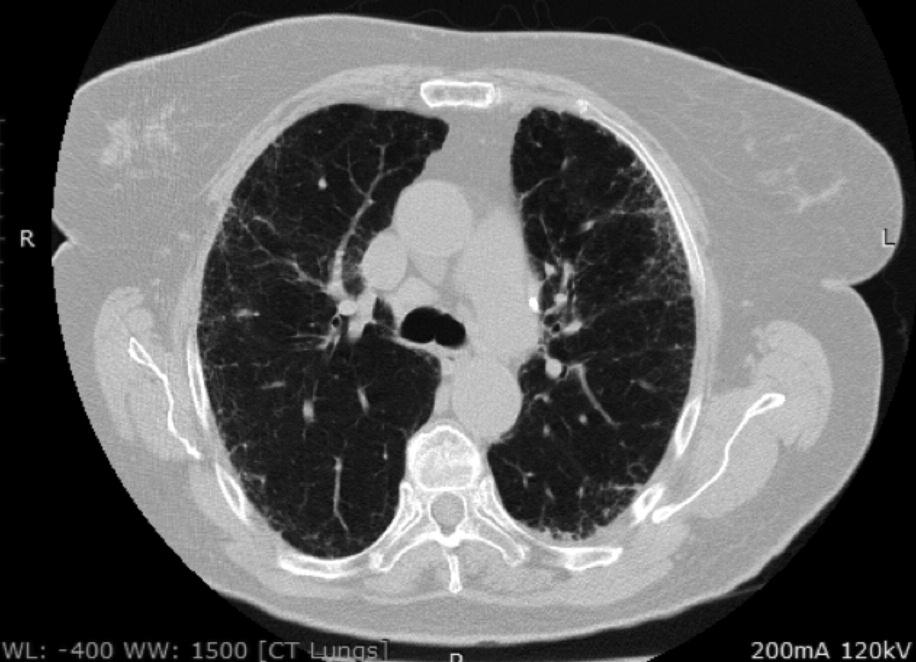
В одном из наиболее крупных исследований J. Oldham с соавт. описали группу из 144 пациентов с ИПАП: средний возраст больных составил 63 года, а приблизительно у половины из них основным рентгенологическим и/или гистологическим паттерном была ОИП [19]. У 14,6% пациентов имелись клинические и серологические критерии диагноза, у 8,3% – клинические и морфологические, у 26,4% – все три критерия. У пациентов с ИПАП и идиопатическим легочным фиброзом (ИЛФ) смертность оказалась сходной. Однако при дополнительном анализе результатов исследования было показано, что выживаемость больных ИПАП зависела от рентгенологического варианта поражения легких. При наличии картины ОИП прогноз был сходным с таковым больных с ИЛФ, тогда как у пациентов с другими рентгенологическими паттернами выживаемость была значительно выше и сопоставимой с таковой при ИП, ассоциирующейся с СЗСТ. По данным многофакторного анализа, независимыми неблагоприятными прогностическими факторами были возраст и снижение диффузионной способности легких для монооксида углерода.
В другом исследовании S. Chartrand и соавт. описали 56 пациентов с ИПАП в возрасте в среднем 54,6 года, большинство из которых были некурящими [20]. Наиболее частым паттерном ИП при КТВР и биопсии легкого была НСИП (51,8%), в то время как ОИП была выявлена всего у 9% пациентов. Более чем у половины пациентов имелись классификационные критерии, относящиеся ко всем трем группам, у 37,5% – серологические и морфологические, у 9% – клинические и морфологические, у 1,5% (1 пациент) – серологические и клинические критерии. Наиболее частым клиническими симптомами были феномен Рейно (39,3%), «рука механика» (28,6%) и симптом Готтрона (17,9%). Среди серологических критериев чаще всего встречались АНА в диагностическом титре (48,2%), анти-Ro/SS-A (42,9%), а также анти-тРНК-синтетазные антитела (АТСА) (35,7%). В исследуемой группе не отмечено ни одного летального исхода в течение периода наблюдения (284±141,3 недель).
К. Ahmad и соавт. наблюдали 57 больных с ИПАП, среди которых у 11,1% выявлены клинические и серологические классификационные критерии, у 7% – клинические и морфологические критерии, у 52,7% – серологические и морфологические критерии, у 29,2% – все три критерия [21]. Средний возраст пациентов с ИПАП составил 64,4±14 лет. Соотношение мужчин и женщин было приблизительно одинаковым. 34% пациентов курили. Наиболее частыми рентгенологическими паттернами были НСИП (42,1%) и ОИП (28%), тогда как основным внепаренхиматозным проявлением среди морфологических критериев оказалась легочная васкулопатия (17,5%). В течение периода наблюдения длительностью 16 месяцев умерли 7 пациентов. Много факторный анализ показал, что только курение было неблагоприятным прогностическим фактором. В то же время следует отметить, что в отличие от исследования J. Oldham и соавт., авторы не выявили различия выживаемости между группами пациентов с паттернами ОИП и НСИП.
В исследование Y. Ito и соавт. были включены 99 пациентов с ИПАП [22]. Один пациент с паттерном ОИП был исключен из анализа. Среди остальных 98 пациентов у 64,3% выявлен морфологический паттерн НСИП, у 20,4% – ОП, у 15,3% – перекрест НСИП и ОП. Пятилетняя выживаемость составила 71,1%, средняя продолжительность жизни после установления диагноза – 12,5 лет. Неблагоприятным прогностическим фактором было наличие паттерна НСИП, в то время как серологических предикторов прогноза выявлено не было. У 12 (12,2%) пациентов с ИПАП в динамике отмечено развитие СЗСТ (в большинстве случаев – ревматоидного артрита).
К. Yoshimura с соавт. выделили подгруппу пациентов с ИПАП среди больных с фибротическими вариантами хронической ИП (ОИП и фиброзным вариантом НСИП) [23]. Среди классификационных критериев ИПАП чаще других встречались морфологические (97% пациентов), реже – серологические (72%) и клинические (53%). У пациентов с ИПАП были отмечены более высокая выживаемость и более низкая обострений основного заболевания. При анализе подгрупп у пациентов с ИПАП, сочетавшейся с паттерном НСИП, выживаемость была выше, чем у больных с идиопатической НСИП. Также следует отметить, что в данном исследовании была выявлена тенденция к более высокой выживаемости пациентов с ИПАП, у которых определялся паттерн ОИП, по сравнению с таковой больных с ИЛФ.
H. Chung и соавт. изучали морфологические предикторы прогноза у пациентов с ИПАП [24]. У большинства из них (65,4%) при КТВР был выявлен паттерн типичной или возможной ОИП. По данным однофакторного анализа, достоверными рентгенологическими признаками, ассоциированными со снижением выживаемости, были ретикулярные изменения, зоны «сотового легкого», мозаичная вентиляция (при отсутствии эмфиземы), а также увеличение диаметра легочной артерии. В то же время наличие паттерна ОИП по данным КТВР, а также степень выраженности фиброзных изменений в легких не позволяли предсказать прогноз. По данным многофакторного анализа, независимыми достоверными предикторами неблагоприятного прогноза оказались только зоны «сотового легкого» и увеличение диаметра легочной артерии.
Таким образом, большинство данных, характеризующих группу пациентов с ИПАП, получены в ретроспективных одноцентровых исследованиях, что не позволяет экстраполироват их на всю популяцию таких больных. Этим также может частично объясняться выраженная неоднородность результатов вышеуказанных работ. В частности, в настоящее время остается до конца не выясненным прогностическое значение паттерна ОИП у пациентов с ИПАП: в ряде исследований прогноз в данной подгруппе пациентов не отличался от такового у пациентов ИЛФ, в то время как авторы других работ не выявили сходной закономерности. Кроме того, следует отметить, что в большинстве исследований не учитывалось влияние проводимой иммуносупрессивной терапии на прогноз пациентов с ИПАП. С одной стороны, это ограничивает прогностическое значение полученных результатов исследований, а, с другой стороны, не позволяет разработать рекомендации относительно рациональной фармакотерапии данной патологии.
Обсуждение
Действующие в настоящее время критерии ИПАП были предложены в 2015 г. группой экспертов в области пульмонологии и ревматологии с целью выделения отдельной когорты пациентов с ИИП и признаками системных аутоиммунных заболеваний, не соответствующих классификационным критериям конкретного СЗСТ. Преимущество предложенной классификации заключается в том, что она заменила множество введенных ранее и различающихся между собой определений ИПАП, а также стала основой для разработки критериев включения пациентов в клинические исследования, необходимые для изучения этой патологии.
С учетом новых данных, полученных в группах пациентов с ИПАП, ряд исследователей предлагают различные варианты пересмотра и доработки существующих критериев заболевания. В частности, G. Sambataro и соавт. [18] указывают на то, что наличие среди критериев ИПАП специфичных или даже патогномоничных признаков СЗСТ (симптом Готтрона [25], «рука механика», антитела к цитруллинированному пептиду, АТСА и ряд других аутоантител) не является рациональным. Это объясняется тем, что классификационные критерии ИПАП пересекаются с таковыми недифференцированного заболевания соединительной ткани 27 или с критериями, предложенными для ранней диагностики некоторых СЗСТ. Таким образом, в дебюте часть СЗСТ могут ложно классифицироваться как ИПАП. Примером могут служить критерии ранней диагностики системной склеродермии (very early diagnosis of systemic sclerosis, VEDOSS) [28], которые позволяют идентифицировать пациентов с высоким риском развития этого заболевания. Данная группа пациентов представляет большой интерес, особенно учитывая тот факт, что наличие явных «склеродермических» признаков позволяет не только установить диагноз, но и начать лечение на ранней стадии заболевания.
Кроме того, критериям ИПАП может соответствовать часть пациентов с антисинтетазным синдромом. Принимая во внимание отсутствие единых международных критериев этого синдрома, пациентам с ИП и антисинтетазными антителми (АТСА) может был установлен диагноз как антисинтетазного синдрома, так и ИПАП, несмотря на высокий риск развития у них остальных клинических проявлений классической триады симптомов (артрит и/или миозит) [29]. В отношении антисинтетазного синдрома существует еще одна проблема: с одной стороны, у всех пациентов с ИП необходимо определять антитела, ассоциированные с воспалительными миопатиями, однако на практике в большинстве клинических лабораторий полный перечень данных аутоантител рутинно не исследуется, поэтому антисинтетазный синдром может остаться недиагностированным.
Рядом исследователей были предложены дополнения к существующему определению ИПАП, в частности в серологическую группу критериев рекомендовано включение дополнительных антител, таких как АНЦА [30] и анти-Ku антитела [31]. Уже описаны когорты пациентов с АНЦА-позитивной ИП. Тем не менее, на настоящий момент количество данных относительно этой группы больных весьма ограничено. H. Yamada описал группу из 92 пациентов с ИП, которую ранее классифицировали как ИЛФ с наличием АНЦА [32]. В данной когорте у 35,8% отмечалось наличие АНЦАассоциированного васкулита в дебюте заболевания, еще у 17,4% пациентов он развился в течение нескольких лет после установления диагноза, а у оставшихся 46,8% пациентов ИП оставалась единственным клиническим проявлением заболевания. У части пациентов при биопсии легкого определялись признаки васкулита с поражением интерстиция и/или бронхов. Авторами статьи предложено два возможных механизма формирования интерстициальных изменений в легких при наличии АНЦА. Первый предполагает развитие интерстициального фиброза в результате субклинических альвеолярных геморрагий. В соответствии со второй гипотезой в ответ на образование воспалительных цитокинов миелопероксидаза экспрессируется на поверхности нейтрофилов, что может приводить к фиксации циркулирующих АНЦА с последующей дегрануляцией нейтрофилов и высвобождением активных форм кислорода, которые вызывают повреждение легочной ткани и развитию фиброза. Второй механизм, в частности, способен объяснить развитие АНЦА-ассоциированной ИП без признаков системного васкулита.
Таким образом, текущие диагностические критерии ИПАП охватывают весьма неоднородную группу пациентов, в связи с чем в большинстве исследований проводился поиск прогностических факторов выживаемости пациентов с ИПАП. Особый интерес вызывает морфологический паттерн ОИП, относительно значения которого в настоящее время нет единого мнения. Отсутствие ОИП в группе морфологических критериев ИПАП, с одной стороны, и более низкая выживаемость в данной подгруппе пациентов по результатам ряда исследований, с другой стороны, ставят вопрос о том, не должны ли пациенты с ОИП исключаться из клас сификационной группы ИПАП. Тем не менее, до появления данных проспективных исследований, подтверждающих внутригрупповую неоднородность ИПАП, выявления достоверных предикторов прогноза выживаемости и ответа на различные варианты терапии, пациентов с ОИП следует включать в группу ИПАП при наличии клинических и/или серологических критериев данного диагноза [33].
В ближайшем будущем необходимо проведение проспективных клинических исследований с целью изучения эффективности иммуносупрессивных, и возможно, антифибротических препаратов у пациентов с ИПАП. При большинстве вариантов СЗСТ-ИП и не-ОИП вариантах идиопатической ИП основной медикаментозной терапии являются глюкокортикостероиды, которые в части случаев сочетают с иммунодепрессивными и генно-инженерными биологическими препаратами, однако они неэффективны при ИЛФ, который представляет собой вариант идиопатической ИП с рентгенологическим паттерном ОИП [34,35]. Учитывая доказанную эффективность антифибротической терапии у пациентов с ИЛФ, не исключена возможность ее применения у части пациентов с ИПАП.
Заключение
Диагноз ИПАП был введен с целью унификации группы пациентов с ИП, у которых определяются отдельные симптомы системных аутоиммунных заболеваний. Тем не менее, данные клинических исследований указывают на то, что текущее определение ИПАП, вероятно, не позволяет выделить однородную популяцию больных. Уточнение классификационных критериев ИПАП может оказаться полезным для выделения отдельных вариантов этого состояния, отличающихся по клиническому течению, ответу на терапию и прогнозу, в том числе вероятности развития определенных системных заболеваний соединительной ткани. Для подтверждения данной гипотезы требуется проведение многоцентровых проспективных исследований с междисциплинарным подходом к диагностике и выбору терапии пациентов с ИПАП.
Лимфоцитарная интерстициальная пневмония
(Лимфоидная интерстициальная пневмония)
, MD, MAS, University of Colorado Denver
Клинические проявления
У взрослых лимфоцитарная интерстициальная пневмония вызывает развитие прогрессирующей одышки и кашля. Эти проявления прогрессируют в течение нескольких месяцев или, в некоторых случаях, – нескольких лет, а средний возраст заболевших – 54 года. Также наблюдается снижение массы тела, лихорадка, артралгии и ночная потливость, но гораздо реже.
Физикальное обследование позволяет выявить влажные хрипы. Проявления в виде гепатоспленомегалии, артрита и лимфаденопатии редки и предполагают наличие сопутствующего или альтернативного диагноза.
Диагностика
КТ высокого разрешения (КТВР)
Для подтверждения следует провести биопсию
Лимфоцитарную интерстициальную пневмонию следует заподозрить у пациентов с факторами риска и соответствующими симптомами. При данном диагнозе требуются визуализационные методы исследования, в некотрых случаях проводится биопсия легких.
При рентгенографии органов грудной клетки выявляются линейные или очаговые затемнения, а также усиление легочного рисунка, преимущественно в базальных отделах – неспеци-фические изменения, выявляемые при других инфекциях легких. Альвеолярные затемнения и/или цисты могут выявляться в запущенных случаях.
КТВР помогает установить распространенность поражения, оценить анатомию корней и выявить поражение плевры. Результаты КТВР высоко вариабельны. Характерными изменениями являются: центрилобулярные и субплевральные узелки, утолщение бронхососудистых пучков, узелковые затемнения по типу «матового стекла» и кистозные структуры.
Может наблюдаться выраженная гипоксемия.
Бронхоальвеолярный лаваж позволяет исключить инфекцию и выявить повышение количества лимфоцитов.
Назначают стандартные лабораторные исследования и электрофорез сывороточных белков (ЭФСБ), т. к. примерно у 80% пациентов наблюдаются изменения белкового состава сыворотки крови, обычно в виде поликлональной гаммапатии и гипогаммаглобулинемии; однако значение данных изменений неизвестно.
Для подтверждения диагноза у взрослых необходимо выполнить биопсию легких и выявить расширение альвеолярных септ инфильтрацией лимфоцитарных и других иммунных клеток (плазматическими клетками, иммунобластами, гистиоцитами). Иногда инфильтраты развиваются по ходу бронхов и сосудов, но обычно инфильтрация распространяется вдоль межальвеолярных перегородок. Иммуногистохимическое окрашивание и проточная цитометрия должны выполняться с целью дифференциальной диагностики ЛИП и первичных лимфом. При ЛИП инфильтрация является поликлональной (В- и Т-клеточная), тогда как лимфоматозный инфильтрат моноклонален. Также выявляются герминальные центры и многоядерные гигантские клетки с неказеозными гранулемами.
Прогноз
Естественное течение и прогноз ЛИП у взрослых мало изучены. Может иметь место спонтанное разрешение, разрешение после лечение кортикостероидами или другими иммунодепрессантами, прогрессирование с развитием лимфомы или фиброза легких и дыхательной недостаточности. 5-летняя выживаемость составляет 50–66%. Частые причины смерти – инфекции, злокачественные лимфомы (5%) и прогрессирующий фиброз.
Лечение
В некотрых случаях – Kортикостероиды или цитотоксические препараты
Для лечения лимфоцитарной интерстициальной пневмонии используются кортикостероиды и/или цитотоксические средства, однако, как и при других причинах интерстициальных заболеваний легких, эффективность этого подхода не известна.
Основные положения
Лимфоцитарная интерстициальная пневмония в целом мало распространена, но является одним из наиболее распространенных заболеваний легких у ВИЧ-инфицированных детей.
Симптомы и признаки не являются специфическими.
Необходимо провести КТ высокого разрешения, бронхоальвеолярный лаваж, в некоторых случаях биопсию легких.
Лечить пациентов кортикостероидами, цитотоксичными препаратами, или и теми, и другими.