левофлоксацин с чем принимать при пневмонии
Левофлоксацин (500 мг)
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Таблетки, покрытые оболочкой, 500 мг
Состав
Одна таблетка содержит
(в пересчете на левофлоксацин 500,0 мг),
вспомогательные вещества: целлюлоза микрокристаллическая, натрия крахмала гликолят, кремния диоксид коллоидный (аэросил), кальция стеарат, кислота стеариновая, натрия альгинат,
состав оболочки: гипромеллоза, титана диоксид (Е 171), полисорбат 80 (твин-80), краситель желтый хинолиновый, вазелиновое масло.
Описание
Таблетки, покрытые оболочкой, желтого цвета, с двояковыпуклой поверхностью.
Фармакотерапевтическая группа
Антибактериальные препараты для системного использования.
Фармакологические свойства
Фармакокинетика
Хорошо проникает в органы и ткани. В печени небольшая часть окисляется и/или дезацетилируется. Менее 5% левофлоксацина экскретируется в виде продуктов биотрансформации.
Фармакодинамика
Левофлоксацин активен в отношении большинства штаммов микроорганизмов
— аэробные грамположительные микроорганизмы: Enterococcus faecalis, Staphylococcus aureus (метициллин-чувствительные), Staphylococcus haemoliticus (метициллин-чувствительные), Staphylococcus saprophyticus, Streptococcus pneumoniae (включая пенициллин-резистентные штаммы), Streptococcus pyogenes и Streptococci (группы C и G); Staphylococcus haemoliticus (метициллин-резистентные);
— аэробные грамотрицательные микроорганизмы: Enterobacter cloacae, Escherichia coli, Haemophilus influenzae (ампициллин-чувствительные и резистентные), Heamophilus parainfluenzae, Klebsiella pneumoniae, Klebsiella oxytoca, Legionella pneumophila, Moraxella catarrhalis 1+/-, Pasteurella multocida, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Serratia marcescens, Salmonella species, Shigella species, Yersinia enterocolitica, другие Enterobacter spp, Bordetella pertussis, Citrobacter spp, Acinetobacter spp, Morganella morganii, и Providencia spp.;
— анаэробные микроорганизмы: Clostridium perfringes, Bacteroides fragilis, Peptostreptococci; другие Bacteroides spp., Clostridium difficile;
— внутриклеточные микроорганизмы: Chlamidia pneumoniae, Chlamidia psittaci, Mycoplasma pneumoniae, Mycobacterium tuberculosis.
Показания к применению
обострение хронического бронхита
инфекции кожи и мягких тканей
хронический бактериальный (гонорейный, хламидийный) простатит
Способ применения и дозы
Взрослым: таблетки 500 мг принимают 1-2 раза в сутки. Дозы и продолжительность лечения определяются характером и тяжестью инфекции, а также чувствительностью предполагаемого возбудителя. Таблетки следует принимать, не разжевывая, запивая достаточным количеством жидкости, принимаются во время еды или между приемами пищи. Следует строго соблюдать инструкции по применению.
Для пациентов с нормальной функцией почек или умеренно сниженной функции почек клиренс креатина (КК) > 50 мл/мин можно рекомендовать следующий режим дозирования препарата:
Максимальная разовая доза – 500мг, максимальная суточная доза – 1000мг.
Регистрационный номер:
Торговое наименование препарата:
Международное непатентованное или группировочное наименование:
Лекарственная форма:
Состав:
1 капсула 250 мг содержит:
Действующее вещество: Левофлоксацина гемигидрата 256,23 мг, в пересчете на безводный левофлоксацин 250 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая, тип 101 84,86 мг, гипромеллоза 1,2 мг, повидон К30 4,71 мг, кальция стеарат 3,0 мг.
Состав оболочки капсул:
корпус: титана диоксид (Е171) – 2,0%, желатин – до 100%.
крышечка: титана диоксид (Е171) – 1,00%, индигокармин (Е132) – 0,13330%, желатин – до 100%.
1 капсула 500 мг содержит:
Действующее вещество: Левофлоксацина гемигидрата 512,46 мг, в пересчете на безводный левофлоксацин 500 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая, тип 101 71,07 мг, гипромеллоза 2,4 мг, повидон К30 8,07 мг, кальция стеарат 6,0 мг.
Состав оболочки капсул:
корпус: титана диоксид (Е171) – 2,0%, желатин – до 100%.
крышечка: титана диоксид (Е171) – 1,00%, индигокармин (Е132) – 0,13330%, желатин – до 100%.
Описание
Капсулы 250 мг: твердые желатиновые капсулы № 0 с непрозрачным корпусом белого цвета и непрозрачной крышечкой голубого цвета. Содержимое капсул – смесь гранул и порошка светло-желтого цвета.
Капсулы 500 мг: твердые желатиновые капсулы № 00 с непрозрачным корпусом белого цвета и непрозрачной крышечкой голубого цвета. Содержимое капсул – смесь гранул и порошка светло-желтого цвета.
Фармакотерапевтическая группа:
противомикробное средство, фторхинолон.
Код ATX:
Фармакологические свойства
Фармакодинамика
Препарат Левофлоксацин – синтетический антибактериальный препарат широкого спектра действия из группы фторхинолонов, содержащий в качестве действующего вещества левофлоксацин – левовращающий изомер офлоксацина. Левофлоксацин блокирует ДНК-гиразу и топоизомеразу IV, нарушает суперспирализацию и сшивку разрывов ДНК, ингибирует синтез ДНК, вызывает глубокие морфологические изменения в цитоплазме, клеточной стенке и мембранах микробных клеток.
Левофлоксацин активен в отношении большинства штаммов микроорганизмов, как в условиях in vitro, так и in vivo.
Чувствительные микроорганизмы (МПК ≤2 мг/л, зона ингибирования >17 мм)
Умеренно чувствительные микроорганизмы (МПК = 4 мг/л, зона ингибирования 16-14 мм)
Резистентные к левофлоксацину микроорганизмы (МПК ≥8 мг/л, зона ингибирования ≤13 мм)
Другие микроорганизмы: Mycobacterium avium.
Резистентность
Резистентность к левофлоксацину развивается в результате поэтапного процесса мутаций генов, кодирующих обе топоизомеразы типа II: ДНК-гиразу и топоизомеразу IV. Другие механизмы резистентности, такие как механизм влияния на пенетрационные барьеры микробной клетки (механизм, характерный для Pseudomonas aeruginosa) и механизм эффлюкса (активного выведения противомикробного средства из микробной клетки), могут также уменьшать чувствительность микроорганизмов к левофлоксацину.
В связи с особенностями механизма действия левофлоксацина обычно не наблюдается перекрестной резистентности между левофлоксацином и другими противомикробными средствами.
Клиническая эффективность (эффективность в клинических исследованиях при лечении инфекций, вызываемых перечисленными ниже микроорганизмами)
Фармакокинетика
Левофлоксацин быстро и практически полностью всасывается после приема внутрь, прием пищи мало влияет на его абсорбцию. Абсолютная биодоступность при приеме внутрь составляет 99-100%. После однократного приема 500 мг левофлоксацина максимальная концентрация (Сmax) в плазме крови достигается в течение 1-2 ч и составляет 5,2±1,2 мкг/мл. Фармакокинетика левофлоксацина является линейной в диапазоне доз от 50 мг до 1000 мг. Равновесная концентрация левофлоксацина в плазме крови при приеме внутрь 500 мг левофлоксацина 1 или 2 раза в сутки достигается в течение 48 ч.
На 10 день приема внутрь левофлоксацина 500 мг 1 раз в сутки Сmax левофлоксацина составляла 5,7±1,4 мкг/мл, а минимальная концентрация левофлоксацина (концентрация перед приемом очередной дозы) (Cmin) в плазме крови составляла 0,5 ± 0,2 мкг/мл.
На 10 день приема внутрь левофлоксацина 500 мг 2 раза в сутки Сmax в плазме крови составляла 7,8±1,1 мкг/мл, a Cmin – 3,0±0,9 мкг/мл.
Связывание с белками сыворотки крови составляет 30-40%. После однократного и повторного приема внутрь 500 мг левофлоксацина объем распределения левофлоксацина составляет в среднем 100 л., что указывает на хорошее проникновение левофлоксацина в органы и ткани организма человека.
Проникновение в слизистую оболочку бронхов, жидкость эпителиальной выстилки, альвеолярные макрофаги
После однократного приема внутрь 500 мг левофлоксацина Сmax в слизистой оболочке бронхов и жидкости эпителиальной выстилки достигались в течение 1 ч или 4 ч и составляли 8,3 мкг/г и 10,8 мкг/мл, соответственно, с коэффициентами пенетрации в слизистую оболочку бронхов и жидкость эпителиальной выстилки по сравнению с концентрацией в плазме крови, составляющими 1,1-1,8 и 0,8-3,0 соответственно.
После 5 дней приема внутрь 500 мг левофлоксацина средние концентрации левофлоксацина через 4 ч после последнего приема препарата в жидкости эпителиальной выстилки составляли 9,94 мкг/мл и в альвеолярных макрофагах – 97,9 мкг/мл.
Проникновение в легочную ткань
Сmax в легочной ткани после приема внутрь 500 мг левофлоксацина составляли приблизительно 11,3 мкг/г и достигались через 4-6 ч после приема препарата с коэффициентами пенетрации 2,0-5,0 по сравнению с концентрацией в плазме крови.
Проникновение в альвеолярную жидкость
После 3 дней приема 500 мг левофлоксацина 1 или 2 раза в сутки Сmax левофлоксацина в альвеолярной жидкости достигались через 2-4 ч после приема препарата и составляли 4,0 мкг/мл и 6,7 мкг/мл, соответственно, с коэффициентом пенетрации 1,0 по сравнению с концентрациями в плазме крови.
Проникновение в костную ткань
Левофлоксацин хорошо проникает в кортикальную и губчатую костную ткань, как в проксимальных, так и в дистальных отделах бедренной кости, с коэффициентом пенетрации (костная ткань/плазма крови) 0,1-3,0. Сmax левофлоксацина в губчатой костной ткани проксимального отдела бедренной кости после приема 500 мг препарата внутрь составляли приблизительно 15,1 мкг/г (через 2 ч после приема препарата).
Проникновение в спинномозговую жидкость
Левофлоксацин плохо проникает в спинномозговую жидкость.
Проникновение в ткань предстательной железы
После приема внутрь 500 мг левофлоксацина 1 раз в сутки в течение 3-х дней, средняя концентрация левофлоксацина в ткани предстательной железы составляла 8,7 мкг/г, среднее соотношение концентраций предстательная железа/плазма крови составляло 1,84.
Концентрации в моче
Средние концентрации в моче через 8-12 ч после приема внутрь дозы 150 мг, 300 мг и 600 мг левофлоксацина составляли 44 мкг/мл, 91 мкг/мл и 162 мкг/мл, соответственно.
Левофлоксацин метаболизируется в незначительной степени (5% принятой дозы). Его метаболитами являются дезметиллевофлоксацин и N-оксид левофлоксацин, которые выводятся почками. Левофлоксацин является стереохимически стабильным и не подвергается хиральным превращениям.
После приема внутрь левофлоксацин относительно медленно выводится из плазмы крови (период полувыведения [Т1/2] – 6-8 ч). Выведение преимущественно почками (более 85% принятой дозы). Общий клиренс левофлоксацина после однократного приема 500 мг составлял 175±29,2 мл/мин.
Отсутствуют существенные различия в фармакокинетике левофлоксацина при его внутривенном введении и приеме внутрь, что подтверждает, что прием внутрь и внутривенное введение являются взаимозаменяемыми.
Фармакокинетика у отдельных групп пациентов
Фармакокинетика левофлоксацина у мужчин и женщин не различается.
Фармакокинетика у пациентов пожилого возраста не отличается от таковой у молодых пациентов, за исключением различий фармакокинетики, связанных с различиями в клиренсе креатинина (КК).
При почечной недостаточности фармакокинетика левофлоксацина изменяется. По мере ухудшения функции почек выведение через почки и почечный клиренс (CIR) уменьшаются, а Т1/2 удлиняется.
Фармакокинетика при почечной недостаточности после однократного приема внутрь 500 мг левофлоксацина
Режим дозирования у пациентов с нарушением функции почек (КК ≤50 мл/мин)
Левофлоксацин выводится преимущественно почками, поэтому при лечении пациентов с нарушенной функцией почек требуется снижение дозы препарата (см. таблицу ниже).
Левофлоксацин: ступенчатая терапия внебольничной пневмонии у взрослых
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Государственный институт усовершенствования врачей МО РФ, Москва
Главный военный клинический госпиталь им. Н.Н. Бурденко, Москва
Т радиционный подход к ведению больных тяжелыми или прогностически неблагоприятными инфекциями нижних дыхательных путей (прежде всего пневмонией) предполагал парентеральное введение антибиотиков на протяжении всего периода госпитализации. При этом в известной степени игнорировалась альтернативная возможность назначения антибиотиков в пероральной лекарственной форме, которые имеют широкий спектр антимикробной активности, привлекательную биодоступность при приеме внутрь и столь же эффективны, как и парентеральные формы антибактериальных препаратов. Впрочем, с появлением новых оральных антибиотиков, характеризующихся превосходным фармакокинетическим профилем и безопасностью, и улучшением наших знаний о фармакодинамических предикторах эффективности антибактериальной терапии стало возможным более частое обращение к назначению антибиотиков внутрь даже при серьезных инфекциях, в т.ч. и дыхательных путей.
Особый интерес при этом представляет концепция т.н. ступенчатой терапии*, предполагающая двухэтапное применение антибактериальных препаратов: переход с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента и без ущерба конечной эффективности лечения.
Основная идея ступенчатой терапии – очевидные преимущества для больного, врача и лечебного учреждения (сокращение продолжительности госпитального периода и перевод на лечение в домашних условиях, психологически более комфортных; минимизация риска нозокомиальных инфекций; снижение затрат, связанных с меньшей стоимостью оральных антибиотиков, отказ от дополнительных расходов на введение лекарственного средства в парентеральной форме и т.д.) при сохранении высокого качества медицинской помощи – корреспондирует с современными рекомендациями по ведению больных внебольничной пневмонией [3, 4, 5], справедливо подчеркивающими, что в настоящее время оказание высокоэффективной/высококачественной медицинской помощи должно осуществляться наиболее экономичным путем.
Ступенчатая антибактериальная терапия пневмонии была впервые проведена в 1985 г., когда F. Shann et al. [6] c успехом применили у детей Папуа и Новой Гвинеи последовательное назначение хлорамфеникола в парентеральной, а затем и пероральной лекарственных формах. Однако справедливости ради надо сказать, что только спустя два года R. Quintiliani et al. [7] представили научное обоснование этого нового подхода к применению антибактериальных препаратов.
В реализации концепции ступенчатой антибактериальной терапии необходимо учитывать несколько факторов, а именно «фактор больного», «фактор возбудителя» и «фактор антибиотика» [1] – см. таблицу 1.
Очевидно, что ступенчатая антибактериальная терапия – это не просто механическая замена парентерального лекарственного средства на оральное. Прежде всего, с учетом клинической целесообразности, должны быть определены соответствующие сроки этой замены. При этом основными условиями безопасного перехода на пероральную терапию должны быть следующие: а) тяжелое состояние пациента с нестабильно гемодинамикой, требующее помещения в ОРИТ, исключает актуальность перехода на прием антибиотика внутрь; б) нормальная гастроинтестинальная абсорбция; в) перевод на пероральный антибиотик должен осуществляться в сроки, когда удается убедительно продемонстрировать адекватный клинический и лабораторный «ответ» на начатую парентеральную (как правило, внутривенную) терапию [5]. Обычно к числу последних относят достижение апирексии, уменьшение кашля и выраженности других респираторных симптомов, существенное снижение количества лейкоцитов периферической крови и т.д. Так, в частности, одними из широко популяризируемых критериев перехода на пероральную антибактериальную терапию респираторных инфекций – J.A. Ramirez, 1995 [8] – являются: уменьшение кашля, других респираторных симптомов; нормальная температура тела при последовательном ее измерении с 8–часовым интервалом; тенденция к нормализации количества лейкоцитов периферической крови; отсутствие нарушений гастроинтестинальной абсорбции.
В целом, основываясь на анализе доступных исследований по оценке эффективности и безопасности ступенчатой терапии инфекций нижних дыхательных путей (прежде всего, внебольничной пневмонии), можно выделить следующие условия перехода на прием антибиотика внутрь:
• достижение клинического улучшения на фоне первоначально проводимой внутривенной антибактериальной терапии;
• отсутствие у больного известных факторов риска неблагоприятного прогноза внебольничной пневмонии: состояние после спленэктомии, хронический алкоголизм, нарушения интеллектуально–мнестического статуса, серьезные отклонения результатов физического/лабораторного обследования – тахипноэ і 30/мин, систолическое артериальное давление 38,3 °С, артериальная гипоксемия 30х109/л), почечная недостаточность (остаточный азот мочевины > 20 мг/дл), многодолевая пневмоническая инфильтрация, быстрое прогрессирование очагово–инфильтративных изменений в легких, деструкция легочной ткани, признаки тяжелого течения инфекционного процесса (метаболический ацидоз, септический шок, респираторный дистресс–синдром взрослых и др.).
При этом время перехода с внутривенного на пероральный путь введения антибиотика варьирует, как правило, от 48 до 72 ч. Согласно отдельным публикациям, ближайшие 48 часов представляются оптимальным временным промежутком для принятия решения о переходе на оральный антибиотик [10].
Простую, на первый взгляд, схему ступенчатой антибактериальной терапии инфекций нижних дыхательных путей порой бывает сложно реализовать, поскольку больной может оказаться в поле зрения врачей различных специальностей (отсюда становится чрезвычайно актуальной максимально широкая популяризация современных рекомендаций по ведению больных внебольничной пневмонией). В этом контексте следует принимать во внимание и возможные особенности кооперации «врач – больной». И, наконец, необходимо учитывать то обстоятельство, что у отдельных больных наблюдается медленное обратное клинико–рентгенологическое развитие заболевания, а значит, до перехода на оральную терапию следует провести анализ возможных причин затяжного течения внебольничной пневмонии.
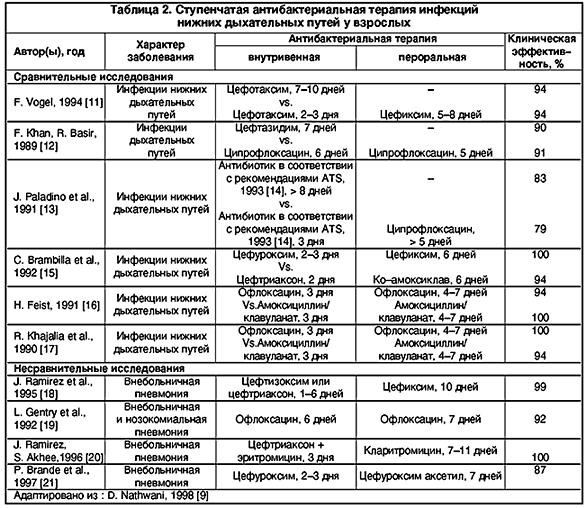
К настоящему времени, мы располагаем весьма ограниченным числом контролируемых клинических исследований, подтверждающих высокую эффективность и безопасность ступенчатой терапии инфекций нижних дыхательных путей (табл. 2). Тем не менее имеющиеся данные служат серьезным аргументом в пользу, по возможности, раннего перехода на пероральный прием антибиотиков в тех случаях, когда на фоне первоначальной внутривенной терапии внебольничной пневмонии достигается адекватный клинический и/или лабораторный «ответ» [3,4,5].
При выборе лекарственного средства для приема внутрь в рамках ступенчатой терапии предпочтение следует отдавать тем антибиотикам, которые демонстрируют идентичный либо близкий к антибиотикам, вводимым парентерально, спектр антимикробной активности. При этом большинство врачей чувствуют себя более комфортно, если переход происходит на оральную форму того же антибиотика (напротив, сам факт, что в ряде случаев соответствующий антибиотик недоступен в пероральной лекарственной форме, может отдалить сроки планируемого «переключения»). Особое значение имеет режим дозирования, корреспондирующий с высокой или, напротив, низкой комплаентностью. Дополнительные преимущества в этой связи приобретают антибиотики, принимаемые 1 или 2 раза в сутки. К числу требований к оральным антибиотикам следует отнести также высокую биодоступность, приемлемый профиль безопасности, минимальный уровень лекарственных взаимодействий.
Всем этим требованиям, особенно в контексте лечения внебольничной пневмонии, наилучшим образом отвечает левофлоксацин – из числа новых или т.н. респираторных фторхинолонов.
Во–первых, как и другие новые или «респираторные» фторхинолоны (моксифлоксацин, гатифлоксацин, гемифлоксацин), левофлоксацин обладает широким спектром активности в отношении всех потенциальных возбудителей внебольничной пневмонии, включая Streptococcus pneumoniae (независимо от их чувствительности к пенициллину и/или макролидам), атипичные возбудители и грамотрицательные бациллы [22].
Во–вторых, левофлоксацин характеризуется привлекательными фармакокинетическими параметрами: практически абсолютная биодоступность при приеме внутрь (і99%); достижение высоких и предсказуемых концентраций в слизистой бронхов, жидкости, выстилающей эпителий бронхов, альвеолярных макрофагах, полиморфноядерных лейкоцитах, превосходящих концентрацию в сыворотке крови [23, 24].
В–третьих, левофлоксацин доступен в лекарственных формах для внутривенного введения и приема внутрь, назначается 1 раз в сутки.
В–четвертых, левофлоксацин имеет приемлемый профиль безопасности, сопоставимый с таковым препаратов сравнения. Так, в частности, левофлоксацин характеризуется незначительной фототоксичностью [25], отсутствием серьезных нежелательных явлений со стороны центральной нервной системы [26], не метаболизируется ферментами системы цитохрома Р450, а значит, не взаимодействует с варфарином, теофиллином, и в целом характеризуется минимальной степенью лекарственных взаимодействий [27]. При приеме левофлоксацина не установлены удлинение корригированного интервала QT, клинически значимая гепатотоксичность [28]. С момента регистрации левофлоксацина в США в 1997 году (в Японии он применяется с 1993 года) во всем мире накоплен огромный опыт успешного клинического применения данного антибиотика, охватывающий более 150 миллионов больных [29]. Данное обстоятельство представляется особенно важным, поскольку специфические проблемы отдельных фторхинолонов (темафлоксацин, тровафлоксацин, грепафлоксацин, клинафлоксацин, ломефлоксацин, спарфлоксацин), могли создать всему классу имидж «токсических антибиотиков».
К настоящему времени в ходе хорошо организованных контролируемых исследований получены многочисленные свидетельства близкой или превосходящей клинической и (или) микробиологической эффективности левофлоксацина в сопоставлении с антибиотиками сравнения в рамках ступенчатой терапии внебольничной пневмонии. В ходе одного из них у больных внебольничной пневмонией была изучена клиническая/микробиологическая эффективность и безопасность левофлоксацина, вводимого внутривенно (500 мг 1 раз/сутки) и (или) перорально (500 мг 1 раз в сутки) в сравнении с цефтриаксоном (1,0–2,0 г 1–2 раза /сутки) и (или) цефуроксимом аксетилом (500 мг 2 раза/сутки) [30]. Помимо этого, исходя из конкретной клинической ситуации, больным, рандомизированным в группу «Цефтриаксон ± цефуроксим аксетил», могли назначаться эритромицин или доксициклин. Данное дополнение оказалось весьма актуальным, т.к. по результатам иммуносерологического исследования у значительного числа обследованных больных удалось установить Chlamydia pneumoniae–, Mycoplasma pneumoniae– и Legionella pneumophila–инфекции (соответственно у 101, 41 и 8 больных). В обеих группах продолжительность антибактериальной терапии не превышала 12 дней. При этом 2% больных получали левофлоксацин только в парентеральной лекарственной форме, 61% – внутрь, а 37% – в рамках ступенчатой терапии. В группе сравнения цефалоспорины в парентеральной, пероральной форме и в рамках ступенчатой терапии назначались соответственно в 2%, 50% и 48% случаев.
Сравнительный анализ показал, что клиническая и микробиологическая эффективность монотерапии левофлоксацином (назначавшимся в т.ч. и в рамках ступенчатой терапии) оказалась достоверно выше традиционных схем лечения внебольничной пневмонии (цефтриаксон ± цефуроксим аксетил±эритромицин или доксициклин) при сопоставимой частоте нежелательных явлений – 5,8% и 8,5% соответственно. Причем это превосходство никак не было связано с известным преимуществом фторхинолона перед цефалоспоринами в отношении «атипичных» возбудителей (табл. 3).
В еще одном исследовании изучалась сравнительная эффективность левофлоксацина в рамках ступенчатой терапии (500 мг 2 раза/сутки*) и цефтриаксона (4,0 г 1 раз/сутки) у больных с тяжелой внебольничной пневмонией [31]. Свидетельствами исходно тяжелого состояния пациентов являлось сопоставимое в обеих группах «представительство» больных с интегральной оценкой по шкале APACHE II і 15 баллов (21%), а также показатель летальности – 7%. В группе получавших левофлоксацин всем больным внутривенно было введено не менее 4–х доз препарата, и большинство пациентов (87%) со временем перешли на прием антибиотика внутрь.
Полученные данные свидетельствовали о сопоставимой клинической и микробиологической эффективности левофлоксацина и цефтриаксона в лечении тяжелой внебольничной пневмонии (табл. 4), хотя случаев отмены цефтриаксона ввиду ранней клинической неэффективности было достоверно больше (p=0,05).
Роль и место левофлоксацина в рамках ступенчатой терапии внебольничной пневмонии в сравнении с традиционной терапией были изучены в рамках масштабного канадского исследования (CAPITAL Study), включавшего 1743 больных, наблюдавшихся в 20 центрах [32]. Для решения вопроса о месте лечения и способе введения лекарственного средства использовалась известная прогностическая шкала M.J. Fine et al., 1997 [33]. При этом если, согласно этой шкале, итоговая оценка пациента в баллах не превышала 90, то лечение проводилось в домашних условиях с назначением левофлоксацина (500 мг 1 раз/сутки, внутрь) в течение 10 дней. Если же итоговая оценка в баллах составляла 91 и более, то больной госпитализировался, и первоначально левофлоксацин (500 мг 1 раз/сутки) вводился внутривенно (первая доза в течение ближайших 4 ч с момента обращения больного за медицинской помощью). В последующем, по достижении стабильного состояния (способность проглатывать пищу и жидкость, отрицательные результаты посевов крови, температура тела Ј38,0°C, частота дыхания 90%) для больных с сопутствующей хронической обструктивной болезнью легких при pО2>60 мм рт. ст.
И, наконец, недавно были опубликованы результаты еще одного многоцентрового открытого рандомизированного сравнительного исследования, ставившего своей целью изучить клиническую и микробиологическую эффективность левофлоксацина и цефтриаксона в комбинации с эритромицином у больных внебольничной пневмонией с высоким риском неблагоприятного исхода [34]. Cвидетельством исходно тяжелого состояния больных являлись соответствующие значения итоговой балльной оценки по шкале APACHE II, составившие в группе больных, получавших левофлоксацин, 15,9±6,29, а в группе сравнения – 16,0±6,65.
Больным, получавшим левофлоксацин (n=132), препарат первоначально вводился внутривенно в дозе 500 мг 1 раз/сутки (і 24 ч), а затем прием антибиотика продолжался в пероральной лекарственной форме (500 мг 1 раз/сутки) в течение 7–14 дней. В группе сравнения (n = 137) больным внутривенно или внутримышечно вводился цефтриаксон (1–2 г 1 раз/сутки) и внутривенно эритромицин (500 мг 4 раза/сутки) с последующим переходом на прием внутрь амоксициллина/клавуланата (875 мг 2 раза/сутки) в сочетании с кларитромицином (500 мг 2 раза/сутки).
Интегральная клиническая (случаи излечения и клинического улучшения) и микробиологическая эффективность оказались сопоставимыми в обеих группах (табл. 5).
Поскольку в большинстве из опубликованных ранее работ анализировались случаи внебольничной пневмонии с низким риском неблагоприятного исхода, то очевидно, что данное исследование представляет уникальную информацию, свидетельствующую, что монотерапия левофлоксацином по крайней мере не уступает по эффективности традиционному комбинированному лечению «цефтриаксон + эритромицин» у категории больных с высокой вероятностью летального исхода.
Как уже говорилось выше, такие свойства левофлоксацина, как возможность введения препарата в парентеральной и оральной лекарственных формах, доказанная клиническая эффективность при лечении инфекций дыхательных путей, практически абсолютная биодоступность, безопасность, отсутствие клинически значимых лекарственных взаимодействий, хорошая переносимость при приеме внутрь, длительный интервал дозирования создают образ «идеального» антибиотика для ступенчатой терапии внебольничной пневмонии. И в проведенных к настоящему времени исследованиях, включавших в т.ч. и больных с тяжелым и (или) прогностически неблагоприятным течением заболевания, были получены убедительные свидетельства превосходящей или, по меньшей мере, сопоставимой клинической и микробиологической эффективности монотерапии левофлоксацином по сравнении с традиционным комбинированным лечением (цефалоспорины + макролиды). Это обстоятельство, а также прекрасный профиль безопасности, подтвержденный многолетней практикой широкого клинического применения, и очевидные экономические преимущества монотерапии объясняют присутствие левофлоксацина в современных схемах лечения внебольничной пневмонии, особенно в условиях стационара (рис. 1).
1. Fine A., Grossman R., Ost D., Farber B., Cassiere H. Diagnosis and Management of Pneumonia and Other Respiratory Infections. 1st ed. Berlin:PCI; 1999.
2. Страчунский Л.С., Розенсон О.Л. Ступенчатая терапия: новый подход к применению антибактериальных препаратов. Клиническая фармакология и терапия 1997; 6: 15–24.
3. Bartlett J.G., Breiman R.F., Mandell L.A., File T.M. Community–acquired pneumonia in adults: guidelines for management. Infectious Diseases Society of America. Clin Infect Dis 1998; 26: 811–838.
4. Bartlett J.G., Dowell S.F., Mandell L.A. et al. Practice guidelines for the management of community–acquired pneumonia in adults. Infectious Diseases Society of America. Clin Infect Dis 2000; 31: 347–382.
5. Mandell L.A., Marrie T.J., Grossman R.F. et al. Canadian guidelines for the initial management of community–acquired pneumonia: an evidence–based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. Clin Infect Dis 2000; 31: 383–421.
6. Shann F., Barker J., Poore P. Chloramphenicol alone versus chloramphenicol plus penicillin for severe pneumonia in children. Lancet 1985; 2: 684–685.
7. Quintiliani R., Cooper B.W., Briceland L.L. et al. Economic impact of streamlining antibiotic administration. Am J Med 1987; 82(suppl 4A): 391–394.
8. Ramirez J.A. Switch therapy in community–acquired pnemonia. Diagn Microbiol Infect Dis 1995; 22: 219–223.
9. Nathwani D. Sequential Switch Therapy for Lower respiratory Tract Infections. A European Perspective. Chest 1998; 113: 211–218.
10. Weingarten S.R., Reidinger M.S., Varis G. et al. Identification of low–risk hospitalized patients with pneumonia: implications for early conversion to oral antimicrobial therapy. Chest 1994; 105: 1109–1115.
11. Vogel F., Multicentre Trial Group. Efficacy and tolerance of cefotaxime followed by oral cefixime versus cefotaxime alone in patients with lower respiratory tract infections. Curr Ther res 1994; 55(suppl A): 42–48.
12. Khan F.A., Basir R. Sequential intravenous–oral administration of ciprofloxacin vs ceftazidime in serious bacterial respiratory tract infections. Chest 1989; 96: 528–537.
13. Paladino J., Sperry H., Backes J. et al. Clinical and economic evaluation of oral ciprofloxacin after an abbreviated course of intravenous antibiotics. Am J Med 1991; 91: 462–470.
14. Niederman M.S., Bass J.B., Campbell A.M. et al. Guidelines for the initial management of adults with community–acquired pneumonia: diagnosis, assessment of severity, and initial antimicrobial therapy: American Thoracic Society, Medical Section of the American Lung Association. Am Rev Pespir Dis 1993; 148: 1418–1426.
15. Brambilla C., Kastanakis S., Knight S. et al. Cefuroxime and cefuroxime axetil versus amoxicillin plus clavulanic acid in the treatment of lower respiratory tract infections. Eur L Clin Microb Infect Dis 1992; 11: 118–124.
16. Feist H. Sequential therapy with IV and oral ofloxacin in lower respiratory tract infections: a comparative study. Infection 1991; 19 (suppl 7):380–383.
17. Khajalia R., Driicek M., Vetter N. A comparative study of ofloxacin and amoxycillin/clavulanate in hospitalized patients with lower respiratory tract infections. J Antimicrob Chemother 1990; 26 (suppl D): 83–91.
18. Ramirez J.A., Srinath L., Ahkee S. et al. Early switch from intravenous to oral cephalosporins in the treatment of hospitalized patients with community acquired pneumonia. Arch Intern Med 1995; 155: 1273–1276.
19. Gentry L.O., Rodriguez–Gomez G., Kohler R.B. et al. Parenteral followed by oral ofloxacin for nosocomial pneumonia and community–acquired pneumonia requiring hospitalization. Am Rev Respir Dis 1992; 145: 31–35.
20. Ramirez J.A., Akhee S. Early switch from intravenous antimicrobials to oral clarithromycin in the treatment of hospitalized patients with community acquired pneumonia [abstract 12.04]. Abstracts of the Third International Conference on Macrolides, Azalides and Streptogramins, Lisbon, Portugal, 1996; 83.
21. Brande P., Vondra V., Vogel F. et al. Sequential therapy with cefuroxime followed cefuroxime axetil in community–acquired pneumonia. Chest 1997; 112: 406–415.
22. Davis R., Bryson H.M. Levofloxacin. A review of its antibacterial activity, pharmacokinetics and therapeutic efficacy. Drugs 1994; 47: 677–700.
23. Chien S.C., Rogge M.C., Gisclon L.G. et al. Pharmacokinetic profile of levofloxacin following once daily 500–milligram oral or intravenous doses. Antimicrob Agents Chemother 1997; 41: 2256–2260.
24. Preston S.L., Drusano G.L., Berman A.L. et al. Levofloxacin population pharmacokinetics and a creation of demographic model for prediction of individual drug clearance in patients with serious community–acquired infection. Antimicrob Agents Chemother 1998; 42: 1098–1104.
25. Lipsky B.A., Baker C.A. Fluoroquinolone toxicity profiles: a review focusing on newer agents. Clin Infect Dis 1999; 28: 352–364.
26. Nau R., Kinzig M., Dreyhaupt T. et al. Kinetics of ofloxacin and its metabolites in cerebrospinal fluid after single intravenous infusion of 400 milligrams of ofloxacin. Antimicrob Agents Chemother 1994; 38: 1849–1853.
27. Fish D.N., Chow A.T. The clinical pharmacokinetics of levofloxacin. Clin Pharmacokinet 1997; 32: 101–119.
28. Owens R., Ambrose P. Clinical use of the fluoroquinolones. Med Clin North Am 2000; 84: 1447–1469.