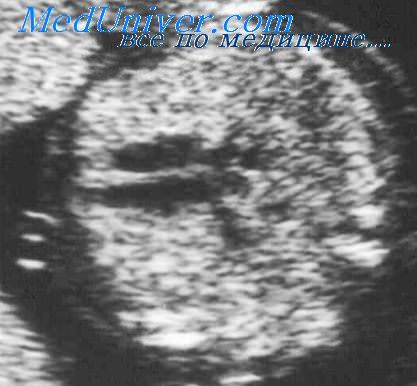
легочный секвестр у плода что это
Легочный секвестр у плода что это
Секвестрация легкого может быть изолированной или входить в состав симптомокомплекса, состоящего из нескольких аномалий. У большинства пациентов наличие этой патологии сопровождается симптоматикой и диагностируется в первые 6 мес жизни, однако в 10% случаев она может обнаруживаться как случайная находка при полном отсутствии каких-либо симптомов.
Во всех 5 наших наблюдениях секвестрация легких была изолированным пороком. У 4 новорожденных, перенесших оперативное вмешательство, послеоперационный период протекал без осложнений, а в отношении пятого ребенка было принято решено ограничиться консервативно-выжидательной тактикой ведения.
Нормальное развитие легких из первичного ларинготрахеального углубления, которое образуется на вентральной поверхности передних отделов первичной кишки в сроки от 5-й до 6-й нед развития эмбриона. Зачаток легкого подвергается многократному ветвлению и дает начало трахеобронхиальному дереву.
Общепринятое теоретическое объяснение происхождения секвестрации легкого было предложено Eppinger и Schawerstein в 1902 г. и позже поддержано многими исследователями.
Согласно их теории зачаток аберрантного легкого развивается из передних отделов первичной кишки эмбриона дистальнее по отношению к расположению нормального трахеобронхиального зачатка. Затем эта масса из полипотентных клеток продолжает мигрировать дистально, сохраняя прежнее кровоснабжение, и образует легочный секвестр.
Будет ли секвестрация интралобарной или экстралобарной, определяется временем формирования аберрантного зачатка. При более раннем развитии, когда первичная передняя кишка еще остается короткой, формируется интралобарный секвестр. На более поздних этапах, при развитии из уже удлинившейся первичной передней, кишки он остается с внешней стороны легкого (экстралобарно) и бывает покрыт собственной плеврой.
Изначально сформированное соединение между аберрантным зачатком и передней кишкой лишается своего кровоснабжения и обычно подвергается инволюции, однако при его персистенции могут возникать коммуникации с желудочно-кишечным трактом.
При микроскопическом исследовании ткань экстралобарного секвестра напоминает строение нормальной легочной ткани, но отличается наличием диффузного расширения структур паренхимы. Отмечается расширение и извитой ход бронхиол, альвеолярных протоков и увеличение просвета альвеол.
Иногда встречаются кисты, выстланные мерцательным цилиндрическим эпителием. В 90% поддиафрагмальные экстралобарные секвестры располагаются в левой половине брюшной полости и в 80% находятся в задней реберно-диафрагмальной борозде, примыкающей к нижним отделам пищевода. Кроме того, в 15-25% случаях в их ткани была выявлена кистозно-аденоматозная мальформация.
При макроскопическом обследовании секвестр, как правило, имеет вид единичной опухоли с наибольшим размером от 3 до 6 см овальной или пирамидальной формы на разрезе. Свое кровоснабжение он обычно получает из крупных артерий (аорта) или межреберных артерий. В частности, было обнаружено, что в 80% случаях питающая артерия секвестра отходит от грудной или брюшной аорты. Венозный отток при экстралобарной секвестрации обычно осуществляется через системы непарной и полунепарной вен.
Кистозный аденоматоз и секвестр легких плода – современный взгляд на проблему. Диагностика и исходы развития
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, Москва, Россия
Проведен анализ 30 публикаций ведущих отечественных и зарубежных исследователей с целью оценки возможности использования эхографии в диагностике и прогнозировании постнатального исхода при кистозно-аденоматозном пороке развития легких (КАПРЛ) и легочной секвестрации (ЛС) у плода. Частота диагностики пороков развития легких значительно возросла за последнее десятилетие и составляет 1:2500–3000 новорожденных. В 30–50% наблюдений отмечается сочетание КАПРЛ и ЛС, что приводит к образованию «гибридных форм». Пренатальная диагностика патологии возможна с 20–21 недели беременности, после 32 недель в большинстве наблюдений отмечается уменьшение размеров или полное исчезновение патологических признаков. Однако проведение в постнатальном периоде КТ с внутривенным контрастированием практически в 100% наблюдений позволяет обнаружить диагностируемую ранее патологию. В 95% наблюдений при наличии указанной патологии легких исход для новорожденного благоприятный. Неблагоприятный исход отмечен в 5–9%, при возникновении водянки плода. Тактика ведения новорожденных с бессимптомным течением заболевания неоднозначна, в подавляющем большинстве случаев проводится резекция пораженного участка легкого или секвестрэктомия.
Кистозно-аденоматозный порок развития легких (КАПРЛ) и легочная секвестрация (ЛС) являются наиболее частыми патологиями легких плода.
Установлено, что КАПРЛ возникает в результате нарушения развития терминальных бронхиол и образования кист различного диаметра [1–4]. Данная патология начинает формироваться на 5-й неделе гестации. Впервые признаки КАПРЛ были описаны Ch’in K., Tang M. в 1949 г. [5], а первое сообщение о пренатальной диагностике этой патологии легких опубликовано в 1980 г. [6, 7].
ЛС – порок развития, при котором часть аномально развитой легочной паренхимы отделяется от неизмененного легкого. При этом образовавшийся секвестр не связан с воздухоносными путями, не имеет функционального кровотока, а его кровоснабжение осуществляется изолированным сосудом, отходящим непосредственно от аорты [3, 4, 8]. Впервые данная патология была описана Rokitansky в 1861 г. [9] и в дальнейшем детализирована Pryce в 1946 г. [10].
За последние 20 лет отношение к данным порокам развития претерпело существенные изменения. Ранее эта внутриутробная патология легких обычно рассматривалась как крайне неблагоприятный для жизни порок развития, в связи с чем рекомендовалось прерывание беременности [6,11–14]. Однако в настоящее время большинство авторов сообщают о высокой выживаемости новорожденных с данной патологией [6, 12, 14–17]. Хорошо известен также феномен самопроизвольного исчезновения ее патологических признаков в конце беременности, что, по мнению ряда авторов, может достигать 50% [1, 12, 15, 16]. Также ранее высказывалось мнение, что смещение средостения большими размерами патологического участка легкого относится к прогностически неблагоприятному признаку. Однако в настоящее время установлено, что смещение средостения наблюдается довольно часто – в 50–60% наблюдений [1, 6, 14, 18] и не оказывает заметного влияния на выживаемость новорожденных. Последнее, как было установлено, связано с тем, что в процессе прогрессирования беременности в 60% случаев происходит уменьшение объема патологической ткани [5, 15, 19].
В настоящее время к единственно прогностически неблагоприятному признаку относят развитие водянки плода, что встречается в 5–10% наблюдений [6, 14–16, 20]. Ряд авторов [6, 15, 16, 21] считают, что проведение внутриутробного лечения при водянке плода позволяет повысить выживаемость новорожденных, тогда как другие придерживаются выжидательной тактики ведения беременности при этом осложнении.
Частота и диагностика
По данным исследований, опубликованных в начале 2000 гг., частота КАПРЛ варьирует в пределах 1 на 11 000–35 000 новорожденных [18]. Stocker L. и соавт. [18], в результате ретроспективного анализа выявления данной патологии за 19-летний период наблюдений в одном из регионов Англии отметили значительное увеличение ее диагностики в пренатальном периоде в последнее десятилетие. Так, по их данным, за период 1994–1998 гг. частота встречаемости составила 1,27 на 10 000 новорожденных, в то время как за период с 2008 по 2012 гг. – 4,15 на 10 000. Это, по их мнению, связано с увеличением разрешающей способности ультразвуковых приборов и повышением опыта оператора [7, 18], что подтверждают также и исследования Walker L. [15]. Так, проведенный им анализ пренатально диагностированных случаев легочной патологии в двух регионах Северной Англии (население более 8 млн человек), показал, что частота встречаемости этой патологии составляет 1:3000. По данным некоторых авторов, частота данной аномалии достигает 1:2000–2500 новорожденных [12, 13, 20].
Частота встречаемости ЛС точно не известна [8]. По данным Walker L. [15], диагноз ЛС был поставлен в 11% случаев (из 228 плодов с патологий легких) на основании выявления отдельного питающего сосуда.
Не отмечено зависимости патологии легких от пола плода. Она встречалась с одинаковой частотой у плодов как мужского, так и женского пола [4, 18, 20].
Сопутствующая патология при КАПРЛ выявляется в 3–18% случаев и наиболее часто сочетается с аномалиями сердечно-сосудистой и мочевыделительной систем [1, 6, 15, 16]. Хромосомная патология встречается редко, она отмечена только у 1% плодов с наличием сочетанных пороков развития [15].
При ЛС сочетанные пороки развития выявляются в 10–22%, из них наиболее часто встречаются врожденная диафрагмальная грыжа, патология сердечно-сосудистой системы, легочная гипоплазия [1].
Классификация кистозного аденоматоза
В настоящее время предложено несколько классификаций КАПРЛ. Согласно классификации Stocker J. [22], которая основана на размере кист и выстилающего их эпителия, выделяют следующие типы этой патологии:
Врожденные пороки развития легких у новорожденных
Общая информация
Краткое описание
Эмбриология. Пороки легких и бронхов могут быть результатом отклонений в развитии на всех стадиях формирования органа: между 3-й и 6-й неделями эмбрионального развития, когда на первичной кишке появляется дивертикул трахей, между 6-й и 16-й неделями, когда происходит быстрое деление бронхов, после 16-й недели, когда начинается активное формирование альвеолярного аппарата.
Врожденная гипоплазия и дисплазия лёгкого (синонимы: Врожденная кистозно-аденоматозная мальформация легкого, КАМЛ). Порок, при котором происходит разрастание терминальных бронхиол с образованием кист разного размера, не затрагивающих альвеолы. Вовлеченная в патологический процесс ткань легкого снабжается воздухом из магистральных дыхательных путей через узкие поры Кона, а кровью из легочной артерии. Практический во всех случаях заболевание поражает одно легкое (80-95%).
Врожденная секвестрация легкого (СЛ) представляет собой порок развития, характеризующийся тем, что часть легочной ткани, обычно ано-мально развитой и представляющей собой кисту или группу кист, оказывается отделенной от нормальных анатомо-физиологических связей (бронхи, легочные артерии) и васкуляризуется артериями большого круга кровообращения отходящими от аорты. Масса нефункционирующей эмбриональной или кистозной ткани, не имеющей связи с функционирующими дыхательными путями и снабжаемой кровью из большого круга кровообращения, носит название секвестра. Частота возникновения этого порока варьирует 0,15 до 6,4% среди всех пороков развития легкого. Почти во всех случаях поражение одностороннее и располагается в нижней доле легкого; около 2/3-слева.
Врожденная киста легкого (ВКЛ) (синонимы: бронхогенная, бронхолегочная, бронхиальная, воздушная бронхогенная и др.) киста легкого является пороком развития одного из мелких бронхов и представляет собой округлое полостное тонкостенное образование, выстланное изнутри эпителием и содержащее слизистую жидкость или воздух.
Диагностика и хирургическое лечение секвестрации легких у детей
Проведен анализ результатов диагностики и лечения 14 больных с секвестрацией легких (СЛ). Описаны анатомические формы и клинико-рентгенологические варианты СЛ, проведен анализ ошибочных диагнозов и трудности дифференциальной диагностики СЛ на догоспитальном и госпитальном этапах. Представлены основные варианты хирургического лечения данного порока развития легких.
Diagnosis and surgical treatment of pulmonary sequestration in children.
Analysis of results of diagnosis and treatment of 14 patients with pulmonary sequestration SL is conducted. Anatomical and clinical-radiologic variants of the SL, the analysis of erroneous diagnoses and the difficulties of differential diagnosis of SL in the pre-admission and hospital stages are described. It is presented the main variants for surgical treatment this of pulmonary malformation of light in our clinic.
Секвестрация легкого (СЛ) относится к редким порокам развития, обусловленным комбинированным нарушением развития всех структур, образующих легкое, при котором участок легочной ткани, частично или полностью отделившийся на ранних стадиях эмбриогенеза, развивается независимо от основного легкого, представляя полностью эктопированную ткань, или располагается внутри функционирующей ткани легкого. СЛ имеет изолированную бронхиальную систему и одну или несколько аномальных артерий, отходящих чаще от аорты или ее ветвей.
Термин «секвестрация» в 1946 году ввел D. Pryce, ему же принадлежит заслуга глубокого изучения этого порока развития легких [11]. Этот термин используется до настоящего времени, хотя не является удачным, так как речь идет о жизнеспособном порочно сформированном участке легкого. В то же время в литературе иногда используются другие названия СЛ [12]. Наиболее удачным названием этой патологии является «сепарация легкого», на что указывает ряд зарубежных и отечественных исследователей [6].
Тератогенный период этого сложного порока относится к ранней эмбриональной фазе. До настоящего времени преимущественное признание имеет теория тракции, выдвинутая еще в 1946 году D. Pryce [11]. Легочная артерия развивается из сосудистого сплетения, связанного с дорсальной и вентральной аортой. В процессе развития легкого связи с аортой прерываются. Если происходит нарушение эмбриогенеза, то нередуцированные ветви первичной аорты отшнуровывают часть первичного легкого в результате тракции и сдавления бронха. В дальнейшем они превращаются в аномальные артерии, кровоснабжающие одну из ветвей развивающегося бронхиального дерева. СЛ может сочетаться с другими пороками развития [2, 5, 10].
Как и большинство исследователей, мы выделяем две анатомические формы СЛ: внутридолевую и внедолевую [1, 10]. При внутридолевой форме секвестрированный участок не имеет своего плеврального листка и находится среди воздушной легочной ткани, но обязательно имеет один или несколько аберрантных сосудов. Связей секвестрированного участка с окружающей легочной тканью через нормальные бронхи, ветви легочной артерии и вены, как правило, нет. При внедолевой форме секвестрированный участок имеет собственную висцеральную плевру и может располагаться в междолевых щелях, средостении, полости перикарда, под диафрагмой, в толще грудной стенки, на шее. Кровоснабжение осуществляется аберрантным сосудом, отходящим чаще от грудной или брюшной аорты. Имеются сообщения о кровоснабжении секвестрированного участка легкого из системы легочной артерии при внедолевой форме [8, 9]. Описано одновременное существование внутри- и внедолевой секвестрации [4, 5]. Частота СЛ среди хронических неспецифических заболеваний легких (ХНЗЛ), по данным разных авторов, составляет 0,8-2% [1, 7].
С 1981 по 2006 год в нашей клинике проходили обследование и лечение 14 детей с СЛ. В возрасте от 5 месяцев до 1 года были 2 пациента, 4-7 лет — 5 детей, 11-15 лет — 7 больных. Среди них было 5 мальчиков и 9 девочек. Половина пациентов попали в поле зрения детских хирургов в возрасте старше 10 лет.
Внутридолевая СЛ локализовалась в зоне базальных сегментов у 8 больных, в одном случае располагалась в верхней доле левого легкого. Внедолевая форма СЛ отмечена у 5 больных — в трех случаях патологическая ткань легкого располагалась над диафрагмой, в одном случае прилегала к передне-боковой поверхности перикарда и в одном случае тесно прилегала к верхней доле в верхнем отделе плевральной полости.
Диагностика СЛ до настоящего времени представляет непростую задачу, особенно на догоспитальном этапе. Больные поступали в клинику с различными диагнозами: деструктивная пневмония (БДЛ), абсцесс легкого, киста легкого, опухоль грудной полости, туберкулез легкого. Часто они безрезультатно получали противовоспалительную терапию, в том числе и у фтизиатров. Использование обычных рентгенологических методов исследования не всегда позволяет однозначно интерпретировать их результаты. В результате у большинства больных окончательный диагноз СЛ был установлен в ходе оперативного вмешательства.
В зависимости от клинической картины больные разделены на две группы: СЛ с отсутствием клинической симптоматики — выявлялась во время рентгенологического обследования, у другой группы больных отмечались признаки хронического воспалительного процесса в легких: продуктивный и непродуктивный кашель, болевой синдром, симптомы интоксикации.
Уточнить диагноз позволяли дополнительные методы исследования — у больных были выполнены различные варианты рентгенологической диагностики: рентгенография грудной клетки (14), томография (2), РКТ (6), бронхография (6), бронхоскопия (12) аортография (2), ангиопульмонография (1). Правильный диагноз до операции был установлен у 2 больных, в других случаях СЛ выявлена при оперативном вмешательстве. Следует отметить, что появление современных высокотехнологичных методов исследования: РКТ, аортографии, ангиопульмонографии значительно расширяет диагностические возможности в определении точного диагноза до оперативного лечения.
Суммируя клинические данные и результаты рентгенологических исследований, мы выделили следующие встретившиеся варианты СЛ:
1. Кистозно-абсцедирующий вариант СЛ (9 больных). Клиническая картина соответствовала хроническому нагноительному процессу в легких. В течение длительного времени больных беспокоил сухой или продуктивный кашель, а в периоды обострения появление гнойной мокроты, умеренных болей в груди на стороне поражения, одышки при физической нагрузке, симптомов интоксикации: слабости, утомляемости, потливости. В 2 случаях прогрессирование воспалительного процесса в легочной ткани привело к плевральным осложнениям. При рентгенологических исследованиях на фоне выраженной деформации сосудисто-бронхиального рисунка визуализировались множественные полостные образования — от 0,5 до нескольких сантиметров в диаметре. Часть полостных образований содержала жидкостный компонент. При бронхологическом исследовании эндоскопическая картина чаще соответствовала катарально-гнойному эндобронхиту на стороне поражения. На бронхограммах бронхи соседних сегментов были оттеснены патологическим образованием и сближены, контрастное вещество в полость кист не проникало. Окончательно определиться с диагнозом до операции позволяет выполнение аортографии.
В качестве примера кистозно-абсцедирующего варианта СЛ приводим следующее наблюдение: Больная Ф., 1 г. 7 мес., неоднократно находилась на стационарном лечении по поводу пневмонии, бронхита по месту жительства. В июне 2004 года с целью дальнейшего обследования и лечения поступила в пульмонологическое отделение ДРКБ, где проведены РКТ, бронхологическое обследование. При УЗИ было обнаружено высокое расположение правой почки. После проведенного обследования был выставлен предварительный диагноз: поликистоз нижней доли правого легкого, высокое расположение правой почки. Для уточнения диагноза 28.09.04 г. проведена аортография, которая подтвердила дистопию (высокое расположение) правой почки с наличием добавочной артерии к нижнему полюсу дистопированной почки. Кроме того, было выявлено, что на уровне ThXII от аорты отходит дополнительная артерия к нижней доле правого легкого диаметром 2,8 мм, с контрастированием нижней доли правого легкого. Клинический диагноз: секвестрация нижней доли правого легкого, дистопия правой почки. 06.10.04 г. операция — торакотомия, удаление нижней доли правого легкого. Послеоперационный период протекал без осложнений, больная выписана в удовлетворительном состоянии. Окончательный диагноз: внутрилегочная секвестрация нижней доли правого легкого, кистозно-абсцедирующая форма. Дистопия правой почки без нарушения уродинамики.
2. Псевдотуморозный вариант СЛ (4 больных). Характеризуется бедностью или отсутствием клинических симптомов. У 2 больных с этим вариантом СЛ патология была выявлена случайно, при рентгенологическом исследовании органов грудной полости. На рентгенограммах гомогенные интенсивные тени с четкими контурами. При бронхографии контрастное вещество в патологическое образование не попадало. Макроскопически СЛ в этом случае была похожа на ателектазированную легочную ткань или ткань селезенки, внутри располагались несколько кистозных полостей. На гистологических срезах препарата стенки кист покрыты цилиндрическим эпителием, легочная ткань по строению соответствует легкому плода. Приводим одно из наших наблюдений: Больной Ш., 5 мес. 19 дн., поступил в ДРКБ на обследование по поводу выявленного при рентгенографии грудной клетки затенения в верхних отделах слева. До этого лечился амбулаторно у педиатра от коклюша. Были проведены УЗИ, РКТ, рентгеноскопия под ЭОП органов грудной полости, которые указывали на наличие объемного образования средостения слева. Предварительные диагнозы: дермоидная киста средостения, легочная секвестрация. 09.11.00 г. операция — торакотомия слева, удаление СЛ. В ходе оперативного вмешательства обнаружены три аномальных сосуда, идущих к дуге аорты. Сосуды перевязаны, пересечены. Произведено удаление секвестрированной легочной ткани. Окончательный диагноз: внедолевая секвестрация слева, псевдотуморозная форма. В послеоперационном периоде осложнений не было, ребенок выписан в удовлетворительном состоянии.
3. Бронхоэктатический вариант СЛ (1 больной), формирующийся в результате вторично возникающего сообщения с бронхиальным деревом вследствие расплавления пограничной легочной ткани на фоне повторных воспалительных реакций в легком. Клиническая картина соответствовала хроническому рецидивирующему воспалительному процессу в легких с присоединением плевральных осложнений.
Из 14 больных, обратившихся в нашу клинику, 13 были оперированы, 1 больная находится под наблюдением. При внутридолевой форме СЛ у 6 пациентов была выполнена операция по удалению пораженной доли легкого, в 2 случаях — удаление сегментов. В случаях внедолевой формы СЛ проведено удаление дополнительной секвестрированной легочной ткани. Во время всех операций проводилось выделение и обработка аномальных сосудов. Анализ наших наблюдений больных с СЛ подтверждает необходимость оперативного лечения этого порока развития легких после его выявления, независимо от выраженности клинических проявлений. Это совпадает с мнением других исследователей [1, 6]. Консервативное лечение может быть использовано для устранения выраженного воспалительного процесса в участке СЛ и возможных гнойных осложнений в легочной ткани и плевральной полости и, таким образом, является этапом предоперационной подготовки.
В ходе операции у большинства больных в плевральной полости имел место спаечный процесс разной степени выраженности. Разъединение и пересечение спаек представляло опасность из-за возможности повреждения дополнительных сосудов, находящихся в этих сращениях. Особый риск в этом аспекте имел место в тех случаях, когда диагноз СЛ у больного до операции как один из вариантов интерпретации клинико-рентгенологических данных не предполагался. Пересечение нелигированного аберрантного сосуда приводит к массивному кровотечению и может закончиться смертью больного, на что указывают ряд авторов [1, 3]. Таким образом, мы считаем, что наличие триады симптомов, характерных для СЛ, — локализация в зоне базальных сегментов кистовидного образования с обедненным легочным рисунком вокруг и отсутствие связи с бронхиальным деревом (отсутствие контрастированных бронхов в зоне затемнения и вокруг нее, по данным бронхографии) — является показанием для проведения РКТ в сосудистом режиме и аортографии (АГ) с целью уточнения диагноза. Выполнение АГ, кроме подтверждения диагноза СЛ, позволяет судить о количестве аномальных сосудов, их топографии, что сводит риск выполнения операции к минимуму. У обследованных и лечившихся у нас больных секвестрированная ткань легкого получала кровоснабжение дополнительными сосудами, отходившими от дуги аорты, грудного и брюшного ее отделов. Количество аберрантных сосудов — от 1 до 3, их диаметр — от 2 до 8 мм. Мы встретили следующие варианты отхождения аномальных сосудов от аорты: дуга аорты — у 1 больного, грудной и брюшной отдел аорты — у 7 и 5 пациентов соответственно, в 1 случае сосуды отходили от грудного и брюшного отделов аорты.
Учитывая различные варианты сосудистой архитектоники, необходимо особенно тщательно перевязывать добавочные сосуды, идущие к секвестрированной ткани легкого. При хирургических манипуляциях по поводу кисты или гнойных процессах легочной ткани необходимо помнить о возможном существовании СЛ и наличии дополнительных сосудов к ней.
Отдаленные результаты операций, выполненных у проанализированных больных, хорошие, прослежены у всех пациентов.
1. Своевременная ранняя диагностика СЛ вызывает определенные трудности из-за редкости патологии, отсутствия характерных симптомов и настороженности по врожденной патологии легких, сложности инструментальных, рентгенологических исследований и трудности их однозначной интерпретации.
2. Основным методом диагностики является рентгенологический, включающий в себя обзорную рентгенографию, томографию, РКТ в сосудистом режиме, бронхологическое обследование и контрастное исследование сосудов (аортография).
3. Триада симптомов, которая позволяет заподозрить СЛ, это: локализация в зоне базальных сегментов, кистовидное образование с обедненным легочным рисунком вокруг и данные бронхографии: отсутствие связи с бронхиальным деревом — контрастированных бронхов в зоне затемнения и вокруг нее нет. Обнаружение при аортографии аномального аберрантного сосуда позволяет окончательно определиться с диагнозом СЛ.
4. Важна своевременная ранняя диагностика порока развития до развития осложнений.
5. Оперативное вмешательство является основным методом лечения данного порока развития легких и дает хороший результат.
П.Н. Гребнев, А.Ю. Осипов
Казанский государственный медицинский университет
Детская республиканская клиническая больница, г. Казань
Гребнев Павел Николаевич — доктор медицинских наук, профессор кафедры детской хирургии
1. Бородулин Б.Е., Гелашвили П.А., Бородулина Е.А., Подсевалова Н.В. // Пороки развития и наследственные заболевания легких. — Учебное пособие. — Самара, 2003.
2. Гринберг Л.М., Худяков Л.М., Мезенцев И.А. // Вест. рентг. и радиол. — 1990. — № 4. — С. 16-20.
3. Дужий И.Д., Тертышный Н.Г. // Клинич. хир. — 1989. — № 10. — С. 35-36.
4. Картавова В.А., Левашев Ю.Н., Некласов Ю.Ф. и др. // Груд. хир. — 1984. — № 5. — С. 31-36.
5. Коновалов Ю.Н. // Труды ленинградского научного общества патологоанатомов. — 1974. — Т. 15. — С. 149-151.
6. Королев Б.А., Шахов Б.Е., Павлунин А.В. // Аномалии и пороки развития легких. — НГМА. — Н. Новгород, 2000.
7. Рокицкий М.Р., Гребнев П.Н., Осипов А.Ю. // Детская хирургия — 1998. — № 1. — С. 54-57.
8. Феофилов Г.Л., Хроменков И.Х. // Сов. мед. — 1970. — № 8. — С. 147-148.
9. Феофилов Г.Л. // Груд. хир. — 1977. — № 3. — С. 68-72.