лансопразол или рабепразол что лучше
Ингибиторы протонной помпы
Это препараты, используемые с недавнего времени для успешного лечения желудочно-кишечных болезней, и блокирующие в той или иной степени образование и выделение клетками слизистой желудка соляной кислоты. На сегодня зарегистрированы 6 поколений этих препаратов.
Ингибиторы протонной помпы и их поколения
Их поочередное появление в фармацевтической практике согласуется с их поколением:
Стандартные дозы ингибиторов протонной помпы лицензированы для лечения эрозивного эзофагита в течение 4-8 недель, а двойная доза – для лечения рефрактерных пациентов, которые уже были ранее пролечены стандартными дозами, но не имели улучшения. Стандартные дозы назначаются однократно в день, двойная доза – дважды в сутки (В. Д. Пасечников и др.).
В США рецептурные ингибиторы протонной помпы (эзомепразол, декслансопразол, омепразол, лансопразол, пантопразол и рабепразол) разрешены для лечения таких заболеваний, как гастроэзофагеальная рефлюксная болезнь, язвы желудка и двенадцатиперстной кишки, эзофагит. Безрецептурные (over-the-counter), с пониженной дозой ингибиторы протонной помпы (омепразол и лансопразол), используются для лечения частой изжоги.
Из своей многообразности этих препаратов пациенту нужно знать, что чем выше поколение, тем лучше препарат по очистке, длительности и силе действия, уменьшению побочных эффектов и т.д. Но не все препараты одинаково действуют на всех. Есть незначительная доля людей, которые не могут правильно метаболизировать те или иные препараты, и они им не подходят. Необходимо консультироваться с гастроэнтерологами и не заниматься самолечением.
Выбор ингибитора протонной помпы с позиций эффективности и безопасности у конкретного пациента

Ингибиторы протонной помпы — разнообразный класс препаратов с уникальными свойствами кислотной супрессии. Целью работы было представить терапевтические преимущества рабепразола и пантопразола в клинической практике. Многочисленные исследования продемонстр
Abstract. Proton pump inhibitors are a diverse class of drugs with unique acid suppression properties. The aim of the work was to present the therapeutic benefits of rabeprazole and pantoprazole in clinical practice. Numerous studies have demonstrated the high effectiveness of proton pump inhibitors and the relative safety of taking these drugs. However, it is necessary to increase the awareness of doctors and pharmacists regarding the possibility of complications during treatment with proton pump inhibitors in a polymorbid patient. The choice of proton pump inhibitors should be based on the clinical situation, concomitant pathology and therapy, the presence of risk factors in the patient, the speed and stability of the effect of the drug. Rabeprazole is converted from prodrug to drug faster than other drugs, and thus creates a greater gradient of prodrug concentration on the membrane secretory tubules. The pharmacodynamics of rabeprazole does not depend on gene polymorphism; in this regard, there is no need for dose adjustment in fast metabolizers. In addition, a distinctive feature of rabeprazole is the ability to more stimulate the production of mucin, thereby providing an additional cytoprotective effect. A feature of the metabolism of pantoprazole is that in addition to binding to cysteine 813, there is an additional connection with cysteine 822, which ensures the restoration of acid secretion only the synthesis of a new protein and, as a result, the longest lasting effect of the drug. High pH selectivity characterizes the low probability of inhibition of proton pumps in tissues with a less acidic pH, i.e. determines the specificity of action only in the parietal cells of the stomach and the greatest safety of long-term use in patients with comorbid pathology. Among all proton pump inhibitors, pantoprazole and rabeprazole have the lowest affinity for the cytochrome P450 system and lower inhibitory activity against CYP2C19, demonstrating a minimal risk of drug interactions.
Резюме. Ингибиторы протонной помпы — разнообразный класс препаратов с уникальными свойствами кислотной супрессии. Целью работы было представить терапевтические преимущества рабепразола и пантопразола в клинической практике. Многочисленные исследования продемонстрировали высокую эффективность ингибиторов протонной помпы и относительную безопасность приема этих препаратов. Однако необходимо повышение осведомленности врачей и фармацевтов относительно возможности осложнений на фоне терапии ингибиторами протонной помпы у полиморбидного пациента. Выбор ингибиторов протонной помпы должен основываться в зависимости от клинической ситуации, сопутствующей патологии и терапии, наличия факторов риска у пациента, скорости и стабильности эффекта препарата. Рабепразол быстрее других препаратов превращается из пролекарства в лекарство, и таким образом создается больший градиент концентраций пролекарства на мембране секреторных канальцев. Фармакодинамика рабепразола не зависит от генного полиморфизма, в этой связи нет необходимости коррекции дозы у быстрых метаболизаторов. Помимо этого, отличительной особенностью рабепразола является способность в большей степени стимулировать выработку муцина, оказывая тем самым дополнительное цитопротективное действие.
Особенностью метаболизма пантопразола является то, что, помимо связывания с цистеином 813, имеется дополнительная связь с цистеином 822, что обеспечивает восстановление секреции кислоты только после синтеза нового белка и, как следствие, наиболее продолжительный эффект препарата. Высокая рН-селективность характеризует низкую вероятность ингибирования протонных помп в тканях с менее кислой pH, т. е. обусловливает специфичность действия только в париетальных клетках желудка и наибольшую безопасность длительного приема у пациентов с коморбидной патологией.
Среди всех ингибиторов протонной помпы самое низкое сродство к системе цитохрома Р450 и более низкую ингибирующую активность в отношении CYP2C19 имеют пантопразол и рабепразол, демонстрируя минимальный риск лекарственных взаимодействий.
Необходимость в подавлении кислотной продукции желудка возникает при целом ряде широко распространенных заболеваний. Подавление желудочной секреции стало настолько успешным, что оперативные вмешательства при некоторых заболеваниях, таких как гастроэзофагеальная рефлюксная болезнь и язвенная болезнь, практически перестали применяться. В настоящее время ингибиторы протонной помпы (ИПП) являются наиболее эффективным средством базисной кислотосупрессивной терапии, и спектр показаний к их назначению с каждым годом расширяется [1].
Первые ИПП были разработаны в период с 1980 по 1990 г. [1]. В настоящее время класс препаратов включает такие формы, как омепразол, лансопразол, рабепразол, пантопразол, эзомепразол, декслансопразол, дексрабепразол, тенатопразол*.
Эффективное терапевтическое действие каждой отдельной формы ИПП достигается посредством использования различных стратегий с учетом особенностей фармакокинетики и фармакодинамики конкретного ИПП и клинической ситуации.
Целью данного сообщения являются терапевтические аспекты использования рабепразола и пантопразола в клинической практике.
Показаниями для терапии ИПП в настоящее время являются [1]:
Фармакотерапия ИПП является успешной при условии, что удается поддерживать целевые значения рН на протяжении определенного периода времени. В 1990 г. W. Burget и соавт. впервые опубликовали данные метаанализа более 300 работ, на основании которого пришли к заключению, что язвы желудка и двенадцатиперстной кишки рубцуются почти во всех случаях, если в течение суток удается поддерживать рН внутрижелудочного содержимого > 3 около 18 часов в сутки (правило Бурже) [2].
Дальнейшие исследования позволили определить степень повышения значений рН и продолжительности этого повышения в качестве прогностического фактора при лечении других кислотозависимых заболеваний. Так, оптимальным для заживления рефлюкс-эзофагита является значение рН > 4. Эрадикация инфекции Helycobacter рylori (H. pylori) успешна при значениях интрагастрального рН > 5 (создаются худшие условия для бактерии и лучшие для реализации эффекта антибиотиков).
Современные ингибиторы протонной помпы позволяют добиться оптимальных значений рН (> 3) даже при однократном приеме стандартной дозы, для быстрых метаболизаторов требуется увеличение кратности приема препаратов первого поколения (два раза в день стандартной дозы омепразола или лансопразола) [2].
Все ИПП являются также пролекарствами, но при попадании в кислую среду способны превращаться из пролекарства в лекарство, представляющее собой циклический сульфенамид [5, 6].
Основные фармакокинетические характеристики ингибиторов протонного насоса и эффективность их действия включают: абсорбцию из кишечника с проникновением в системный кровоток; концентрирование в секреторных канальцах париетальных клеток; связывание протона в кислой среде канальцев; превращение из пролекарства в лекарство (активация ИПП под действием кислоты); ковалентное связывание с SH-группами протонного насоса и его ингибирование [5, 6].
Механизм действия всех упомянутых выше ИПП на протонный насос примерно одинаков. Различия заключаются в скорости метаболизма этих соединений.
Для ИПП среди фармакокинетических параметров, от которых зависит величина расчетного параметра AUC, наибольшее значение имеет Cmax (максимальная концентрация лекарственного препарата в крови), коррелирующая с количеством заблокированных молекул протонной помпы в секреторных канальцах париетальных клеток на максимуме концентрации препарата. T1/2 — время удержания препарата в крови имеет меньшее значение, так как ИПП — препараты с коротким периодом полувыведения и скорость их выведения намного превышает скорость замещения заблокированных молекул протонной помпы вновь синтезированными активными молекулами энзима [5, 6].
ИПП действуют на протонный насос не со стороны крови или внеклеточной жидкости, а со стороны секреторных канальцев, и эффект зависит не столько от концентрации ИПП (т. е. пролекарства) в крови, сколько от концентрации активной формы, т. е. соответствующего циклического сульфенамида в секреторных канальцах [5, 6].
Концентрация ИПП в секреторных канальцах в свою очередь зависит не только от фармакокинетических параметров, но и от скорости превращения пролекарства в лекарство: по мере того как происходит такое превращение, может увеличиваться скорость накопления ИПП в секреторных канальцах. Таким образом, чем быстрее происходит превращение пролекарства в лекарство, тем больше лекарства может накопиться в секреторных канальцах, тем большее количество молекул насоса будет заблокировано. А ингибиторный эффект сохраняется длительное время после снижения концентрации ИПП в плазме крови [5, 6].
Скорость накопления ИПП в канальцах париетальных клеток для разных ИПП разная и определяется показателем константы ионизации (диссоциации) — рКа: чем больше константа, тем больше скорость трансформации ИПП в активную форму. Самый высокий показатель рКа среди ИПП у рабепразола — 4,8. Рабепразол в системе in vitro обеспечивает 80-процентное ингибирование уже за 5 минут (рис. 2) [5, 6].
Рабепразол быстрее других препаратов превращается из пролекарства в лекарство, и таким образом создается больший градиент концентраций пролекарства на мембране секреторных канальцев [7, 8].
Помимо этого отличительной особенностью рабепразола является способность в большей степени стимулировать выработку муцина (более чем в 5 раз в течение 8 недель) и тем самым восстанавливать защитный барьер желудка и пищевода, оказывая дополнительное цитопротективное действие [7, 8].
Продолжительность ингибирования секреции
Восстановление секреции кислоты после ингибирования ИПП может быть обусловлено синтезом de novo белка насоса и/или восстановлением дисульфида и реактивацией ингибированного насоса. Принимая во внимание, что все ИПП связываются с цистеином 813, пантопразол дополнительно связывается с цистеином 822, более глубоким в мембранном домене TM6. Восстановление секреции кислоты после пантопразола полностью зависит от синтеза нового белка. У пантопразола этот период наиболее продолжительный и составляет около 46 часов [5, 6].
Особенности взаимодействия с системой цитохрома Р450
При применении ИПП, метаболизирующихся системой цитохрома Р450, могут остро вставать вопросы конкурентного лекарственного взаимодействия с препаратами, метаболизм которых также осуществляется с помощью указанной системы. Для всех ИПП, исключая рабепразол и пантопразол, ингибиторный эффект в отношении CYP2C19 достаточно велик [5, 6].
В 2009 и 2010 г. Управление по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drug Adminstration of the United States, FDA) [22] и Европейское агентство по оценке лекарственных средств (European Medicines Agency, ЕМА) [23] не рекомендовали использовать клопидогрел совместно с такими препаратами, как омепразол и эзомепразол.
В отличие от других ИПП, превращения рабепразола и пантопразола происходят помимо системы цитохрома по «неферментативному пути», в ходе которого образуется тиоэфир рабепразола, также обладающий антисекреторной активностью, а метаболизм пантопразола осуществляется с помощью сульфотрансферазы цитозоля [5, 6].
Таким образом, среди всех ИПП самое низкое сродство к системе цитохрома Р450 с более низкой ингибирующей активностью в отношении CYP2C19 проявляют пантопразол и рабепразол, демонстрируя минимальный риск лекарственных взаимодействий.
Кроме того, следует подчеркнуть, что фармакодинамика рабепразола не зависит от генного полиморфизма, в этой связи нет необходимости коррекции дозы у быстрых метаболизаторов [5, 6].
Вопросы безопасности терапии ИПП
Многочисленные контролируемые рандомизированные исследования продемонстрировали высокую эффективность ИПП и их относительную безопасность (количество побочных эффектов не превышает 3%) [9, 10].
Однако следует обсудить вопрос о безопасности длительной терапии ИПП. В настоящее время имеются данные о возможном развитии мальабсорбции и нарушении всасывания микронутриентов. Получены данные об увеличении риска развития гипомагниемии в 1,54 раза [9]. Показано, что терапия ИПП в течение 2 и более лет может приводить к дефициту витамина В12 (ОШ — 1,65; 95% ДИ 1,58–1,73) [10]. Подтверждается более высокий риск переломов, особенно у пожилых лиц на фоне длительной терапии ИПП, в связи с чем перед назначением ИПП пожилым пациентам необходимо тщательно взвешивать соотношение риска и пользы [11].
Обнаружена связь между длительностью приема ИПП и риском развития синдрома избыточного бактериального роста в кишечнике (в 3 раза при приеме более 13 месяцев) [12], с повышенным риском развития коллагенового колита (коэффициент риска — 4,5) [13]. Некоторые обсервационные исследования показали, что ИПП повышают риск развития рака желудка у пациентов, инфицированных H. pylori, тогда как другие представляют противоречивые результаты [14–16]. Дополнительные исследования будут необходимы, чтобы определить, повышают ли ИПП риск развития рака желудка у пациентов с инфекцией H. pylori, а также у тех, кто успешно прошел эрадикацию.
При длительном приеме ИПП способны вызвать гиперплазию фундальных желез [14–16].
Опубликованные результаты крупного метаанализа, включавшего в общей сложности 785 пациентов, показали, что длительный прием ИПП для поддержания ремиссии у пациентов с гастроэзофагеальной рефлюксной болезнью не сопровождается увеличением частоты атрофических изменений в слизистой оболочке желудка, а также гиперплазией энтерохромаффиноподобных клеток по крайней мере в течение 3 лет непрерывного лечения по результатам рандомизированных клинических исследований [17].
Приведенные результаты отдельных исследований свидетельствуют о нефротоксичности ИПП, проявляющейся развитием острого тубулоинтерстициального нефрита (ОТИН), хронической болезни почек [18, 19]. В связи с этим при назначении ИПП следует учитывать наличие факторов риска ОТИН, включающих пожилой возраст, сердечную недостаточность, хроническую болезнь почек, сахарный диабет, цирроз печени, прием диуретиков. Повышение уровня сывороточного креатинина, снижение скорости клубочковой фильтрации, электролитные нарушения (гиперкалиемия, гипонатриемия), протеинурия, лейкоцитурия, гематурия, цилиндрурия, эозинофилурия позволяют с высокой вероятностью диагностировать ОТИН [18, 19].
В недавно проведенном исследовании показано, что терапия ИПП является независимым фактором риска инфаркта миокарда: после 120 дней приема ИПП риск увеличивался в 1,58 раза [18, 19].
При необходимости назначения ИПП пациентам с высоким риском гастроинтестинальных кровотечений на фоне терапии антиагрегантами и антикоагулянтами наиболее безопасной считается терапия ИПП, имеющими самую низкую аффинность к CYP2C19 с минимальным риском лекарственных взаимодействий (пантопразол или рабепразол) [20].
Частота назначения ИПП и длительность применения послужили основанием для проведения крупномасштабных популяционных исследований. Самое длительное исследование безопасности имеется у пантопразола (15 лет непрерывного приема препарата) [21]. Отсутствие клинически значимых нежелательных явлений в течение длительного периода лечения обусловлено, по-видимому, высокой pH-селективностью молекулы пантопразола. Высокая рН-селективность характеризует низкую вероятность ингибирования протонных помп в тканях с менее кислой pH, т. е. обусловливает специфичность действия только в париетальных клетках желудка и наибольшую безопасность длительного приема у пациентов с коморбидной патологией.
Таким образом, необходимо повышение осведомленности врачей и фармацевтов относительно возможности осложнений на фоне терапии ИПП, что позволит снизить частоту их развития и улучшить прогноз. Выбор ИПП должен зависеть от клинической ситуации, сопутствующей патологии и терапии, наличия факторов риска у пациента, скорости и стабильности эффекта ИПП.
Литература/References
* Препарат в РФ не зарегистрирован [1].
* ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
** ФГБОУ ВО Астраханский ГМУ Минздрава России, Астрахань, Россия
*** ФГБОУ ВО СГУ, Сочи, Россия
Выбор ингибитора протонной помпы с позиций эффективности и безопасности у конкретного пациента/ Е. А. Лялюкова, Ю. В. Терещенко, Е. Н. Чернышева, А. В. Лялюков
Для цитирования: Лечащий врач № 8/2020; Номера страниц в выпуске: 6-10
Теги: кислотная супрессия, факторы риска, желудок
Сравнение эффективности влияния однократного и повторного приема лансопразола и рабепразола на внутрижелудочное рН в течение 24 часов у здоровых добровольцев
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Введение Способность антисекреторных препаратов уменьшать клинические проявления и излечивать язвенную болезнь и эрозии пищевода зависит от их активности в подавлении желудочной секреции, и, таким образом, в возможности повышать внутрижелудочный pH–фактор выше критических порогов. Критический порог pH–фактора для заживления открытой язвы составляет более 4 [1–3].
Способность антисекреторных препаратов уменьшать клинические проявления и излечивать язвенную болезнь и эрозии пищевода зависит от их активности в подавлении желудочной секреции, и, таким образом, в возможности повышать внутрижелудочный pH–фактор выше критических порогов. Критический порог pH–фактора для заживления открытой язвы составляет более 4 [1–3].
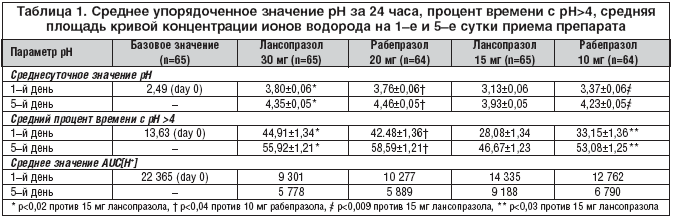
Ингибиторы протонной помпы (ИПП) являются на сегодняшний день самыми эффективными препаратами для поддержания внутрижелудочного pH–фактора >4. Все препараты данной группы имеют одинаковый механизм действия, однако они различаются по скорости начала действия и степени подавления кислотности вследствие различий в биодоступности и дозе [4–11]. Например, омепразол, первый ИПП, одобренный в США, имеет 40%–ую биодоступность после первого приема. Биодоступность повышается до 60% к седьмой дозе и приводит к стабильному уровню внутрижелудочного pH–фактора после повторных введений. В отличие от него у лансопразола биодоступность составляет 80–90% после начальной дозы. Рабепразол также обладает высокой биодоступностью после начальной дозы. В исследовании на здоровых добровольцах Helicobacter pylori–негативных, было выявлено, что внутрижелудочный pH–фактор в течение суток с момента начала приема был значительно выше после единственной дозы рабепразола 20 мг, чем при приеме омепразола 20 мг [12]. До настоящего времени лишь в небольшом количестве исследований сравнивалась эффективность и время начала действия рабепразола и лансопразола в отношении внутрижелудочного pH–фактора. Гарднер с соавт. предположили, что интегральная кислотность (то есть область, ограниченная кривой «концентрация ионов водорода – время», AUC [H+]) – более информативный показатель, чем процент времени со значением pH–фактора> 4, и поэтому может быть более достоверной мерой оценки фармакологических параметров [13,14]. Исходя из этого мы включили AUC [H+] в исследование, но представили эти данные только в заключении.
Материалы и методы
Исследование проводилось в Charterhouse Clinical Research Unit, Stamford Hospital, Ravenscourt Park, и Hammersmith Medicines Research, Central Middlesex Hospital, Park Royal, London (Великобритания). Все этапы исследования были одобрены Этическим комитетом. Каждый участник подписал информированное согласие.
Участники исследования
Участниками были здоровые мужчинаы и женщины, в возрасте 18–45 лет, не курящие в течение, по крайней мере, 6 месяцев, и с массой тела, близкой к идеальной (рассчитывалась по методике Metropolitan height and weight table for men and women, 1983 ) [15]. Здоровье всех участников оценивалось как хорошее (заключение делалось на основе анамнеза, осмотра, анализов крови, мочи, электрокардиографии, определении уровня гастрина). Обследование на наличие Helicobacter pylori не проводилось.
Дизайн исследования
Данное исследование является открытым, перекрестным, рандомизированным и двухцентровым. В исследование было включено 72 здоровых добровольца. Каждый участник получал препараты четырьмя курсами по 5 дней с двухнедельным перерывом. 24–часовой мониторинг рН проводился на первые и на пятые сутки приема препаратов. После вечернего воздержания от пищи каждому участнику давали per os лансопразол 15 мг, лансопразол 30 мг, рабепразол 10 мг или рабепразол 20 мг с 180 мл воды, приблизительно за 1?час до завтрака в 1–5–й дни. Порядок получения препаратов был рандомизирован с помощью системы SAS programм (SAS Institute, Cary, NC, USA) так, что каждый участник прошел все четыре режима лечения в рамках исследования.
Внутрижелудочный рН измеряли вечером перед началом очередного периода введения препарата (чтобы определить значение базового pH–фактора) и вечером спустя 24 часа после получения последней дозы препарата. Участники получали стандартную пищу приблизительно в 10:00 (спустя 1 час после введения препарата) и примерно в 13:00 и 18:00. Стандартную пищу давали в соответствующее время в течение всего периода исследования. Сок грейпфрута, ксантин– и кофеинсодержащие пищевые продукты и напитки были запрещены.
Измерение внутрижелудочного pH–фактора
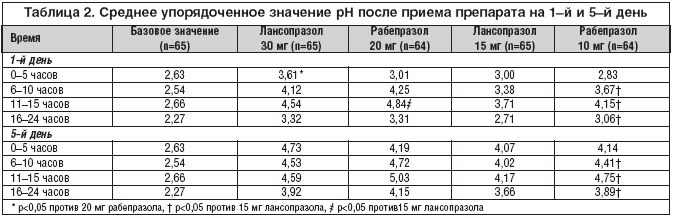
Колебания внутрижелудочного pH–фактора в течение суток регистрировались в день начала исследования и затем на 1–е и 5–е сутки каждого периода исследования, с использованием системы Flexilog 2010 или 2020 (Oakfield Instruments, Oxon, Великобритания). Каждая проба калибровалась стандартными буферными средами с рН 1,4 и 7. Для суточного мониторинга использовалась назогастральная интубация. Все 24–часовые измерения pH–фактора начались в 9:00 утра. На первые и пятые сутки измерение проводилось до введения препарата. При суточном мониторинге внутрижелудочный рН регистрировался каждые 6?секунд. Полученные данные обрабатывались с помощью программного обеспечения Flexisoft II.
Интегральный показатель кислотности рассчитывался по формуле [H+] = (10–pH • 1000) ммоль/л [13,14].
Фармакокинетическая оценка
Для определения концентрации рабепразола и лансопразола в плазме в течение первых и пятых суток исследования забиралась венозная кровь объемом 5 мл (спустя 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 6.0, 8.0, 10.0, 12.0 и 24.0 часа после приема препарата). Образцы помещались в лед и центрифугировались при температуре 5°C в течение 30 минут. Плазма отделялась и замораживалась при –70°C, после чего выполнялось хроматографическое тандемное масс–спектрографическое исследование (MDS Pharma Services, Lincoln, NE, USA). Лансопразол и рабепразол извлекались из плазмы с помощью этилового эфира и метиленхлорида. Растворитель связывался с азотом и восстанавливался ацетонитрилом. Кривые калибровки концентрации ранжировались от 5 до 1200 нг/мл для лансопразола и от 4,71 до 377 нг/мл для рабепразола. Коэффициент корреляции составил 0,9940. После калибровки отбрасывались крайне низкие значения. Образцы с крайне высокой концентрацией растворяли в плазме и оценивали повторно.
Фармакокинетические параметры
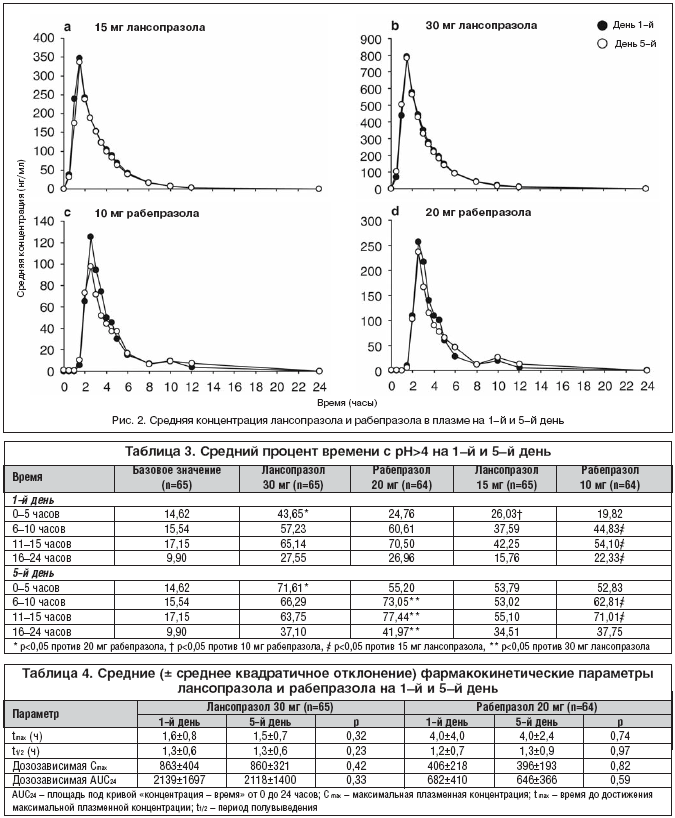
Фармакокинетические параметры лансопразола и рабепразола определялись на 1–е и 5–е сутки. Максимальная плазменная концентрация (Cmax) и время к Cmax (tmax) были взяты непосредственно из расчетных плазменных концентраций. Дозозависимая Cmax подсчитывалась после введения препарата.
Площадь под кривой плазменной концентрации разового приема препарата от нулевого времени до 24 часов (AUC24) была вычислена с помощью линейного трапециевидного уравнения. Дозозависимая концентрация в течение суток подсчитывалась после введения лансопразола или рабепразола. Конечное значение константы элиминации (b) было получено из графика линейной логарифмической регрессии измеримых концентраций против времени в логарифмической терминальной фазе кривой. Конечное время полужизни (полувыведения) t1/2 препарата рассчитывалось по формуле ln(2)/b.
Статистический анализ
Для каждого пациента рассчитывались следующие показатели: среднесуточное значение и интервал колебаний рН, среднее значение AUC[H+], процент времени с рН>4.
Среднесуточные значения рН желудка сравнивались с помощью перекрестной дисперсной системы анализа вариаций (ANOVA), которая включала влияние режима, времени, последовательности лечения и индивидуальных особенностей. Индивидуальное влияние было случайным. Все остальные эффекты были фиксированными. В рамках системы ANOVA использовалось четыре режима сравненеия. Для AUC [H+] при статистическом анализе использовалась такая же модель ANOVA. Все тесты рассчитывались со статистической погрешностью р 4 между лансопразолом 30 мг и рабепразолом 20 мг не прослеживается, как на 1–е, так и на 5–е сутки приема препарата.
Вместе с тем среднесуточное внутрижелудочное рН, как и процент времени с рH > 4, было значительно больше на 1–й и 5–й день после приема рабепразола 10 мг, чем после лансопразола 15 мг (p?0,009 и p 4 были достоверно выше и AUC?[H+] достоверно ниже после приема 30 мг лансопразола, чем 15 мг лансопразола (p 4 в первые 5 часов после приема препаратов на 1–й и 5–й дни было значимо выше (р 4 было достоверно значительно выше, а среднее значение AUC [H+] значительно ниже в течение первых 5 часов после приема 30 мг лансопразола по сравнению с 20 мг рабепразола. Такое различие, возможно, отражает фармакокинетические свойства двух препаратов: tmax после приема 30 мг лансопразола (1,6 ч) было меньше, чем после приема 20 мг рабепразола (4,0 ч) как на 1–й, так и на 5–й день (табл.?4). Эти результаты свидетельствуют о более медленном растворении таблеток рабепразола в желудке по сравнению с быстрым высвобождением покрытых кишечнорастворимой оболочкой микросфер лансопразола. Такое более быстрое начало действия вряд ли будет клинически значимо при длительном приеме, однако может являться преимуществом при начале терапии у пациентов с постоянной изжогой. Хотя, такое начало действия препарата возможно не столь быстрое, чтобы использовать его «по требованию».
Недостаток данного исследования заключается в том, что все параметры оценивались на здоровых добровольцах, а не на пациентах, страдающих различными заболеваниями верхних отделов желудочно–кишечного тракта. Несомненно, что у больных результаты будут отличаться, но проведение подобных исследований среди пациентов вряд ли осуществимо. Более того, здоровые добровольцы – это именно та группа, в которой целесообразно проведение исследования фармакокинетики и фармакодинамики желудочных антисекреторных препаратов, поскольку физиология секреции кислоты у них не отличается от таковой пациентов, страдающих гастроэзофагеальной рефлюксной болезнью. Хотя у пациентов с гастроэзофагеальным рефлюксом повышен кислотность, это возникает больше из–за аномальной работы сфинктера, а не вследствие различий в секреции кислоты [16]
Вторым недостатком этого исследования является то, что не производилась оценка наличия Helicobacter pylori. Однако перекрестный дизайн исследования сводит к минимуму значимость Helicobacter pylori.
Активность лансопразола и рабепразола в отношении увеличения рН, показанная в этом исследовании в 1–й день, сопоставима с данными других работ, в которых оценивались ИПП (перекрестное, двойное слепое рандомизированное исследование, сравнивающее однократные дозы ИПП лансопразола 30 мг, рабепразола 20 мг, пантопразола 40 мг, омепразола 20 мг, формы омепразола с множеством ячеек 20 мг и плацебо среди здоровых волонтеров [17]). В данном исследовании лансопразол и рабепразол показали наибольший эффект в отношении снижения рН.
Пантофликова Д. с соавт. сообщили о существенном преимуществе рабепразола, однако отличия в дизайне исследования затрудняют возможность сравнения [18].
В целом полученные данные по интегральной кислотности (AUC [H+]) вполне сопоставимы с результатами работ, основывавшихся на измерении среднего рН. Предположение Гарднера и других исследователей [13,14], что интегральная кислотность может быть более чувствительным фармакодинамическим показателем, чем процент времени с рН>4, не было подтверждено в данной работе. Именно последний показатель при сравнении различных схем лечения постоянно был более значимым. Например, среднее значение AUC [H+] показало достоверную разницу между 20 мг и 10 мг рабепразола только в 4 из 10 возможных случаев. А такой показатель, как средний процент времени с рН>4, выявил достоверное различие в 7 из 10 возможных случаев. Также наблюдалось значимое различие между процентом времени с рН>4 после приема 30 мг лансопразола и 20 мг рабепразола в 5 из 10 возможных случаев, в то время как различие по интегральному показателю кислотности было достоверно лишь в 2 случаях из 10. Показано, что результаты исследований по значению рН и проценту времени с рН>4 сходны. Однако при наличии значимых различий в лечении фармакодинамические показатели, связанные как с рН, так и с AUC [H+], были сопоставимы между 30 и 15 мг лансопразола практически при всех сравнениях (табл. 1). Поскольку AUC?[H+] и рН – производные друг друга, большая сила рН (по сравнению AUC [H+]) при выявлении различий между разными схемами лечения, является лишь результатом изменения распределения информации.
Заключение
Антисекреторный эффект как лансопразола, так и рабепразола был дозозависимым. Эффект лансопразола был больше (по сравнению с рабепразолом) в течение первых пяти часов после первой и повторной доз, но меньше, начиная с 11–го часа после приема. Более быстрое начало действия лансопразола не столь важно при длительном лечении, но может давать преимущество перед рабепразолом в начале симптоматического лечения. Кроме того, по результатам исследования оказалось, что оценка эффективности разных режимов антисекреторной терапии по проценту времени pH–фактора> 4 достовернее, чем по интегральному показателю кислотности.
Реферат подготовлен М.А. Черкашиным по материалам статьи Keith G. Tolman, Jorg Taubel, Steven Warrington et al. «Comparison of the Effects of Single and Repeated Oral Doses of Lansoprazole and Rabeprazole on Ambulatory 24–hour Intragastric pH in Healthy Volunteers» Clin Drug Invest 2006; 26(1): pp 21–28.
Литература
1. Burget DW, Stephen G, Chiverton SG, et al. Is there an optimal degree of acid suppression for healing of duodenal ulcer? A model of the relationship between ulcer healing and acid suppression. Gastroenterology 1990; 99: 345–51
2. Bell NJ, Burget D, Howden C, et al. Appropriate acid suppression for the management of gastro–oesophageal reflux disease. Digestion 1993; 51 Suppl. 1: 59–67
3. Chiba N, De Gara CJ, Wilkinson JM, et al. Speed of healing and symptom relief in grade II to IV gastroesophageal reflux disease: a meta–analysis. Gastroenterology 1997; 112:1798–810
4. Bell NJ, Hunt RH. Time to maximum effect of lansoprazole on gastric pH in normal male volunteers. Aliment Pharmacol Ther 1996; 10: 897–904
5. Blum RA, Shi H, Karol M, et al. The comparative effects of lansoprazole, omeprazole, and ranitidine in suppressing gastric acid secretion. Clin Ther 1997; 19: 1013–23
6. Takeda H, Hokari K, Asaka M. Evaluation of the effect of lansoprazole in suppressing acid secretion using 24–h intragastric pH monitoring. J Clin Gastroenterol 1995; 20 Suppl. 1:S7–9
7. Bruley des Varannes S, Levy P, Lartigue S, et al. Comparison of lansoprazole with omeprazole on 24–h intragastric pH, acid secretion, and serum gastrin in healthy volunteers. Aliment Pharmacol Ther 1994; 8 (3): 309–14
8. Dammann HG, Fuchs W, Richter G, et al. Influence of lansoprazole 15mg and omeprazole 20mg and 40mg on mealstimulated gastric acid secretion. Aliment Pharmacol Ther 1997; 11: 359–64
9. Tolman KG, Sanders SW, Buchi KN, et al. The effects of oral doses of lansoprazole and omeprazole on gastric pH. J Clin Gastroenterol 1997; 24: 65–70
10. Hussein Z, Granneman GR, Mukherjee D, et al. Age–related differences in the pharmacokinetics and pharmacodynamics of lansoprazole. Br J Clin Pharmacol 1993; 36: 391–8
11. Regardh GG. Pharmacokinetics and metabolism of omeprazole in man. Scand J Gastroenterol 1991; 21 Suppl. 118: 99–104
12. Williams MR, Sercombe J, Hamilton MI, et al. A placebo controlled trial to assess the effects of 8 Days of dosing with rabeprazole versus omeprazole on 24–h intragastric acidity and plasma gastric concentrations in young healthy male subjects. Aliment Pharmacol Ther 1998; 12: 1079–89
13. Gardner JD, Rodriquez–Stanley S, Robinson M. Integrated acidity and the pathophysiology of gastroesophageal reflux disease. Am J Gastroenterol 2001; 96: 1363–70
14. Gardner JD, Perdomo C, Sloan S, et al. Integrated acidity and rabeprazole pharmacology. Aliment Pharmacol Ther 2002; 16:455–64
15. Metropolitan Life Insurance Company. Stat Bulletin 1983; 2–9
16. Kahrilas PJ. Anatomy and physiology of the gastroesophageal junction. Gastroenterol Clin North Am 1997; 26 (3): 467–86
17. Miner P, Katz PO, Chen Y, et al. Gastric acid control with esomeprazole, lansoprazole, omeprazole, pantoprazole, and rabeprazole: a five–way crossover study. Am J Gastroenterol 2003; 98: 2616–20
18. Pantoflickova D, Dorta G, Ravic M, et al. Acid inhibition on the first day of dosing: comparison of four proton pump inhibitors. Aliment Pharmacol Ther 2003; 17: 1507–14
- что такое органоминеральное органоминеральные удобрения
- чем вывести старый запах кошачьей мочи с дивана

.gif)
.gif)