кто с чем реагирует неорганика
Таблица «Химические свойства неорганических веществ»
Химические свойства неорганических веществ
Кислотный оксид (кроме SiO 2 ) + вода = кислота
Кислотный оксид + основный оксид = соль
Кислотный оксид + щёлочь = соль + вода
Основный оксид + вода = щёлочь
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
Основание + кислота = соль + вода (реакция нейтрализации)
Щёлочь + кислотный оксид = соль + вода
Щёлочь + соль = новая соль + новое основание (Примечание 1)
Нерастворимое основание оксид + вода
Кислота + основный оксид = соль + вода
Кислота + основание = соль + вода
Кислота + металл = соль + водород (Примечание 2)
Кислота + соль = новая кислота + новая соль (Примечание 3)
Соль + щёлочь = новая соль + новое основание (Примечание 1)
Соль + кислота = новая соль + новая кислота (Примечание 3)
Соль 1 + соль 2 = соль 3 + соль 4 (Примечание 1)
Соль + металл = новая соль + новый металл (Примечание 4)
Металл + неметалл = соль
Металл + кислота = соль + водород (Примечание 2)
Металл + соль = новый металл + новая соль (Примечание 4)
Металл активный + вода = щёлочь + водород
Металл средней активности + вода = оксид металла + водород
Металл малоактивный + вода
Вода + основный оксид = щёлочь
Вода + кислотный оксид (кроме SiO 2 ) = кислота
Вода + металл (см. свойства Металлов)
До реакции оба вещества должны быть растворимыми в воде
После реакции одно или оба вещества – нерастворимые (т.е., должен быть осадок)
Металл должен находиться в ряду металлов до водорода
Нельзя брать кислоту азотную и серную концентрированную
Кислота должна быть растворимая в воде
Соль должна быть растворимая в воде
Кислота, вступающая в реакцию, должна быть сильная
Кислота, полученная после реакции, должна быть слабая
ИЛИ: В результате реакции выпадает осадок
Нельзя брать для реакции металлы, стоящие в ряду активности металлов до магния
Металл, вступающий в реакцию, должен быть активнее того металла, который получается
Обе соли должны быть растворимыми в воде
Азотная кислота + металл (не любой) = соль + вода + какое-либо соединение азота (например, NO 2 )
Серная кислота (конц.) + металл (не любой) = соль + вода + какое-либо соед-е серы (например, SO 2 )
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-576491
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
На новом «Уроке цифры» школьникам расскажут о разработке игр
Время чтения: 1 минута
Педагогов и учеников предлагают тренировать на случай нападения
Время чтения: 1 минута
Минпросвещения РФ опубликовало методические рекомендации по проведению инклюзивных смен для детей с ОВЗ
Время чтения: 2 минуты
Правительство предложило потратить до 1 млрд рублей на установку флагов РФ у школ
Время чтения: 1 минута
ФИПИ опубликовал демоверсии ОГЭ и ЕГЭ 2022
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Неорганическая химия
Ни одна вещь не возникает, не уничтожается, но каждая составляется из смешения существующих вещей или выделяется из них. (Анаксагор)
Неорганическая химия изучает свойства и реакции неорганических соединений (т.е., кроме органических соединений углерода). Число неорганических веществ приближается к 400 тысяч.
Разделы страницы по химии неорганических соединений:
О %nbsp;свойствах химического элемента вы можете почитать, указав его в таблице Менделеева.
Когда появились молекулы?
Стюарт Кауфман из Института системной биологии в США и его коллеги Давид Еленфи и Габор Ваттаи из Будапештского университета в Венгрии построили модель формирования молекул на разных стадиях развития Вселенной, которая воспроизводит наблюдающееся сегодня распределение соединений в межзвездной и межгалактической среде. Так как количество возможных соединений растет быстрее экспоненты в зависимости от количества атомов, то авторы ограничились только рассмотрением общей массы образующихся молекул.
За основу ученые взяли базу данных PubChem, в которой содержится информация о 90 миллионах различных молекул, большинство из которых встречаются в природе. Масса наибольшего количество соединений составляет 290 дальтон, что примерно соответствует 24 атомам углерода. Эти данные ученые сравнили с содержанием веществ в Мурчисонском метеорите — древнем теле, появившемся во времена формирования Солнечной системы около 5 миллиардов лет назад. В нем было обнаружено не менее 58 000 различных молекул, распределение которых по массам напоминает полную базу данных, но больше всего молекул с массой около 240 дальтон.
Затем авторы привлекают теорию образования молекул, согласно которой есть два основных пути их формирования: посредством случайного скапливания атомов, которое быстро порождает всевозможные легкие комбинации, и предпочтительного присоединения, которое медленно порождает небольшое количество из всех возможных молекул с большой массой. Зная скорости этих процессов и различия в распределениях в Мурчисонском метеорите и на Земле в целом, можно экстраполировать данные в прошлое и вывести время образования соединений. Авторы приходят к выводу, что молекулы начали образовываться примерно 12,8 миллиардов лет назад, а аминокислоты появились спустя еще 165 миллионов лет.
Виды неорганических веществ
Неорганические вещества делятся на простые (металлы и неметаллы) и сложные (оксиды, соли, основания, кислоты). [Последние являются результатом окислительно-восстановительных реакций.]
Простые [моноатомные] вещества состоят из атомов одного химического элемента. По своим химическим свойствам они делятся на:
Сложные [гетероатомные] вещества состоят из атомов двух или более химических элементов. Они по своим химическим свойствам делятся на:
Существуют и другие сложные вещества:
Химические реакции между неорганическими веществами
В основе реакционной способности атомов лежит незаполненность их электронного слоя. В ходе химической реакции металлы обычно отдают электроны, а неметаллы – принимают.
Металлы вступают в реакцию с неметаллами с образованием солей: 2Na + S = Na2S.
Металлы в реакциях с кислородом образуют обычно основные оксиды: 4Na + O2 = 2Na2O. Неметаллы в реакциях с кислородом образуют кислотные оксиды: S + O2 = SO2. Основные оксиды реагируют с кислотными оксидами с образованием солей: Na2O + SO2 = Na2SO3.
Основные оксиды реагируют с водой с образованием оснований: Na2O + H2O = 2NaOH. Кислотные оксиды реагируют с водой с образованием кислот: SO2 + H2O = H2SO3. Основания реагируют с кислотами с образованием солей: 2NaOH + H2SO3 = Na2SO3 + 2H2O.
Основные оксиды способны реагировать с кислотами, при этом образуются соли: Na2O + H2SO3 = Na2SO3. Кислотные оксиды реагируют с основаниями также с образованием солей: SO2 + 2NaOH = Na2SO3 + H2O.
Наибольшую реакционную способность проявляют типичные металлы и их соединения, и типичные неметаллы и их соединения. К типичным металлам относятся щелочные металлы, а также барий, стронций кальция. Активность всех остальных металлов и их соединений снижена. Так магний вступает в химическую реакцию только с кипящей водой и нагретыми парами воды, а оксид магния не реагирует с водой. Медь, к примеру, не реагирует с кислотами (не может быть окислена ионом водорода). Примерно тоже самое можно сказать о неметаллах. Наибольшую активность проявляют фтор, кислород, галогены.
Соли (состав и свойства)
Соли разделяются на растворимые в воде и нерастворимые в воде. О растворимости солей можно узнать из таблицы растворимости. Хорошо растворимы обычно соли щелочных металлов и аммония.
Средние соли состоят только из остатка кислоты и основания: CaSO4, Ba(NO3)2. Кислые соли кроме катиона металла содержат катион водорода, следовательно, они проявляют все свойства солей и кислот: Ca(HCO3)2 + Сa(OH)2 = 2CaCO3 + 2H2O.
Основные соли включают в свой состав также гироксильную группу и проявляют свойства солей и оснований: (MgOH)2SO4 + H2SO4 = 2MgSO4 + 2H2O.
Основания и щёлочи
Основания делятся на растворимые в воде и нерастворимые в воде. Растворимые основания называют щелочами.
Щелочами являются гидроксиды щелочных металлов, а также гидроксиды бария, стронция кальция.
Кислоты
Все изучаемые в школе кислоты, кроме кремниевой растворимы в воде. Кислоты можно разделить на сильные и слабые. Сильные кислоты: это азотная HNO3, серная H2SO4, хлорная HClO4, хлороводородная (соляная) HCl, бромоводородная HBr, йодоводородная HI.
Как реагируют амфотерные вещества (простые и сложные)
Кроме вышеописанных существуют амфотерные простые вещества, оксиды и гидроксиды.
Амфотерные простые вещества
Амфотерными простыми веществами изучаемыми в школе являются бериллий Be, алюминий Al и цинк Zn. Амфотерные простые вещества реагируют как с кислотами, так и с основаниями. Например: Zn + 2HCl = ZnCl2 + H2; Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2.
Амфотерные оксиды
К амфотерным оксидам относят BeO, Al2O3, ZnO, H2O, Cr2O3, Fe2O3. Амфотерные оксиды реагируют с кислотами и основаниями, а также основными и кислотными оксидами: ZnO + 2HCl = ZnCl2 + H2O; ZnO + 2KOH + H2O = K2[Zn(OH)4]; SO3 + H2O = H2SO4; K2O + H2O = 2KOH.
Амфотерные гидроксиды
Амфотерные гидроксиды – сложные вещества, которые имеют свойства и кислот, и оснований. Все они — твердые вещества, не растворимые в воде. Они растворяются в кислотах и щелочах: Zn + 2OH = Zn(OH)2 = 2H + ZnO2 Cr + 3OH = Cr(OH)3 = H + CrO2 + H2O
Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов. К амфотерным гидроксидам относят Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3.
Направления реакционной способности основных классов неорганических веществ
Все вышесказанное удобно представить в виде схемы:
Свойства неорганических веществ
Теория к заданию 9 из ЕГЭ по химии
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
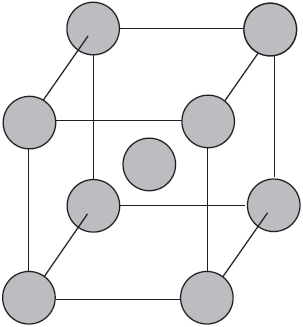
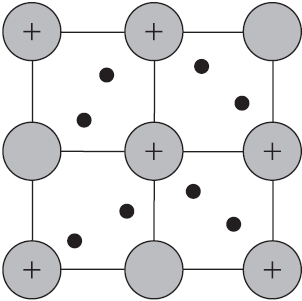
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
Олово имеет две кристаллические модификации:
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
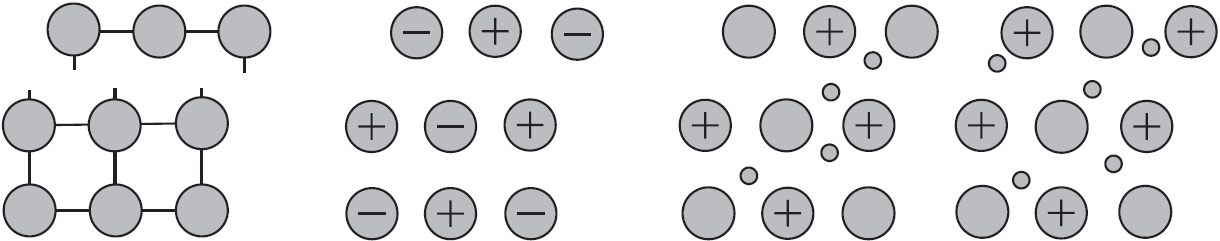
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
В технике принято классифицировать металлы по различным физическим свойствам: