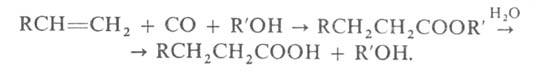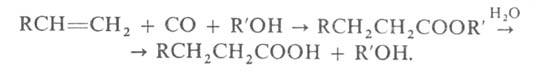что такое вжк в химии
ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ
(ВЖК), натуральные (природные) и синтетич. карбоновые к-ты алифатич. ряда с числом атомов углерода в молекуле не менее 6.
Получают натуральные ВЖК из жиров и масел. В промети используют преим. высокотемпературный (200-225 o С) гидролиз под давлением (
2,50 МПа), реже-кислотный гидролиз в присут. контакта Петрова. В лаб. условиях ВЖК синтезируют кислотным гидролизом в присут. реактива Твитчеля (смесь олеиновой и серной к-т с бензолом), ферментативным (липазным) гидролизом, омылением р-рами гидроксидов металлов I группы с послед. разложением образовавшихся солей (мыл) водными р-рами H2SO4 или НС1.
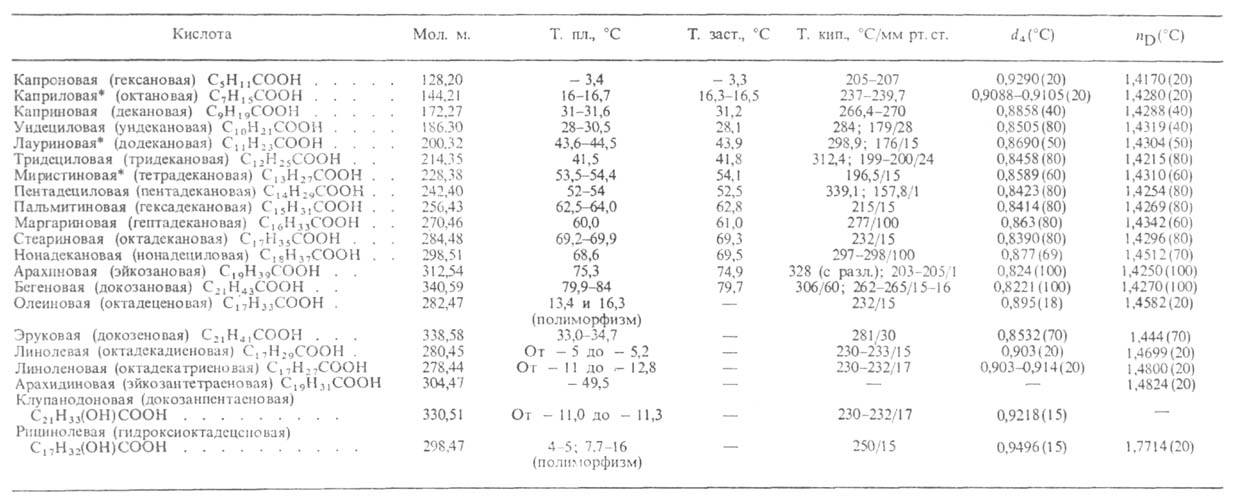
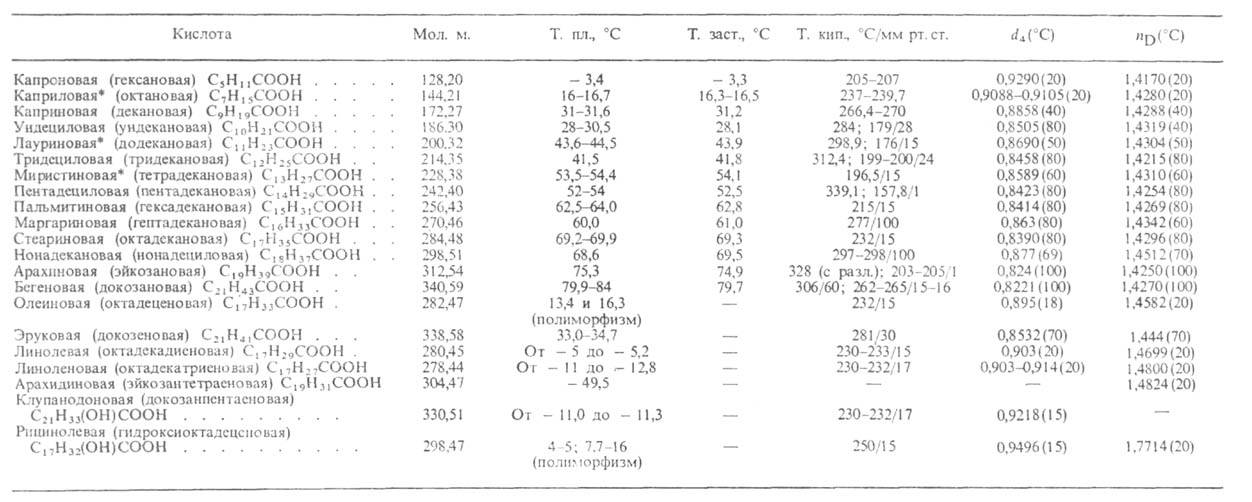
Табл. 1.-СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ВЫСШИХ ЖИРНЫХ КИСЛОТ
Смотреть что такое «ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ» в других словарях:
СУЛЬФИРОВАННЫЕ ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ — техн. продукты взаимод. высших жирных к т, их эфиров, а также растит. масел и животных жиров с сульфирующими агентами (H2SO4, HSO3C1, SO3, олеум и др.); анионные ПАВ. В зависимости от хим. строения реагирующих в в и условий сульфирования основу… … Химическая энциклопедия
Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа… … Википедия
ЖИРНЫЕ КИСЛОТЫ — одноосновные карбоновые кислоты алифатич. ряда. Осн. структурный компонент мн. липидов (нейтральных жиров, фосфоглицеридов, восков и др.). Свободные Ж. к. присутствуют в организмах в следовых кол вах. В живой природе преим. встречаются высшие Ж.… … Биологический энциклопедический словарь
Жирные кислоты — I Жирные кислоты карбоновые кислоты; в организме животных и в растениях свободные и входящие в состав липидов жирные кислоты выполняют энергетическую и пластическую функции. Ж. к. в составе фосфолипидов участвуют в построении биологических… … Медицинская энциклопедия
СИНТЕТИЧЕСКИЕ ЖИРНЫЕ КИСЛОТЫ — см. Высшие жирные кислоты … Химическая энциклопедия
Карбоновые кислоты — класс органических соединений, содержащих карбоксильную группу (карбоксил) Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная… … Большая советская энциклопедия
Жировые кислоты — Жирные кислоты (алифатические кислоты) многочисленная группа исключительно неразветвлённых одноосновных карбоновых кислот с открытой цепью. Название определяется, во первых, химическими свойствами данной группы веществ основанными на присутствии… … Википедия
Предельные органические кислоты* — (хим.) П. органические кислоты можно рассматривать как продукты замещения водородных атомов предельных углеводородов (см. Парафины) карбоксильными группами (см. Кислоты). Смотря по числу последних различают кислоты П. одноосновные, общей формулы… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Предельные органические кислоты — (хим.) П. органические кислоты можно рассматривать как продукты замещения водородных атомов предельных углеводородов (см. Парафины) карбоксильными группами (см. Кислоты). Смотря по числу последних различают кислоты П. одноосновные, общей формулы… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ИСПРАЖНЕНИЯ — (кал, faeces, kopros), содержимое нижних отделов кишечника, образовавшееся в результате акта пищеварения и выделяющееся при акте дефекации. Уже древние врачи придавали внешнему виду И. большое значение для диагноза и прогноза б ни. Левенгук… … Большая медицинская энциклопедия
ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ
Получают натуральные ВЖК из жиров и масел. В промышленности используют преим. высокотемпературный (200-225 o С) гидролиз под давлением (
2,50 МПа), реже-кислотный гидролиз в присут. контакта Петрова. В лаб. условиях ВЖК синтезируют кислотным гидролизом в присут. реактива Твитчеля (смесь олеиновой и серной к-т с бензолом), ферментативным (липазным) гидролизом, омылением р-рами гидроксидов металлов I группы с послед. разложением образовавшихся солей (мыл) водными р-рами H2SO4 или НС1.
Табл. 1.-СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ВЫСШИХ ЖИРНЫХ КИСЛОТ
* Вязкости каприловой, лауриновой и ммристнновой к-т соотв. 5,83 МПа*с (20°С), 6,877 МПа*с (20°С) и 5,06 МПа*с (75 o С).
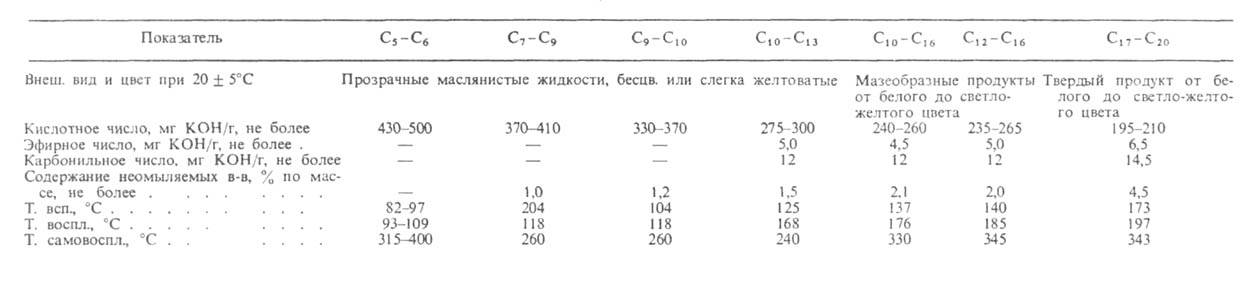
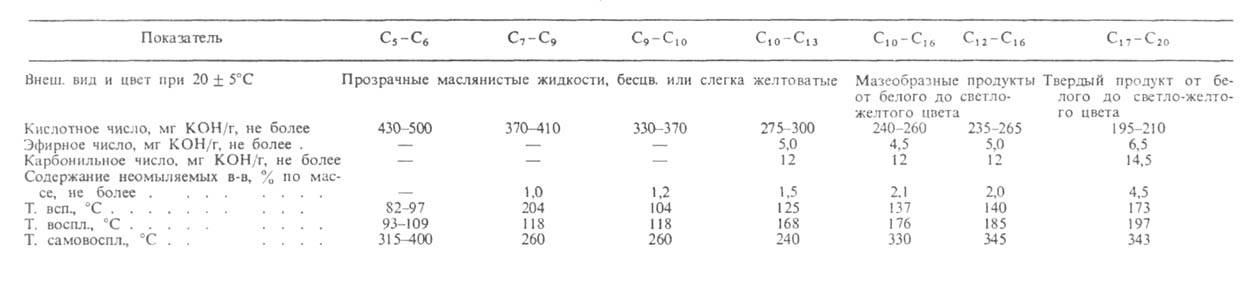
Табл. 1-ХАРАКТЕРИСТИКА ФРАКЦИЙ* СИНТЕТИЧЕСКИХ ЖИРНЫХ КИСЛОТ
Преимущества процессов: малостадийность, высокие выходы к-т; недостатки: довольно жесткие условия, образование большого кол-ва (до 50%) к-т изостроения.
Мощности по произ-ву ВЖК в капиталистич. странах оцениваются в 2,5 млн. т/год (1984). Загрузка мощностей 50-80%. При этом на долю синтетич. к-т приходится только 10%. Ресурсы произ-ва натуральных ВЖК значительны (см. Жиры животные, Растительные масла), однако фракционный состав их узок и ограничивается к-тами С12—С18, а гл. обр. C16 и С18. Возросший интерес к к-там до С12 и выше С20 стимулирует развитие произ-ва ВЖК из нефтехим. сырья.
===
Исп. литература для статьи «ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ» : Тютюнников Б. Н., Химия жиров, 2 изд., M. 1974; Брунштейн Б. А., Клименко В. Л., Цыркин Е. Б., Производство синтетических кислот из нефтяного и газового сырья. Л., 1970; Бол о тин И. М., Милосердое П. Н., Суржа Е. И.. Синтетические жирные кислоты и продукты на их основе, М., 1970; Kirk-Othmer encyclopedia, 3 ed., v. 4, N. Y.-[a. о.], 1978, p. 814-71; Hofmann P., Muller W., «Hydrocarbon Processing», 1981, v. 60, № 10, Sect. 1, p. 151-57. Н. С. Баршюв.
Страница «ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ» подготовлена по материалам химической энциклопедии.
Высшие жирные кислоты
По количеству углеродных атомов в радикале различают кислоты низшие (низкомолекулярные) и высшие (высокомолекулярные), содержащие более 10 атомов углерода.
Высшие кислоты входят в состав жиров (липидов) и поэтому носят название “жирные кислоты” (ВЖК). Наиболее известными карбоновыми кислотами, которые входят в состав жиров, являются:
С3Н7СООН масляная кислота (низшая кислота)
С15Н31СООН пальмитиновая кислота
С17Н35СООН стеариновая кислота
С17Н33СООН олеиновая кислота
С17Н31СООН линолевая кислота
С17Н29СООН линоленовая кислота
Нетрудно заметить, что эти жирные кислоты (их еще называют незаменимыми жирными кислотами) имеют неразветвленную цепочку с четным числом атомов углерода, что объясняется особенностями их биосинтеза, который происходит из остатков уксусной кислоты (С2).
ВЖК – в основном бесцветные, твердые вещества без вкуса и запаха. В воде они не растворяются, но хорошо растворяются в органических растворителях.
Смесь пальмитиновой и стеариновой кислоты называют “стеарином”.
ВЖК также растворимы в водных концентрированных растворах щелочей, при этом образуются соли ВЖК – мыла.
Высшие жирные кислоты применяются в производстве синтетических моющих средств, синтетического каучука, линолеума, лакокрасочных изделий, в качестве гидрофобизирующих веществ для обработки строительных материалов.
Вопрос № 6. Сложные эфиры (30 мин)
Сложными эфирами называются органические соединения, молекулы которых состоят из углеводородных радикалов (остатков спирта) и кислотных остатков, соединенных атомом кислорода. Сложные эфиры можно рассматривать как производные кислот, у которых атом водорода в карбоксиле замещен радикалом:
Общая формула сложных эфиров такая же, как и у карбоновых кислот СnH2nO2.
Сложные эфиры могут быть образованы как органическими, так и неорганическими кислотами:
этиловый эфир этиловый эфир этиловый эфир
уксусной кислоты серной кислоты азотной кислоты
Номенклатура сложных эфиров
Сложные эфиры в большинстве своем называют по тем кислотам и спиртам, остатки которых участвуют в их образовании. По систематической номенклатуре сложные эфиры называют, прибавляя в качестве приставки название спиртового радикала к названию кислоты, в котором окончание “- овая” заменяется на “- оат”.
метиловый эфир этиловый эфир этиловый эфир метиловый эфир
муравьиной уксусной пропионовой масляной
кислоты кислоты кислоты кислоты
метиловый эфир этиловый эфир этиловый эфир метиловый эфир
метановой этановой пропановой бутановой
кислоты кислоты кислоты кислоты
метилметаноат этилэтаноат этилпропаноат метилбутаноат
метилформиат этилацетат метилпропионат метилбутират
Изомерия сложных эфиров
Изомерия сложных эфиров определяется изомерией радикалов кислот и спиртов, участвующих в их образовании.
Сложные эфиры являются межклассовыми изомерами с карбоновыми кислотами, имея одинаковую общую формулу.
Физические свойства сложных эфиров
Этилацетат – жидкость с приятным запахом, легко испаряется, плохо растворяется в воде. С воздухом этилацетат образует взрывоопасные смеси. Эфир способен к электризации. При контакте с сильными окислителями (перманганатом калия КMnO4, хромовым ангидридом CrO3, перекисью натрия Na2O2) самовозгорается.
Способы получения сложных эфиров
Важнейший способ получения сложных эфиров – реакция этерификации: взаимодействие кислоты и спирта.
уксусная кислота пропанол-1 пропиловый эфир уксусной кислоты
С помощью метода меченых атомов доказано, что при этерификации от молекулы кислоты отщепляется гидроксильная группа ОН-, а от молекулы спирта – водород.
Химические свойства сложных эфиров
1. Гидролиз сложных эфиров
Гидролиз сложных эфиров является их основным химическим свойством. Это реакция расщепления сложных эфиров под действием воды (обратна реакции этерификации). Реакция протекает как в кислой (катализаторы реакции – протоны Н + ), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН – ).
пропиловый эфир уксусной кислоты уксусная пропанол-1
пропиловый эфир уксусной кислоты ацетат пропанол-1
В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
В растворах разбавленных минеральных кислот соли карбоновых кислот вновь превращаются в исходную карбоновую кислоту:
ацетат натрия уксусная кислота
2. Реакция восстановления
При восстановлении сложных эфиров образуется смесь двух спиртов:
Применение сложных эфиров
Многие сложные эфиры обладают приятным запахом. Так, амиловый эфир муравьиной кислоты имеет запах вишни, изоамиловый эфир уксусной кислоты – запах груш. Эти эфиры идут на изготовление искусственных эссенций, используемых в производстве фруктовых вод и т.п., а также в парфюмерии.
Этилацетат используется в качестве растворителя, а также при изготовлении лекарственных средств.
Жиры – это смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Строение жиров было выяснено в 1811 г французским химиком Шеврелем. В 1854 г Бертло доказал строение жиров, получив их нагреванием глицерина с ВЖК.
Общее название этих эфиров – глицериды. Они могут содержать как одинаковые, так и разные кислотные остатки. Чаще всего встречаются кислоты с числом атомов углерода 12 – 18.
Как правило, все сложные эфиры, входящие в состав жиров, являются полными эфирами, т.е. производными глицерина, остаток которого связан с тремя остатками ВЖК; такие полные эфиры глицерина называются триглицеридами.
Реакция получения триглицерида олеодистеарина, состоящего из остатка олеиновой кислоты и двух остатков стеариновой кислоты может быть записана следующим образом:
глицерин ВЖК олеодистеарин
Глицерин – постоянная составная часть жиров, т.е. входит во все природные жиры. Кислоты же, входящие в состав жиров весьма разнообразны. Из жиров выделено около 50 различных кислот.
В настоящее время практическое значение имеет лишь получение жиров из природных источников – животных и растений; синтез жиров пока экономически невыгоден.
Физические свойства жиров
Жиры бывают животного и растительного происхождения. Некоторые жиры при обычной температуре – твердые вещества (например, баранье и говяжье сало), другие – мягкие или даже жидкие. Жидкие жиры обычно называют маслами.
Химические свойства жиров
1. Гидролиз (омыление) жиров
В результате омыления жиров щелочами образуются соли ВЖК – мыла и глицерин:
СН – О – ОС – С17Н35 + 3NaOH® СН – ОН + 3 С17Н35СООNa
триглицерид глицерин стеарат натрия
стеариновой кислоты (мыло)
2. Гидрогенизация (гидрирование) жиров
Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров, в результате чего эти остатки переходят в остатки предельных кислот.
Например, остатки олеиновой, линолевой и линоленовой кислот, присоединяя два, четыре или шесть атомов водорода, превращаются в остатки стеариновой кислоты.
Твердые гидрогенизованные жиры используются не только для технических целей (мыловарение), но и как пищевые жиры (маргарин).
Название “маргарин” происходит от греческого слова “маргарон”, т.е. жемчуг. Впервые метод получения маргарина путем гидрогенизации растительных жиров был предложен французский химиком Меж-Мурье. Маргарин принес ему славу – он выиграл приз, назначенный Наполеоном III за изобретение заменителя сливочного масла.
При более значительной гидрогенизации жиров жирные кислоты превращаются в высокомолекулярные спирты, применяющиеся для производства синтетических заменителей мыла.
с Характерным свойством жиров, как и других органических веществ, является окисление. Эта реакция сопровождается выделением 39 кДж энергии на 1 г жира, что более чем в два раза превосходит тепловой эффект окисления углеводов или белков.
Другая особенность окисления жиров состоит в том, что в результате окисления из 1 г жира образуется до 1, 4 г воды. Это существенный вклад в поддержание общего водного баланса организма. Отдельные виды обитающих в пустынях животных (например, верблюды) такой эндогенной водой полностью удовлетворяют свои потребности во влаге.
Окислению могут подвергаться и остатки непредельных жирных кислот по месту их кратных связей. Этот процесс называется прогорганием жиров. В результате образуются кислоты с более короткими цепями типа масляной кислоты, обладающие неприятным запахом.
От количества кратных связей зависит и способность масел к высыханию. Растительные масла, содержащие в своем составе ненасыщенные связи, при окислении образуют твердую тонкую прозрачную пленку, которая носит название “линоксин”. Масло высыхает тем легче, чем больше двойных связей имеют кислотные остатки.
| Масла, по способности к высыханию делятся на | ||
| высыхающие | полувысыхающие | Невысыхающие |
| льняное, ореховое, маковое, конопляное | подсолнечное, хлопковое | оливковое, кокосовое |
Чтобы ускорить процесс высыхания, высыхающие масла варят и прибавляют к ним так называемые сиккативы – катализаторы, ускоряющие высыхание. В качестве сиккативов используются соли марганца, кобальта, свинца. Высыхающее масло, подвергнутое нагреванию (варке) в присутствии сиккативов, называется олифой.
Процесс высыхания олифы очень сложен и еще полностью не изучен. Известно, что в основе высыхания лежит процесс полимеризации остатков непредельных кислот, образующих высыхающие масла, а также, возможно, их окисления. Кислород воздуха, так же как и сиккативы, является катализатором полимеризации.
Олифа применяется для приготовления масляных красок, для приготовления клеенки, линолеума и т.д.
Мыла
Мыла – соли высокомолекулярных карбоновых кислот.
стеариновая стеарат натрия
Соли щелочно-земельных металлов (Са, Mg, Ва) в воде не растворяются и выпадают в осадок. По этой причине моющая способность мыл в жесткой воде, содержащей соли этих металлов, резко падает.
Под моющим действием понимают способность моющих веществ и их растворов удалять с отмываемых поверхностей прилипшие частицы грязи и переводить их во взвешенное состояние в виде эмульсии и суспензии.
Моющим действием обладают соли карбоновых кислот с числом атомов углерода от 11 до 20. Соли карбоновых кислот с числом углеродных атомов меньше 10 и выше 20 моющим действием не обладают.
Мыла получают в качестве в мыловаренной промышленности при переработке жиров.
СН – О – ОС – С17Н35 + 3NaOH® СН – ОН + 3 С17Н35СООNa
триглицерид глицерин стеарат натрия
стеариновой кислоты (мыло)
В настоящее время широко используются поверхностно-активные вещества ПАВ (смачиватели, детергенты), представляющие собой натриевые соли сульфокислот. Сульфокислоты – производные углеводородов, в которых атом водорода замещен остатком серной кислоты – SO3H.
Воски
Воски (воска) – это сложные эфиры жирных кислот и одноатомных высокомолекулярных (высших) спиртов. Это жироподобные вещества растительного и животного происхождения. Только вместо глицерина в состав восков входят высшие спирты.
По внешнему виду, физическим свойствам и источникам происхождения жиры и воска имеют много общего, однако воски очень устойчивы к воздействию химических реагентов и не изменяются при длительном хранении.
Существует простой способ, помогающий их различить. При сильном нагревании жир издает резкий неприятный запах акролеина, а воск при этом имеет приятный запах.
Воски бывают растительные, животные, ископаемые и синтетические.
Карнаубский воск покрывает листья бразильской пальмы Coperniciacerifera. Представляет собой сложный эфир триаконтанола СН3(СН2)29ОН и тетракозановой кислоты СН3(СН2)22СООН. Для получения карнаубского воска листья пальмы высушивают, из них выколачивают порошок, который вываривают в воде и выливают в формы. 2000 листьев дают около 16 кг воска. Используют карнаубский воск для изготовления мастик, кремов для обуви.
Пальмовый воск находится в углублениях кольчатого ствола восковой пальмы, откуда его соскабливают. Одно дерево дает 12 кг воска.
Японский воск добывают из лакового дерева, произрастающего в Японии и Китае.
Растительными восками покрыты фрукты, овощи и ягоды (например, черника).
Пчелиный воск – наиболее известный из этого вида восков – представляет собой пальмитиномирициловый эфир.
Шерстяной (шерстный) воск – ланолин – обильно покрывает шерсть животных.
Спермацет содержится в костных черепных углублениях некоторых видов китов, особенно кашалотов. На 90 % состоит из пальмитиноцетилового эфира:
Китайский воск вырабатывается червецом, который обитает на китайском ясене и образует на нем восковой покров. Содержит сложный эфир гексакозановой кислоты СН3(СН2)24СООН и гексадеканового спирта СН3(СН2)15ОН.
К воскам относятся кожное сало и ушная сера.
Воск бактерий покрывает поверхность кислотоупорных бактерий, например, туберкулезных, обеспечивая их устойчивость к внешним воздействиям. Содержит сложные эфиры миколевой кислоты С88Н172О2 и октадеканола С20Н42О.
Торфяной воск получают экстракцией бензином при 80 0 С верхового битуминозного торфа.
Буроугольный воск (монтан-воск) извлекают бензином из бурого битуминозного угля.
Горный воск – озокерит – минерал из группы нефтяных битумов.
Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Воски применяют более чем в 200 отраслях народного хозяйства. Они входят в состав политур, защитных композиций для металлов, тканей, бумаги, кож, дерева; как изолирующий материал; компоненты мазей в косметике и медицине.
Дата добавления: 2016-12-26 ; просмотров: 3728 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
главная > справочник > химическая энциклопедия:
Высшие жирные кислоты
Высшие жирные кислоты (ВЖК), натуральные (природные) и синтетические карбоновые кислоты алифатического ряда с числом атомов углерода в молекуле не менее 6.
Получают натуральные высшие жирные кислоты из жиров и масел. В промышленности используют преимущественно высокотемпературный (200-225 o С) гидролиз под давлением (
Табл. 1.-СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ВЫСШИХ ЖИРНЫХ КИСЛОТ
* Вязкости каприловой, лауриновой и ммристнновой кислот соотв. 5,83 МПа*с (20°С), 6,877 МПа*с (20°С) и 5,06 МПа*с (75 o С).
Преимущества процессов: малостадийность, высокие выходы кислот; недостатки: довольно жесткие условия, образование большого количества (до 50%) кислот изостроения.
Мощности по производству высших жирных кислот в капиталистических странах оцениваются в 2,5 млн. т/год (1984). Загрузка мощностей 50-80%. При этом на долю синтетических кислот приходится только 10%. Ресурсы производства натуральных высших жирных кислот значительны (см. Жиры животные, Растительные масла), однако фракционный состав их узок и ограничивается кислотами С12—С18, а главным образом C16 и С18. Возросший интерес к кислотам до С12и выше С20 стимулирует развитие производства высших жирных кислот из нефтехимического сырья.
Лит.: Тютюнников Б. Н., Химия жиров, изд., M. 1974; Брунштейн Б. А., Клименко В. Л., Цыркин Е. Б., Производство синтетических кислот из нефтяного и газового сырья. Л., 1970; Болотин И. М., Милосердое П. Н., Суржа Е. И.. Синтетические жирные кислоты и продукты на их основе, М., 1970; Kirk-Othmer encyclopedia, 3 ed., v. 4, N. Y.-[a. о.], 1978, p. 814-71; Hofmann P., Muller W., «Hydrocarbon Processing», 1981, v. 60, № 10, Sect. 1, p. 151-57. Н. С. Баршев.
ЖИРНЫЕ КИСЛОТЫ
Жирные кислоты – алифатические карбоновые кислоты – в организме могут находиться в свободном состоянии (следовые количества в клетках и тканях) либо выполнять роль строительных блоков для большинства классов липидов.
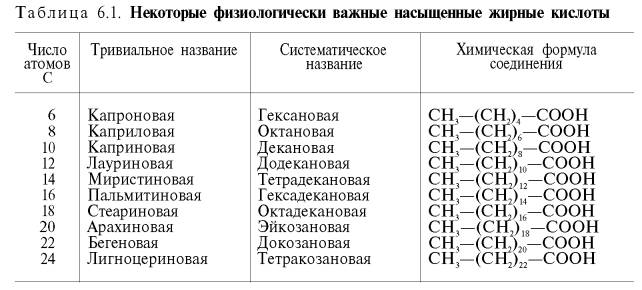
В природе обнаружено свыше 200 жирных кислот, однако в тканях человека и животных в составе простых и сложных липидов найдено около 70 жирных кислот, причем более половины из них в следовых количествах. Практически значительное распространение имеют немногим более 20 жирных кислот. Все они содержат четное число углеродных атомов, главным образом от 12 до 24. Среди них преобладают кислоты, имеющие С16 и С18 (пальмитиновая, стеариновая, олеиновая и линолевая). Нумерацию углеродных атомов в жирно-кислотной цепи начинают с атома углерода карбоксильной группы. Примерно 3 /4 всех жирных кислот являются непредельными (ненасыщенными), т.е. содержат двойные связи.
Систематическое название жирной кислоты чаще всего образуется путем добавления к названию углеводорода окончания -овая. Насыщенные кислоты при этом имеют окончание -ановая (например, октановая кислота – систематическое название, каприловая кислота – тривиальное название), а ненасыщенные кислоты – -еновая (например, октадеценовая кислота – систематическое название, олеиновая кислота – тривиальное название) (табл. 6.1; 6.2).
В соответствии с систематической номенклатурой количество и положение двойных связей в ненасыщенных жирных кислотах часто обозначают с помощью цифровых символов: например, олеиновую кислоту как 18:1;9, линолевую кислоту как 18:2;9,12, где первая цифра – число углеродных атомов, вторая – число двойных связей, а следующие цифры – номера ближайших к карбоксилу углеродных атомов, вовлеченных в образование двойной связи.
В специальной литературе жирные кислоты часто изображают в виде зигзагообразной вытянутой линии, отражающей жесткость валентного угла атомов углерода в 111° для насыщенной и в 123° – для двойной связи. Однако такая конформация является условной и справедлива только для случая, когда жирная кислота находится в кристаллическом состоянии. В растворах жирно-кислотная цепь может образовывать бесчисленное количество конформаций вплоть до клубка, в котором имеются и линейные участки различной длины в зависимости от числа двойных связей. Клубки могут слипаться между собой, образуя так называемые мицеллы. В последних отрицательно заряженные карбоксильные группы жирных кислот обращены к водной фазе, а неполярные углеводородные цепи спрятаны внутри мицеллярной структуры. Такие мицеллы имеют суммарный отрицательный заряд и в растворе остаются суспендированными благодаря взаимному отталкиванию.
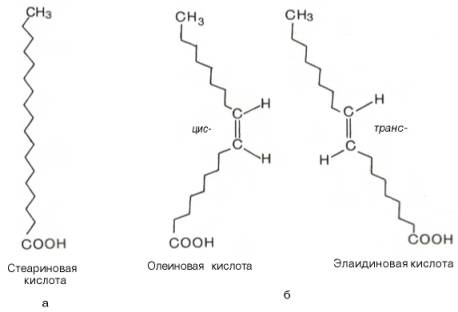
Известно также, что при наличии двойной связи в жирнокислотной цепи вращение углеродных атомов относительно друг друга ограничено. Это обеспечивает существование ненасыщенных жирных кислот в виде геометрических
изомеров (рис. 6.1), причем природные ненасыщенные жирные кислоты имеют цис-конфигурацию и крайне редко транс-конфигурации. Считают, что жирной кислоте с несколькими двойными связями цис-конфигурация придает углеводородной цепи изогнутый и укороченный вид. По этой причине молекулы этих кислот занимают больший объем, а при образовании кристаллов упаковываются не так плотно, как транс-изомеры. Вследствие этого цис-изомеры имеют более низкую температуру плавления (олеиновая кислота, например, при комнатной температуре находится в жидком состоянии, тогда как элаидиновая – в кристаллическом). Цис-конфигурация делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму.
Рис. 6.1. Конфигурация 18-углеродных насыщенных (а) и мононенасыщенных (б) жирных кислот.