что такое всс в медицине
Внезапная сердечная смерть
Внезапная сердечная смерть – это асистолия или фибрилляция желудочков, возникшая на фоне отсутствия в анамнезе симптомов, свидетельствующих о коронарной патологии. Основные проявления включают отсутствие дыхания, артериального давления, пульса на магистральных сосудах, расширение зрачков, отсутствие реакции на свет и любых видов рефлекторной деятельности, мраморность кожи. Через 10-15 минут отмечается возникновение симптома кошачьего глаза. Патология диагностируется на месте по клиническим признакам и данным электрокардиографии. Специфическое лечение – мероприятия сердечно-легочной реанимации.
МКБ-10
Общие сведения
Причины
Факторы риска по ВКС не отличаются от таковых для ишемической болезни. К числу провоцирующих воздействий относится курение, употребление большого количества жирной пищи, артериальная гипертензия, недостаточное поступление в организм витаминов. Немодифицируемые факторы – пожилой возраст, мужской пол. Патология может возникать под действием внешних влияний: чрезмерных силовых нагрузок, ныряния в ледяную воду, недостаточной концентрации кислорода в окружающем воздухе, при остром психологическом стрессе. В перечень эндогенных причин остановки сердца входят:
Патогенез
Патогенез напрямую зависит от причин, вызвавших заболевание. При атеросклеротическом поражении коронарных сосудов происходит полная окклюзия одной из артерий тромбом, кровоснабжение миокарда нарушается, формируется очаг некроза. Сократительная способность мышцы снижается, что приводит к возникновению острого коронарного синдрома и прекращению кардиальных сокращений. Нарушения проводимости провоцируют резкое ослабление работы миокарда. Нед остаточная сократительная способность становится причиной снижения сердечного выброса, застоя крови в камерах сердца, образования тромбов.
При кардиомиопатиях патогенетический механизм основан на непосредственном снижении работоспособности миокарда. При этом импульс распространяется нормально, однако сердце по тем или иным причинам слабо на него реагирует. Дальнейшее развитие патологии не отличается от блокады проводящей системы. При ТЭЛА нарушается приток венозной крови к легким. Происходит перегрузка ПЖ и других камер, формируется застой крови в большом круге кровообращения. Переполненное кровью сердце в условиях гипоксии оказывается неспособным продолжать работу, происходит его внезапная остановка.
Классификация
Симптомы внезапной сердечной смерти
Сердечная остановка характеризуется утратой сознания. Пульс не определяется как на лучевой, так и на магистральных артериях. Остаточное дыхание может сохраняться на протяжении 1-2 минут с момента развития патологии, но вдохи не обеспечивают необходимой оксигенации, так как кровообращение отсутствует. При осмотре кожа бледная, синюшная. Отмечается цианоз губ, мочек ушей, ногтей. Зрачки расширены, не реагируют на свет. Отсутствует любая реакция на внешние раздражители. При тонометрии АД тоны Короткова не выслушиваются.
Осложнения
К числу осложнений относится метаболическая буря, которая наблюдается после успешных реанимационных мероприятий. Изменения pH, обусловленные длительной гипоксией, приводят к нарушению деятельности рецепторов, гормональных систем. При отсутствии необходимой коррекции развивается острая почечная или полиорганная недостаточность. Почки также могут поражаться микротромбами, образующимися при появлении ДВС-синдрома, миоглобином, выброс которого происходит при дегенеративных процессах в поперечнополосатой мускулатуре.
Некачественно проведенная сердечно-легочная реанимация становится причиной декортикации (смерти мозга). При этом тело пациента продолжает функционировать, однако кора больших полушарий погибает. Восстановление сознания в таких случаях невозможно. Сравнительно легкий вариант церебральных изменений – постгипоксическая энцефалопатия. Характеризуется резким снижением умственных способностей больного, нарушением социальной адаптации. Возможны соматические проявления: параличи, парезы, нарушение функции внутренних органов.
Диагностика
Неотложная помощь
Помощь пострадавшему оказывают на месте, транспортировка в ОРИТ осуществляется после восстановления сердечного ритма. Вне ЛПУ реанимацию проводят путем простейших базовых приемов. В условиях стационара или машины скорой помощи возможно использование сложных специализированных методик электрической или химической дефибрилляции. Для оживления применяют следующие методы:
Прогноз и профилактика
Прогноз при любой разновидности ВСС неблагоприятный. Даже при своевременно начатой СЛР высок риск ишемических изменений в тканях ЦНС, скелетных мышцах, внутренних органах. Вероятность успешного восстановления ритма выше при фибрилляции желудочков, полная асистолия прогностически менее благоприятна. Профилактика заключается в своевременном выявлении сердечных заболеваний, исключении курения и употребления алкоголя, регулярных умеренных аэробных тренировках (бег, ходьба, прыжки через скакалку). От чрезмерных физических нагрузок (тяжелая атлетика) рекомендуется отказаться.
Синдром Бругада – загадочная причина внезапной смерти
Внезапная сердечная смерть — одна из ведущих причин смертности в развитых странах. Частота ее развития составляет 15–20 % от всех ненасильственных случаев смерти. К заболеваниям, ассоциированным с высоким риском ВСС в молодом возрасте, относят синдром внезапной смерти младенцев, синдром удлиненного интервала Q-T, аритмогенную дисплазию правого желудочка, идиопатическую фибрилляцию желудочков и др. Сегодня речь пойдет об одном из наиболее загадочных заболеваний в этом ряду — синдроме Бругада. Впервые данный синдром описан испано-бельгийскими кардиологами, братьями Хосепом и Педро Бругада. В 1992 г. они опубликовали результаты наблюдения за 8 пациентами, имевшими в анамнезе синкопе и эпизоды клинической смерти. Для верификации причин этому пациентам были выполнены инструментальные исследования: ЭКГ, эхокардиография, нагрузочное тестирование, ангиография, ЭФИ сердца, биопсия миокарда. В результате исследования братьями Бругада впервые были описаны характерные изменения на электрокардиограмме, позволяющие определить высокий риск возникновения нарушений ритма у лиц без органических изменений сердца.
Итак, что же такое синдром Бругада?
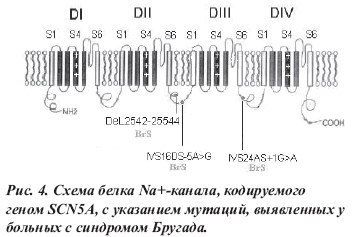
Синдром Бругада — это генетически детерминированное нарушение сердечного ритма, обусловленное мутацией гена SCN5A, кодирующего биосинтез белковых субъединиц натриевого канала кардиомиоцитов, и проявляющееся синкопальными состояниями, подъемами сегмента ST в правых прекардиальных отведениях (V1-V3) с инвертированным зубцом Т, полной или неполной БПНПГ, периодическим удлинением интервала P-R с высоким риском развития жизнеугрожающих желудочковых тахиаритмий (эпизодов полиморфной ЖТ и ФЖ), обычно развивающихся во сне или в спокойном состоянии.
Эпидемиология
Частота встречаемости данного заболевания — 5 на 10 000 человек, хотя, учитывая сложность диагностики, точную цифру назвать трудно. Наиболее распространен этот синдром в Юго-Восточной Азии, тогда как в западных странах частота встречаемости несколько ниже (2–3 случая на 10 000 человек).
Патофизиологические основы
Ионные механизмы синдрома Бругада связаны с уменьшением количества или ускоренной инактивацией натриевых каналов в клетках эпикарда правого желудочка, что приводит к уменьшению плотности потока натрия и преждевременной реполяризации эпикарда. Кроме того, было обнаружено перемещение натриевых каналов с поверхности клеток в ЭПР, что также нарушает их функцию. Потеря вершины ПД на участках эпикарда при его нормальной величине в эндокарде создает дисперсию реполяризации стенки желудочка, приводящую к трансмуральному градиенту напряжения, который проявляется на ЭКГ подъемом сегмента ST. Вследствие указанных выше процессов образуется «уязвимое окно», во время которого может возникнуть механизм re-entry, запускающий ЖТ и ФЖ.
Клинические особенности и диагностика
Чаще всего синдром Бругада наблюдается у пациентов в 30–40-летнем возрасте. Клиническая картина заболевания характеризуется частым возникновением синкопе на фоне приступов желудочковой тахикардии и ВСС, преимущественно во сне, а также отсутствием признаков органического поражения миокарда.
Выраженность клинических проявлений СБ определяется степенью повреждения натриевых каналов: при повреждении менее 25 % каналов ЭКГ-паттерн и нарушения ритма наблюдаются только после введения блокаторов натриевых каналов; при увеличении количества поврежденных натриевых каналов (свыше 25 %) риск ВСС резко возрастает.
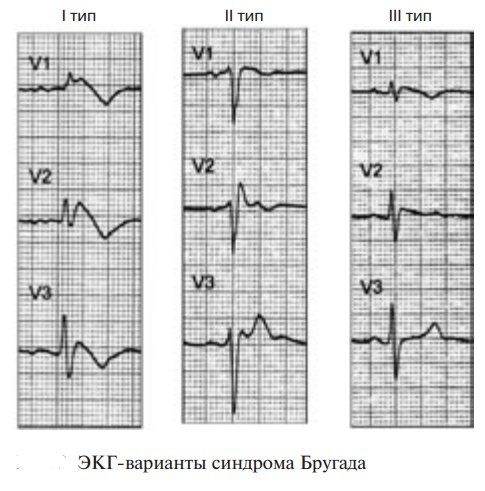
Описаны два типа подъема сегмента ST при синдроме Бругада: сводчатый (coved) и седловидный (saddleback). Подъем сводчатого типа преобладает при симптомных формах СБ с фибрилляцией желудочков в анамнезе, в то время как седловидный чаще встречается при бессимптомных формах СБ. Однако изменения на ЭКГ при СБ могут носить преходящий характер, что требует поиска дополнительных методов верификации. Для верификации диагноза необходимо проведение нагрузочных проб с лекарственной нагрузкой (антиаритмические препараты IA класса) с введением блокаторов натриевых каналов (аймалин, новокаинамид). Тест с блокаторами натриевых каналов проводится в условиях реанимационного отделения, так как во время его проведения существует большая вероятность развития желудочковой тахикардии по типу TdP и ФЖ.
Лечение
Лечение проводят с учетом клинических особенностей заболевания и характера генетических нарушений (дефект Na-каналов). При наличии клинических симптомов больным необходима имплантация кардиовертера-дефибриллятора.
Из антиаритмических препаратов необходимо назначать хинидин, дизопирамид, амиодарон. Следует избегать назначения препаратов I класса, таких как новокаинамид, флекаинид, аймалин, которые являются блокаторами натриевых каналов и провоцируют клиническое проявление синдрома Бругада.
Еще один препарат, рассматриваемый для лечения СБ — тедисамил, который в настоящее время используется для лечения фибрилляции предсердий. Он способен подавлять механизм развития СБ путем блокирования Itо, и может оказаться более эффективным, чем хинидин.
Анестезиологическое пособие у больных СБ
У больных с подтвержденным диагнозом СБ необходимо осторожно подходить к выбору метода анестезии. Исходя из механизмов развития СБ, предпочтительным методом является общая анестезия. Успешно используется как ингаляционная анестезия (изофлюран, севофлюран), так и неингаляционная (барбитураты, мидазолам, фентанил). С осторожностью следует применять пропофол (риск синдрома инфузии пропофола) и кетамин (риск манифестации СБ).
Регионарная анестезия у больных СБ имеет свои особенности и используется реже ввиду возможных осложнений. Прежде всего анестезиолог должен определиться с препаратами для местной анестезии. Наиболее приемлемыми являются местные анестетики короткого действия, такие как лидокаин. Использование препаратов длительного действия (бупивакаин) неоправданно ввиду их способности длительно блокировать Na-каналы, что может вызвать серьезные осложнения. Немаловажным фактором успеха является снижение дозы анестетика. Достичь этого можно двумя путями — использовать адъювант (адреналин, фентанил) или проводить катетеризацию неврального ложа под контролем УЗИ.
Вне зависимости от выбранного метода анестезии необходимо тщательно подойти к вопросу интраоперационного мониторинга. Операционная должна быть оборудована кардиомонитором (для регистрации ЭКГ), BiS-монитором (для оценки глубины наркоза, т. к. недостаточная аналгезия может привести к повышению тонуса вегетативной нервной системы, что в свою очередь может спровоцировать фибрилляцию желудочков), а также дефибриллятором на случай возникновения осложнений.
Источники
Медицинские интернет-конференции
Языки
Внезапная сердечная смерть
Резюме
Ключевые слова
Обзор
Наиболее распространенными электрофизиологическими механизмами, ведущими к ВСС являются тахиаритмии, такие как фибрилляция желудочков (ФЖ) или желудочковая тахикардия (ЖТ).
Есть несколько факторов на органном (например, дисбаланс вегетативного тонуса), тканевом (механизм re-entry, обрыв волны, и альтернация потенциала действия), клеточном (триггерная активность и автоматизм) и субклеточном (аномальные активации или деактивации ионных каналов) уровнях, участвующих в формировании ЖТ или ФЖ в различных условиях 4. Анатомический или функциональный блок в ходе распространения импульса может создать контур с циркуляцией волны по нему, что приводит к ЖТ.
Другие механизмы, такой как обрыв волны участвуют в формировании ФП из ЖТ. В то время, как на тканевом уровне вышеупомянутые механизмы re-entry и обрыв волны являются наиболее важными, известны механизмы ЖТ и ФЖ повышения уровня клеточной возбудимости или уменьшения реполяризации дополнительных (резервных) кардиомиоцитов, что может привести к эктопической активности, способствуя развитию ЖТ и ФЖ.
Примерно 20-30% пациентов с зарегистрированными случаями ВСС, перенесли брадиаритмию или асистолию. Часто трудно определить с уверенностью инициирующее событие у пациента с брадиаритмией, потому что асистолия и электромеханическая диссоциация могут быть следствием устойчивой ЖТ. Реже начальная брадиаритмия, обусловленная ишемией миокарда, может затем вызвать ЖТ или ФЖ.
В большинстве случаев ВСС возникает у пациентов со структурными аномалиями сердца [7,8]. Инфаркт миокарда (ИМ) и постинфарктное ремоделирование сердца являются наиболее распространенными структурными аномалиями среди пациентов с ВСС. У больных, которые перенесли инфаркт миокарда, наличие преждевременных желудочковых сокращений (ПЖС), особенно сложных форм, таких как полиморфные желудочковые экстрасистолы (ЖЭ), короткие интервалы связывания (феномен R-на-T), или ЖТ залпами 3 или более эктопических сокращений, отражают повышенный риск ВСС.
Реже ВСС возникает у больных, которые не имеют очевидной структурной патологии сердца [9,10]. Подобные состояния, как правило, относятся к синдромам аритмий, передаваемым по наследству.
Хотя многие пациенты имеют анатомические и функциональные сердечные субстраты, которые предрасполагают к развитию желудочковых аритмий, только у небольшого процента этих больных возникает ВСС. Выявление пациентов с риском ВСС остается проблемой.
Наиболее известным предиктором ВСС является значительная дисфункция левого желудочка (ЛЖ) любой этиологии [8,11-13]. Взаимосвязь между региональной ишемией, дисфункцией ЛЖ и транзиторными состояниями (например, прогрессирование ишемии, ацидоз, гипоксемия, напряжение стенок, медикаменты, нарушения обмена веществ) была предложена как основа ВСС.
В США ВСС составляет около 325 000 смертей в год. По причине ВСС возникает больше смертей, чем в связи с раком легких, раком молочной железы, или СПИДом. Частота случаев среди взрослого населения составляет 0,1-0,2% в год. ВСС часто является первым проявлением заболевания коронарных артерий и причиной примерно 50% случаев смерти от ИБС.
В некоторых исследованиях, было отмечено снижение частоты внебольничной остановки сердца за последние 2 десятилетия, но доля внезапных смертей вследствие ИБС в США не изменилась.
Частота ВСС в западных индустриальных странах такая же, как в США. Частота ВСС в других странах колеблется, как показатель распространенности ишемической болезни сердца и других часто встречающихся кардиомиопатий у этих групп населения. Тенденция к увеличению случаев ВСС в развивающихся странах мира, как полагают, отражает изменения в питание и образе жизни в этих странах. Было подсчитано, что ВСС отнимает более 7 000 000 жизней в год во всем мире.
У большинства людей, перенесших ВСС, дальнейшая выживаемость зависит от наличия поблизости людей, которые являются компетентными в выполнении реанимационных мероприятий, быстрого прибытия медицинского персонала и наличия в близи устройств для дефибрилляции, успешного выполнения мер по поддержанию жизнеобеспечения и транспортировку в больницу.
Даже в идеальных условиях, только 20% больных с внегоспитальной остановкой сердца доживают до выписки. По результатам исследования, проведенного в Нью-Йорке, среди пациентов с внебольничной остановкой сердца, этот показатель составляет 1,4%. Другие исследования в пригородных и сельских районах показали более высокую частоту выживаемости (свыше 35%).
Размещение автоматических наружных дефибрилляторов во всех общественных местах и обучение людей их использованию может способствовать значительному улучшению прогноза ВСС.
Большинство исследований приводят неубедительные данные в отношении расовых отличий касательно частоты случаев внезапной смерти. Некоторые исследования показали, что большая часть коронарных смертей была «внезапной» у чернокожей расы, по сравнению с белокожей.
Мужчины имеют более высокий риск ВСС, чем женщины в соотношении 3:1. Это соотношение в целом отражает более высокую частоту ИБС у мужчин. Последние данные свидетельствуют о том, что причина в гендерных отличиях связана с тем, что мужчины, как правило более склонны к разрыву ишемической бляшки, а женщины к поверхностной эрозии бляшки.
Частота случаев ВСС соотносится с заболеваемостью ИБС. И пик ВСС приходится на людей в возрасте 45-75 лет. Частота ВСС увеличивается с возрастом у мужчин, женщин, белокожих и не белокожих так же, как и распространенность ИБС увеличивается с возрастом. Тем не менее, доля смертей, которые относятся к внезапным в связи с болезнями коронарных артерий уменьшается с возрастом. В исследовании Framingham, доля внезапных смертей вследствие ИБС, составила 62% у мужчин в возрасте 45-54 лет, но этот процент снизился до 58% у мужчин в возрасте 55-64 лет и 42% у мужчин в возрасте 65-74 лет.
Тщательный сбор анамнеза у пациента, членов семьи или других свидетелей необходим, чтобы получить представление о событиях, связанных с внезапной смертью. Пациенты с риском развития ВСС могут жаловаться на боль в груди, усталость, сердцебиение, и другие неспецифические жалобы. Анамнез и связанные с ним симптомы, в какой-то степени зависят от основной этиологии ВСС. Например, ВСС у пожилого пациента с выраженной ИБС может быть связан с предшествующей болью в груди вследствие ИМ, в то время как ВСС в молодом возрасте может быть связано с наличием в анамнезе синкопальных состояний. Более 45% лиц, имеющих ВСС наблюдались у врача в течение 4 недель до смерти, хотя у 75% из них жалобы не были связаны с сердечно-сосудистой системой. Дисфункции ЛЖ в анамнезе (фракция выброса 45) генов, кодирующих белки саркомера сердечной мышцы. Среди описанных генетических аномалий, большинство случаев составляют мутации в генах, кодирующих тяжелые цепи бета-миозина и сердечного тропонина Т. Другие мутации могут включать в себя мутации генов, кодирующих тяжелые MYH6 цепи альфа-миозина, сердечного тропонина С (TNNC1), альфа-тропомиозина (TPM1), миозин-связывающего белка-C (MYBPC3), сердечного тропонина (TNNI3), эфирных и регуляторных генов легких цепей (MYL3 и MYL2, соответственно), гена сердечного альфа-актина (АКТС) и тайтина (TTN). Частота ВСС в этой группе населения составляет 2-4% в год среди взрослого и 4-6% в год у детей и подростков. ГКМП является наиболее распространенной причиной ВСС среди людей моложе 30 лет.
Подавляющее большинство молодых людей, умерших от ГКМП, не предъявляли никаких жалоб (бессимптомны) [19]. Пациенты могут перенести ВСС во время отдыха или при умеренной физической нагрузке, однако, в большинстве случаев, ВСС возникает после значительной физической нагрузки. ГКМП является единственной причиной ВСС у молодых спортсменов и, следовательно, основным признаком, который выявляют во время физикального обследования спортсмена.
Механизм возникновения ВСС при ГКМП не до конца понят. Первоначально считалось, что имеется связь с обструкцией выходного тракта в результате действия катехоламинов. Однако, более поздние исследования предположили, что пациенты с необструктивными формами ГКМП также находятся в группе высокого риска ВСС, главным образам, связанного с ЖТ или ФЖ. Механизм аритмии в этом случае неясен, и гипертрофия у этих больных может быть частью ремоделирования сердца, что обеспечивает субстрат для смертельной аритмии.
Аритмогенная дисплазия правого желудочка (АДПЖ)
АДПЖ характеризуется заменой стенки ПЖ фиброзной тканью. Вовлечение в процесс межжелудочковой перегородки и левого желудочка ухудшает прогноз [20].
В 30-50% случаев наблюдаются фенотипически очевидные семейные расстройства. Несколько генетических дефектов, в том числе мутации в локусе домена десмоплакина в 6-й хромосоме и локуса рецепторов рианодина в 1-й хромосоме, ассоциированы с ВСС. Опять же, интерстициальный фиброз играет важную роль в развитии желудочковой аритмии. Аутосомно-доминантный тип наследования является обычным явлением, но аутосомно-рецессивные случаи передачи характерны только для определенных (отдельных) мутаций. Аутосомно-рецессивная форма, болезнь Наксона (названа в честь греческого острова), обнаружена в географически изолированном районе преимущественно в странах Средиземноморья и, как правило, связана с обильным оволосением, кератодермией ладоней и подошв или аналогичными заболеваниями кожи. Это заболевание связано с мутацией в гене плакоглобина, белка, участвующего в клеточной адгезии, найденного в 17p хромосоме.
Мужчины больше подвержены аритмогенной дисплазии ПЖ, чем женщины. Годовой показатель заболеваемости ВСС в этой группе населения составляет около 2%. У пациентов могут быть признаки и симптомы гипертрофии и дилатации ПЖ, часто устойчивая мономорфная или полиморфная ЖT из левой ножки пучка Гиса с отрицательной осью обычно между 90-100 °
До появления хирургического лечения клапанных пороков сердца, ВСС была довольно широко распространена у пациентов с прогрессирующим стенозом аортального клапана.
В исследовании, проведенном Chizner среди 42 пациентов с изолированным аортальным стенозом, которые не были подвергнуты замене клапана, 56% смертей были внезапными при периоде наблюдения в 5 лет [21]. Из этих 42 пациентов, 32 – были симптоматическими и 10 были бессимптомными. Механизм внезапной смерти был не определен, но было доказано влияние злокачественной желудочковой аритмии и брадиаритмии.
Частота ВСС значительно снизилась с появлением возможности замены аортального клапана. Тем не менее, аортальный стеноз по-прежнему является второй наиболее распространенной причиной смерти в послеоперационном периоде в этой группе населения, особенно в случае протезирования и замены аортального клапана. Частота ВСС после протезирования аортального клапана наиболее высока в первые 3 недели после процедуры, а затем риск снижается в течение 6 месяцев наблюдения.
Другие поражения клапанов сердца
Риск ВСС значительно ниже при остальных заболеваниях клапанов по сравнению с аортальным стенозом [22,23]. Недостаточность аортального клапана, как правило, сочетается с признаками сердечной недостаточности и прогрессирующей дилатацией ЛЖ. В рамках этого процесса, в желудочке могут развиться эктопические или очаги ре-ентри, и в конечном итоге привести к симптоматической желудочковой аритмии. После замены клапана, можно прогнозировать уменьшение напряжения стенки ЛЖ и риска аритмии.
Митральный стеноз становится все менее распространённым в Соединенных Штатах из-за широкого использования антибиотиков в начальных стадиях развития стрептококковой инфекции. ВСС по причине митрального стеноза встречается редко.
Пациенты с пролапсом митрального клапана (ПМК) имеют низкий риск развития ВСС. ПМК встречается в 5-7% случаев от общего числа населения. Клинически значимый ПМК увеличивает риск ВСС, судя по общей смертности. По оценкам Kligfield, частота внезапной смерти зависит от наличия симптомов и тяжести митральной регургитации [24]. Желудочковые тахиаритмии являются наиболее частой формой аритмии, встречающейся у пациентов, перенесших ВСС. Факторы риска ВСС, рассматриваемые у таких больных включают семейный анамнез по ВСС, эхокардиографические данные значительной митральной регургитации, расстройства реполяризации и удлинение интервала QT (> 420 мс у женщин и> 450 мс у мужчин).
Врожденные пороки сердца
В детском и подростковом возрасте, ВСС происходит с частотой 1,3-8,5 случаев на 100 000 пациентов в год, что составляет примерно 5% всех случаев смерти в этой группе. Причины ВСС гораздо разнообразнее у детей, чем у взрослых. При рассмотрении 13 исследований с участием 61 детей и подростков с ВСС, Дрисколл обнаружил, что 50% случаев были связаны с ГКМП, 25% были связаны с аномальным развитием левой коронарной артерии, остальные пациенты имели аортальный стеноз.
Ниже представлена классификация ВСС в педиатрии.
У больных с известным, ранее диагностированным врожденным пороком сердца, аномалии, связанные с ВСС включают в себя следующие:
• Транспозиция магистральных артерий,
• Пролапс митрального клапана,
• Синдром гипоплазии левых отделов сердца,
• Врожденная блокада сердца,
У больных с известной, ранее диагностированной болезнью сердца, приобретенные причины ВСС включают следующие:
• ДКМП или миокардит,
У пациентов с ранее не выявленным сердечно-сосудистых заболеванием, которые имеют структурную патологию сердца, причины ВСС включают следующее:
• Врожденные аномалии коронарных артерий
• Аритмогенная кардиомиопатия ПЖ
У больных с ранее не выявленной болезнью сердца, которые не имеют структурных заболеваний сердца, причины ВСС включают следующее:
• синдром удлиненного интервала QT,
• Первичная желудочковая тахикардия и фибрилляция желудочков,
• Первичная легочная гипертензия,
Другие причины внезапной смерти
Еще две причины ВСС, заслуживают внимания.
Легочная эмболия является частой причиной внезапной смерти у людей группы риска. К факторам риска относятся предшествующий или семейный анамнез тромбоэмболии глубоких вен, злокачественные опухоли, гиперкоагуляционный статус и недавние механические травмы, такие как перелом бедра или колена.
Расслоение аорты или разрыв аневризмы является другой основной причиной внебольничной неаритмогенной сердечно-сосудистой смерти. Предрасполагающие факторы для расслоения аорты включают генетические дефекты коллагена, такие как синдром Марфана, синдром Элерса-Данло и кистозный медиальный некроз аорты.
Для дифференциальной диагностики необходимо:
· Раннее выявление и лечение больных с ИБС. Важность этого факта не может быть переоценена, так как более 80% случаев ВСС возникает на фоне ИБС.
· Использование адекватной медикаментозной терапии ИБС (например, бета-блокаторов)
· Важно привлечение специалиста по сердечно-сосудистым заболеваниям при уходе за пациентами с симптомами ИБС, клапанного поражения или сложных аритмий.
· Очень важно рассказать пациентам о последствиях несоблюдения медикаментозной терапии.
Дифференциальный диагноз проводят с такими заболеваниями, как:
1. Аортальный стеноз,
2. Дилатационная кардиомиопатия,
3. Гипертрофическая кардиомиопатия,
4. Атеросклероз коронарных артерий,
5. Аномалия Эбштейна,
6. Синдром Lown-Ganong-Levine,
7. Инфаркт миокарда,
10. Аритмия по типу «пирует»,
11. Преждевременные желудочковые сокращения,
12. Желудочковая тахикардия,
13. Синдром Вольфа-Паркинсона-Уайта.
• Сердечные ферменты (креатинкиназы, миоглобин, тропонин). Повышение уровней этих ферментов может указывать на ишемию и инфаркт миокарда. Степень повреждения миокарда, как правило, может коррелировать с уровнем увеличения содержания указанных ферментов. Пациенты в постинфарктном периоде имеют высокий риск развития аритмии.
• Электролиты, кальций и магний. Тяжелый метаболический ацидоз, гипокалиемия, гиперкалиемия, гипокальциемия, гипомагниемия – вот некоторые состояния, которые могут увеличить риск аритмии и внезапной смерти.
• Количественное содержание лекарственных препаратов (хинидин, прокаинамид, трициклические антидепрессанты, дигоксин). Дозировка лекарственных средств выше уровня терапевтического индекса приводит к проявлению проаритмического эффекта. Субтерапевтические уровни этих препаратов применяются у больных специфическими сердечными заболеваниями, что также проводит к увеличению риска развития аритмии. Большинство антиаритмических препаратов обладают проаритмическим эффектом.
• Тиреотропный гормон. Гипертиреоз может привести к тахикардии и тахиаритмии. При длительном применении, он также может привести к сердечной недостаточности. Гипотиреоз может привести к пролонгации интервала QT.
• Мозговой натрийуретический пептид (МНП) (BNP). МНП имеет прогностическое значение, особенно у постинфарктных больных и пациентов с сердечной недостаточностью. Хотя прогноз предварительный и не окончательный, появляющиеся данные подтверждают мнение о том, что повышенный уровень МНП может предоставить прогностическую информацию в отношении риска ВСС, независимо от клинической информации и ФВ ЛЖ.
• Рентгенография грудной клетки может определить, имеется ли застойная сердечная недостаточность. Она также может показать признаки предполагаемого увеличения ЛЖ или ПЖ. Признаки легочной гипертензии также могут быть очевидны на рентгенограмме грудной клетки.
• Эхокардиография. Двухмерная эхокардиография с допплеровским режимом имеет важное значение в оценке ВСС [25]. Множество исследований показывают, что использование 2-мерной эхокардиографии для оценки дисфункции стенки ЛЖ после острого инфаркта (с помощью индекса оценки движения ЛЖ) используется в прогнозирования риска развития основных сердечно-сосудистых событий, в том числе внезапной смерти. Пациентов, перенесших инфаркт миокарда, со снижением фракции выброса и прогрессированием дисфункции стенки ЛЖ по данным эхокардиографии, было предложено включать в группу высокого риска сердечной смерти.
• Электрокардиограмма: это исследование показано всем пациентам. Позволяет выявить следующие признаки: удлинение интервал QT, укорочение интервал QT, эпсилон волны, признак Бругада, укороченный PR, картина синдрома ВПУ или другие 29.
• ЭКГ с усредненным сигналом (SAECG) по различным сообщениям, используется при анализе пациентов с ВСС. Наиболее информативной является анализ зубца Т (аlternans) у пациентов с ЖТ,ФЖ и/или ВСС. Небольшие изменения в амплитуде зубца Т не обнаруживаются на ЭКГ в 12 отведениях. МкВ зубца Т alterans (MTWA) усиливает изменения и может использоваться в прогнозировании риска ВСС. MTWA по-видимому, имеет высокую отрицательную прогностическую ценность риска ВСС у пациентов с низкой фракцией выброса левого желудочка ( 35%, предполагая, что MTWA может рассматриваться в качестве средства для выявления пациентов с риском ВСС. Тем не менее, необходимы дальнейшие исследования, чтобы определить преимущества и недостатки изолированного применения MTWA или, возможно, в сочетании с другими электрофизиологическими методами, для стратификации риска пациентов в отношении ВСС.
• Генетическое тестирование: значение генетического тестирования по-прежнему оценивается при таком состоянии, как врожденное удлинение интервала QT и ГКМП. Некоторые исследования рекомендуют тестирование родных братьев и сестер, близких родственников людей, перенесших ВСС.
Катетеризацию сердца проводят пациентам, которые перенесли ВСС для оценки функции левого желудочка, степени тяжести и распространения ИБС. Количество сосудов с тяжелой обструкции и степень дисфункции ЛЖ являются важными факторами в прогнозировании сердечных событий. Фракция выброса является лучшим предиктором значимых сердечно-сосудистых событий и выживания. Коронарная ангиография может также помочь определить коронарные аномалии и другие формы врожденных пороков сердца. Ангиография проводится с целью выявления пациентов, которым необходимо выполнение реваскуляризации.
Электрофизиологическое исследование (ЭФИ)
У целевых пациентов, ЭФИ имеет диагностическое, прогностическое и терапевтическое значение. ЭФИ обычно выполняется после диагностики ишемического и структурного заболевания сердца 31. Это исследование используется для дифференциальной диагностики у пациентов индуцируемых и не индуцируемых форм устойчивой мономорфной ЖТ. Наличие индуцируемой устойчивой ЖТ в начале заболевания, или когда пациент принимает антиаритмические препараты, дает более высокий риск внезапной смерти. Значительное снижение функция левого желудочка также было обнаружено у пациентов с индуцируемой устойчивой ЖТ. Индуцибельная ЖТ из ножек пучка Гиса может повторяться и наблюдаться у пациентов с ДКМП и в послеоперационном периоде после протезирования клапанов. Более 20% пациентов с ГКМП имеют индуцированную устойчивую мономорфную ЖТ.
Сердечно-легочная реанимация (СЛР) (ACL): в случае остановки сердца, рекомендовано немедленное осуществление мероприятий СЛР. В настоящее время широкое внимание привлекают публикации по обучению СЛР с акцентом на раннее использование дефибрилляции работниками государственных служб (например, полиция, пожарные, авиационный персонал). С помощью подобных мер, можно достичь улучшения здоровья населения в борьбе с повторными случаями внезапной смерти. В 2010 году Американская Ассоциация Сердца опубликовала новые рекомендации по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи.
2009 Саммит Американской Ассоциации Сердца по выживаемости больных, перенесших ВСС выпустила на основе консенсуса рекомендации по оптимизации лечения пациентов с внебольничной (ВВСС). Эти рекомендации включают сбор национальных данные о ВВСС и локальные изменения.
Первичная сердечно-легочная реанимация
Berdowski и его коллеги в недавнем крупном исследовании показали, что использование автоматизированных наружных дефибрилляторов может сократить время дефибрилляции от 11 минут до 4,1 минут, снизить последствия неврологических нарушений и улучшить выживаемость к моменту выписки с 14,3% до 49,6%. Это наблюдение согласуется с уже известными фактами, что основными механизмами инициирования ВСС являются ЖТ и ФЖ, и, что время фибрилляции представляет важный фактор в восстановлении ритма.
Вывод, который можно сделать из приведенных выше исследований: немедленный непрямой массаж сердца и дефибрилляция являются наиболее важными мерами по улучшению исхода внезапной остановки сердца, в то время как вентиляция не играет такую же важную роль.
Тщательный постреанимационный уход имеет важное значение для выживания пациентов, так как у таких больных имеется риск повторной внутригоспитальной остановки сердца (около 50% больных после перенесенной ВСС). Результаты рандомизированных исследований подтверждают необходимость лечения ишемии миокарда, сердечной недостаточности и электролитных нарушений после многочисленных приступов острого инфаркта миокарда и сердечной недостаточности. Эмпирическое назначение бета-блокаторов является разумным во многих случаях. Антиаритмические препараты, в том числе амиодарон, не должны вытеснять ИКД, потому что пока пациент находится в больнице контроль рецидива ЖТ не требуется.
Эта манипуляция уменьшает неврологические повреждения, обусловленные ишемией мозга во время остановки сердца и реперфузией, связанной с реанимацией.
Есть несколько способов, благодаря которым терапевтическая гипотермия может предупреждать неврологические повреждения, включая снижение скорости метаболизма и потребления кислорода в мозге, ингибирование глутамата и допамина, предотвращение окислительного влияния и апоптоза. Таким образом, терапевтическую гипотермию следует рассматривать для пациентов, которые были успешно реанимированы после внезапной остановки сердца и которые находятся в коматозном состоянии.
Выше указанная терапия противопоказана следующим пациентам: у которых температура барабанной перепонки ниже 30 ° C, которые были в коме, прежде чем перенести ВОС, беременным, с наследственными нарушениями свертываемости крови, и неизлечимо больным.
Существует два основных метода индукции терапевтической гипотермии: поверхностный метод охлаждения и метод охлаждения активной зоны с использованием холодных внутривенных жидкостей.
Первичная профилактика внезапной сердечной смерти
Несколько исследований оценили использование профилактических ИКД у пациентов, которые не имеющих в анамнезе ВСС, но входящих в группу с высоким риском. Первое из них, многоцентровое исследование имплантации автоматического дефибриллятора Trail (MADIT) показало, что у пациентов с ишемической кардиомиопатией (ФВЛЖ ≤35%) и индуцируемой, но не купируемой ЖТ имплантация ИКД увеличивала выживаемость [33].
После этого было проведено исследование MADIT-2, продемонстрировавшее, что пациенты, перенесшие инфаркт миокарда, с фракцией выброса левого желудочка ≤30% имеют большую пользу от имплантации ИКД [34]. Исследование, целью которого была оценка лечения неишемической кардиомиопатии с помощью дефибрилляторов показало, что имплантация ИКД уменьшает риск ВСС в популяции пациентов с неишемической кардиомиопатией (ФВ ЛЖ В среднем: