что такое всп в медицине
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
Ввиду особенностей антенатальной гемодинамики, кровообращение развивающегося плода при врожденных пороках сердца, как правило, не страдает. Врожденные пороки сердца проявляются у детей сразу после рождения или через какое-то время, что зависит от сроков закрытия сообщения между большим и малым кругами кровообращения, выраженности легочной гипертензии, давления в системе легочной артерии, направления и объема сброса крови, индивидуальных адаптационных и компенсаторных возможностей организма ребенка. Нередко к развитию грубых нарушений гемодинамики при врожденных пороках сердца приводит респираторная инфекция или какое-либо другое заболевание.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Что такое всп в медицине
а) Терминология. Структуры цистерн мостомозжечкового угла (ММУ) и внутреннего слухового прохода (ВСП) вкпючают лицевой нерв (ЧН VII), преддверно-улитковый нерв (ЧН VIII) и петлю передней нижней мозжечковой артерии (ПНМА). В этой статье также рассматриваются костный ВСП, гребни его дна (вертикальный и горизонтальный) и его переход во внутреннее слуховое отверстие.
б) Эмбриология. Процесс формирования височной кости включает в себя три отдельных эмбриологических этапа: (1) формирование наружного и среднего уха, (2) формирование внутреннего уха, и (3) формирование ВСП. Практическим следствием этих трех родственных, но, при этом, обособленных эмбриологических событий является то, что наличие или отсутствие ВСП не зависит от процесса развития внутреннего, среднего или наружного уха.
ВСП развивается в ответ на формирование и миграцию лицевых и преддверно-улитковых нервов через эту область. Размер ВСП зависит от количества мигрирующих нервных пучков. Чем меньше размеры нервных пучков, тем меньше размеры ВСП. Если ВСП имеет очень маленькие размеры, и в нем визуализируется только один нерв, им обычно является лицевой нерв.
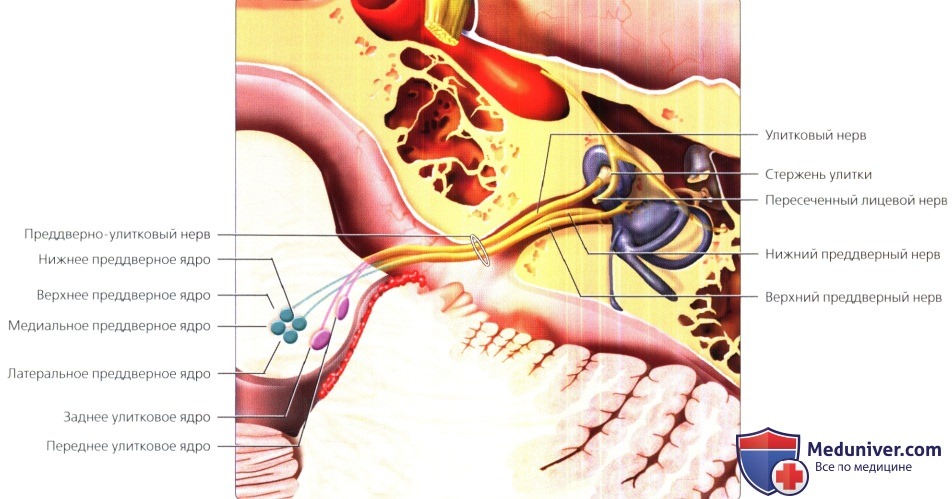
Центральные волокна идут в составе улиткового нерва в заднее и переднее улитковые ядра, расположенные в латеральном крае нижней ножки мозжечка.
Нижний и верхний преддверные нервы берут свое начало от тел нейронов преддверного ганглия; оттуда они направляются центрально к четырем вестибулярным ядрам. 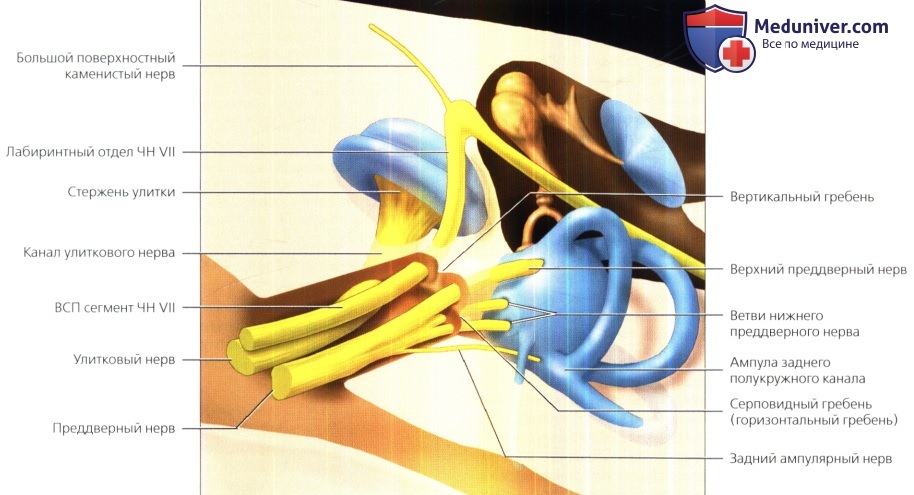
Обратите внимание, что в среднем отделе ВСП имеются четыре основных нерва: лицевой, улитковый, верхний преддверный и нижний преддверный нервы.
Ветви заднего ампулярного нерва отходят от нижнего преддверного нерва по середине ВСП на пути к ампуле заднего полукружного канала.
Несколько ветвей нижнего преддверного нерва, как и верхний преддверный нерв, пронзают решетчатое пятно на своем пути к преддверию.
в) Лучевая анатомия улитки, внутреннего слухового прохода (ВСП) и мостомозжечкового угла (ММУ). Улитковая часть преддверно-улиткового нерва начинается в стержне улитки, где располагается биполярный спиральный ганглий. Аксоны, располагающиеся дистальнее, достигают кортиевого органа в средней лестнице. Аксоны, располагающиеся проксимально, объединяются и формируют на дне МВК собственно улитковый нерв.
ЧН VIII в цистернах ВСП и ММУ состоит из преддверной (положение тела в пространстве) и улитковой (слух) частей. Улитковый нерв располагается в передненижнем квадранте ВСП. В области слухового отверстия, улитковый нерв объединяется с верхним и нижним преддверными нервными пучками, формируя в цистерне ММУ преддверно-улитковый нерв.
ЧН VII находится в передневерхнем квадранте, тогда как улитковый нерв локализуется в передненижнем квадранте. Учитывая эту информацию, можно запомнить, что верхний преддверный нерв (ВПН) располагается сзади и сверху, а нижний преддверный нерв (НПН) располагается сзади и снизу.
Следует помнить, что к другим нормальным структурам, расположенным ВСП, относятся горизонтальный гребень (crista falciformis) и вертикальный гребень («перегородка Билла»), Горизонтальный гребень-медиально расположенный горизонтальный костный выступ на дне ВСП, отделяющий ЧН VII от ВПН выше улиткового нерва и ниже НПН. Вертикальный гребень располагается между ЧН VII И ВПН вдоль верхней стенки костного дна. Горизонтальный гребень можно легко увидеть как в костном окне на КТ, так и при высокоразрешающей МРТ. Вертикальный гребень легче визуализировать в костном окне.
Имеется большое количество отверстий и каналов, соединяющих дно ВСП с внутренним ухом. Самым крупным является расположенный спереди и снизу канал улиткового нерва, через который улитковый нерв проходит из стержня улитки на дно ВСП. Кпереди и кверху в лабиринтную часть канала лицевого нерва открывается меатальное отверстие Решетчатое пятно-многочисленно перфорированная костная структура, которая отделяет преддверие внутреннего уха от дна ВСП.
Другие нормальные, не относящиеся к нервным анатомическим структурам, цистерны ММУ, представляющие интерес, включают петлю ПНМА, клочок полушария мозжечка и сосудистое сплетение. ПНМА отходит от основной артерии, идет кверху и кнаружи в цистерну ММУ, а затем направляется в цистерну ВСП. Внутри ВСП от ПНМА отходит внутренняя слуховая артерия. На Т2-ВИ при высокоразрешающей МРТ петля ПНМА, расположенная в цистерне ВСП или ММУ, может имитировать нервный пучок. ПНМА кровоснабжает улитку, клочок полушария мозжечка и переднебоковой участок моста в области ядер ЧН V, ЧН VII и ЧН VIII. Клочок полушария мозжечка-долька мозжечка, которая располагается в задненаружней части цистерны ММУ. Сосудистое сплетение IV желудочка обычно протягивается через отверстие Люшка в цистерну ММУ.
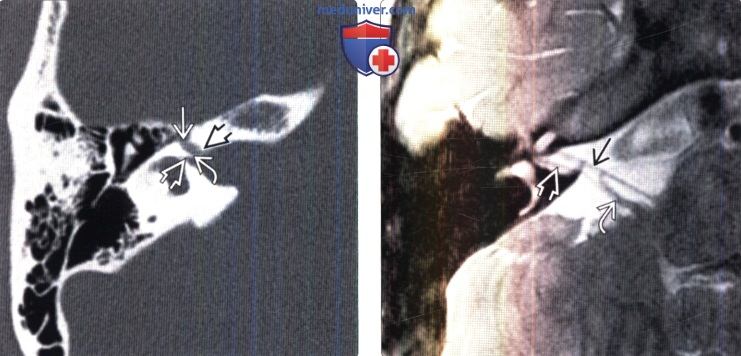
(Справа) МРТ, Т2-ВИ, аксиальный срез через верхний отдел ВСП: визуализируются передне-верхняя часть ЧН VII, верхний преддверный нерв и преддверно-улитковый нерв.
г) Техники визуализации и показания. Главным клиническим показанием к лучевому исследованию ММУ-ВСП является нейросенсорная тугоухость (НСТ). Необходимо соблюдать три основных условия выполнения МРТ при НСТ:
(2) при обнаружении объемного образования необходимо использовать высокоразрешающие Т2-взвешенные последовательности для ответа на предоперационные диагностические вопросы, (3) необходимо исследовать ткань мозга на предмет наличия внутримозговой патологии, такой, как рассеянный склероз.
д) Подходы к вопросам визуализации ММУ-ВСП:
1. Подход к диагностике при нейросенсорной тугоухости у взрослых. МРТ при односторонней НСТ у взрослых пациентов без другой патологии проводится с использованием постконтрастных тонкосрезовых Т1-ВИ области ММУ-ВСП в режиме подавления сигнала от жира. Т2-ВИ помогают в хирургическом планировании при выявлении структурной патологии. Несмотря на проведение в отоларингологических клиниках аудиометрии и исследования методом коротколатентных стволовых вызванных потенциалов выявление при МРТ структурной патологии, вызывающей НСТ, происходит нечасто (
Редактор: Искандер Милевски. Дата публикации: 8.5.2019
Публикации в СМИ
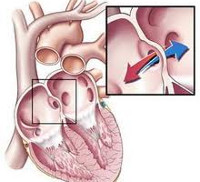
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) — ВПС с наличием сообщения между правым и левым желудочками.
Статистические данные • ДМЖП составляет 9–25% всех ВПС • Выявляют у 15,7% живорождённых детей с ВПС • Как осложнение трансмурального ИМ — 1–3% • 6% всех ДМЖП и 25% ДМЖП у грудных детей сопровождаются открытым артериальным протоком, 5% всех ДМЖП — коарктацией аорты, 2% врождённых ДМЖП — стенозом клапана аорты • В 1,7% случаев межжелудочковая перегородка отсутствует, и такое состояние характеризуют как единственный желудочек сердца • Соотношение мужского и женского пола — 1:1.
Патогенез. Степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются. По мере увеличения ОЛСС возможно изменение направления сброса крови — он начинает происходить справа налево. Без лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения лёгочных сосудов (синдром Айзенменгера).
Варианты ДМЖП • Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно • Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно • Надгребневые (ДМЖП выносящего тракта правого желудочка, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью аортального клапана, самопроизвольно не закрываются • Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с ДМПП типа ostium primum и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается • В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова–Роже) и большие (более 1 см или половина диаметра устья аорты) дефекты.
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки.
• Объективно • Бледность кожных покровов • Борозды Харрисона • Усиление верхушечного толчка, дрожание в области левого нижнего края грудины • Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка • Грубый пансистолический шум у левого нижнего края грудины • При надгребневых ДМЖП — диастолический шум аортальной недостаточности.
Инструментальная диагностика
• ЭКГ: признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии — и правых.
• Яремная флебография: высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация).
• ЭхоКГ •• Гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых •• Визуализация ДМЖП в допплеровском и В-режиме •• Диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.) •• Определяют систолическое давление в правом желудочке, степень сброса крови и Qp/Qs •• Взрослым проводят чреспищеводную ЭхоКГ.
• Рентгенография органов грудной клетки •• При небольших ДМЖП — нормальная рентгенологическая картина •• Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка •• При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
• Радионуклидная вентрикулография: см. Дефект межпредсердной перегородки.
• Катетеризация камер сердца •• Показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных •• Вычисляют Qp/Qs •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии.
• Левая вентрикулография, коронарная ангиография: визуализация и количественная оценка сброса, диагностика ИБС при наличии симптомов или перед операцией.
Медикаментозное лечение. При бессимптомном течении и нормальном давлении в лёгочной артерии (даже при больших дефектах) возможно консервативное лечение до 3–5 лет жизни. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 мес после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Хирургическое лечение
Показания • При бессимптомном течении — если к 3–5 годам жизни не происходит самопроизвольного закрытия дефекта, хотя лучших результатов достигают при оперативном лечении в возрасте до 1 года • Сердечная недостаточность или лёгочная гипертензия у детей младшего возраста • У взрослых отношение Qp/Qs составляет 1,5 и более.
Противопоказания: см. Дефект межпредсердной перегородки.
Методы оперативного лечения. Паллиативное вмешательство — сужение лёгочного ствола манжетой, проводят при необходимости экстренной операции детям с массой тела менее 3 кг, при сопутствующих пороках сердца и малом опыте клиники по радикальной коррекции порока в раннем возрасте. При травматическом дефекте в области мембранозной части межпредсердной перегородки возможно ушивание дефекта. В остальных случаях проводят пластику дефекта заплатой из аутоперикарда или синтетических материалов. При постинфарктном ДМЖП проводят пластику дефекта с одномоментным коронарным шунтированием.
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Прогноз. У 80% пациентов с большими ДМЖП происходит спонтанное закрытие дефекта в течение 1 мес, у 90% — в возрасте до 8 лет, известны единичные случаи спонтанного закрытия ДМЖП в возрасте между 21 и 31 годами. При небольших дефектах продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита (4%). При ДМЖП средних размеров сердечная недостаточность обычно развивается в детском возрасте, тяжёлую лёгочную гипертензию встречают редко. Большие ДМЖП без градиента давления между желудочками в 10% случаев приводят к развитию синдрома Айзенменгера, большинство таких больных умирают в детском или подростковом возрасте. Неотложное хирургическое вмешательство необходимо 35% детей в течение 3 мес после рождения, 45% — в течение 1 года. Материнская смертность во время беременности и родов при синдроме Айзенменгера превышает 50%. При постинфарктном ДМЖП через 1 год при отсутствии хирургического лечения выживают 7% больных. Госпитальная летальность после сужения лёгочной артерии — 7–9%, 5-летняя выживаемость — 80,7%, 10-летняя — 70,6%. Летальность при хирургическом лечении постинфарктных ДМЖП — 15–50%. Госпитальная летальность при закрытии изолированных врождённых ДМЖП с низким ОЛСС — 2,5%, с высоким ОЛСС — менее 5,6%.
Сокращения. Qp/Qs — отношение лёгочного минутного объёма кровотока к системному. ОЛСС — общее лёгочное сосудистое сопротивление.
МКБ-10 • Q21.0 ДМЖП
Код вставки на сайт
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) — ВПС с наличием сообщения между правым и левым желудочками.
Статистические данные • ДМЖП составляет 9–25% всех ВПС • Выявляют у 15,7% живорождённых детей с ВПС • Как осложнение трансмурального ИМ — 1–3% • 6% всех ДМЖП и 25% ДМЖП у грудных детей сопровождаются открытым артериальным протоком, 5% всех ДМЖП — коарктацией аорты, 2% врождённых ДМЖП — стенозом клапана аорты • В 1,7% случаев межжелудочковая перегородка отсутствует, и такое состояние характеризуют как единственный желудочек сердца • Соотношение мужского и женского пола — 1:1.
Патогенез. Степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются. По мере увеличения ОЛСС возможно изменение направления сброса крови — он начинает происходить справа налево. Без лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения лёгочных сосудов (синдром Айзенменгера).
Варианты ДМЖП • Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно • Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно • Надгребневые (ДМЖП выносящего тракта правого желудочка, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью аортального клапана, самопроизвольно не закрываются • Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с ДМПП типа ostium primum и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается • В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова–Роже) и большие (более 1 см или половина диаметра устья аорты) дефекты.
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки.
• Объективно • Бледность кожных покровов • Борозды Харрисона • Усиление верхушечного толчка, дрожание в области левого нижнего края грудины • Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка • Грубый пансистолический шум у левого нижнего края грудины • При надгребневых ДМЖП — диастолический шум аортальной недостаточности.
Инструментальная диагностика
• ЭКГ: признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии — и правых.
• Яремная флебография: высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация).
• ЭхоКГ •• Гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых •• Визуализация ДМЖП в допплеровском и В-режиме •• Диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.) •• Определяют систолическое давление в правом желудочке, степень сброса крови и Qp/Qs •• Взрослым проводят чреспищеводную ЭхоКГ.
• Рентгенография органов грудной клетки •• При небольших ДМЖП — нормальная рентгенологическая картина •• Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка •• При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
• Радионуклидная вентрикулография: см. Дефект межпредсердной перегородки.
• Катетеризация камер сердца •• Показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных •• Вычисляют Qp/Qs •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии.
• Левая вентрикулография, коронарная ангиография: визуализация и количественная оценка сброса, диагностика ИБС при наличии симптомов или перед операцией.
Медикаментозное лечение. При бессимптомном течении и нормальном давлении в лёгочной артерии (даже при больших дефектах) возможно консервативное лечение до 3–5 лет жизни. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 мес после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Хирургическое лечение
Показания • При бессимптомном течении — если к 3–5 годам жизни не происходит самопроизвольного закрытия дефекта, хотя лучших результатов достигают при оперативном лечении в возрасте до 1 года • Сердечная недостаточность или лёгочная гипертензия у детей младшего возраста • У взрослых отношение Qp/Qs составляет 1,5 и более.
Противопоказания: см. Дефект межпредсердной перегородки.
Методы оперативного лечения. Паллиативное вмешательство — сужение лёгочного ствола манжетой, проводят при необходимости экстренной операции детям с массой тела менее 3 кг, при сопутствующих пороках сердца и малом опыте клиники по радикальной коррекции порока в раннем возрасте. При травматическом дефекте в области мембранозной части межпредсердной перегородки возможно ушивание дефекта. В остальных случаях проводят пластику дефекта заплатой из аутоперикарда или синтетических материалов. При постинфарктном ДМЖП проводят пластику дефекта с одномоментным коронарным шунтированием.
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Прогноз. У 80% пациентов с большими ДМЖП происходит спонтанное закрытие дефекта в течение 1 мес, у 90% — в возрасте до 8 лет, известны единичные случаи спонтанного закрытия ДМЖП в возрасте между 21 и 31 годами. При небольших дефектах продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита (4%). При ДМЖП средних размеров сердечная недостаточность обычно развивается в детском возрасте, тяжёлую лёгочную гипертензию встречают редко. Большие ДМЖП без градиента давления между желудочками в 10% случаев приводят к развитию синдрома Айзенменгера, большинство таких больных умирают в детском или подростковом возрасте. Неотложное хирургическое вмешательство необходимо 35% детей в течение 3 мес после рождения, 45% — в течение 1 года. Материнская смертность во время беременности и родов при синдроме Айзенменгера превышает 50%. При постинфарктном ДМЖП через 1 год при отсутствии хирургического лечения выживают 7% больных. Госпитальная летальность после сужения лёгочной артерии — 7–9%, 5-летняя выживаемость — 80,7%, 10-летняя — 70,6%. Летальность при хирургическом лечении постинфарктных ДМЖП — 15–50%. Госпитальная летальность при закрытии изолированных врождённых ДМЖП с низким ОЛСС — 2,5%, с высоким ОЛСС — менее 5,6%.
Сокращения. Qp/Qs — отношение лёгочного минутного объёма кровотока к системному. ОЛСС — общее лёгочное сосудистое сопротивление.