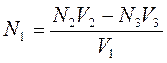что такое реверсивное титрование
Способы титрования



Реакция должна быть практически необратимой, т.е. заканчиваться полным расходованием исходных веществ и иметь большое значение константы равновесия.
При этом не должно образовываться никаких побочных продуктов как вследствие взаимодействия исходных веществ с окружающей средой (например, с кислородом или углекислым газом, содержащимися в воздухе), так и в результате протекания между ними нескольких параллельных реакций.
В реакциях должна точно и быстро фиксироваться точка эквивалентности.
2. Реакция между веществами рабочего и исследуемого растворов должна протекать в строгом стехиометрическом соотношении, соответствующем её химическому уравнению.
4. Реакция должна протекать с достаточной скоростью, т.е. за малый отрезок времени. Наиболее оптимальным в этом случае является время, необходимое для перемешивания одной добавленной капли титранта с объёмом титруемого раствора, т.е. 1-3 секунды.
Если реакция осуществляется медленно, то сложно точно определить наступление точки эквивалентности. При этом также теряется основное достоинство титриметрии – быстрота выполнения анализа и получения результата.
Если химическая реакция не удовлетворяет хотя бы одному из вышеперечисленных требований, она не может быть использована в титриметрическом анализе. Но если ей невозможно найти замену, то такую реакцию пытаются «приспособить» для применения в титриметрии. Например, многие окислительно-восстановительные реакции при обычных условиях протекают медленно, являются обратимыми и многонаправленными, т.е. исходные вещества в них расходуются одновременно по нескольким направлениям. Для устранения данных недостатков изменяют условия проведения реакции. Например, осуществляют её при нагревании или в присутствии катализаторов (это позволяет существенно увеличить скорость реакции), а также в определённой среде: кислой, нейтральной или щелочной (это позволяет устранить обратимость и многонаправленность).
Следует, однако, подчеркнуть, что такое «приспособление» приводит к усложнению метода. Применение его целесообразно идти лишь тогда, когда неизвестна более удобная химическая реакция.
Различают три основных способа титрования: прямое, обратное, косвенное или заместительное.
При прямом титровании используют исследуемый и один рабочий растворы. В процессе определения к определённому точно измеренному объёму одного из них по каплям добавляют второй раствор до наступления точки эквивалентности.
Закон эквивалентов в этом случае может быть математически записан следующим образом:
где V1 и V2 – объёмы израсходованных исследуемого и рабочего растворов, соответственно; N1 и N2— молярные концентрации химических эквивалентов веществ исследуемого и рабочего растворов, соответственно.
Молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитывают по формуле:
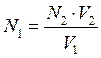
При обратном титровании используют исследуемый и два рабочих раствора, один их которых является вспомогательным, а второй применяют для титрования.
В процессе анализа к определённому точно измеренному объёму исследуемого раствора одномоментно добавляют взятый в избытке фиксированный объём вспомогательного рабочего раствора. В результате протекания химической реакции вещество, присутствующее в исследуемом растворе, расходуется полностью. Не прореагировавший избыток вещества вспомогательного раствора титруется затем вторым рабочим раствором до наступления точки эквивалентности, например:
раствор рабочий раствор
Таким образом, вещество, присутствующее во вспомогательном рабочем растворе, реагирует как с веществом исследуемого раствора, так и с веществом второго рабочего раствора. Закон эквивалентов в этом случае математически может быть записан следующим образом:
где V1, V2, V3 – израсходованные объёмы исследуемого, вспомогательного и второго рабочих растворов, соответственно; N1, N2, N3 – молярные концентрации химических эквивалентов веществ в исследуемом, вспомогательном и во втором рабочих растворах, соответственно.
Молярную концентрацию химического эквивалента рассчитывают по формуле:
Обратное титрование в аналитической практике может называться иначе титрованием по остатку или с двумя титрантами.
Оно используется, если определяемое вещество не реагирует или реагируют медленно с веществом второго рабочего раствора, либо в реакции между ними невозможно определить точку эквивалентности.
При косвенном, или заместительном, титровании также используют исследуемый раствор и два рабочих раствора. В ходе анализа к точно измеренному объёму исследуемого раствора одномоментно добавляют нефиксированный заведомый избыток первого рабочего раствора. В результате протекающей реакции вещество исследуемого раствора полностью расходуется с образованием эквивалентного количества соответствующего продукта реакции, который затем титруется вторым рабочим раствором до наступления точки эквивалентности, например:
исследуемый первый рабочий эквивалентное
раствор раствор кол-во продукта реакции
второй рабочий раствор
Таким образом, мы как бы замещаем определяемое вещество на другое, которое впоследствии и подвергаем анализу.
Так как количество вещества эквивалента образовавшегося продукта и количество вещества эквивалента в исследуемом растворе равны между собой, то молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитываем по такой же формуле, как и при прямом титровании.
Заместительное титрование применяют, когда непосредственное определение вещества в исследуемом растворе невозможно: отсутствует подходящий титрант, нельзя установить точку эквивалентности и т.п.
Аналитическая химия OLD
12.1. Основные понятия титриметрии
Титрование – это процесс определения вещества, при котором к нему постепенно прибавляют небольшие порции реагирующего с ним другого вещества до того момента, пока всё определяемое вещество не вступит в реакцию.
Момент титрования, при котором изменение свойства системы указывает на достижение эквивалент ности, называется конечной точкой титрования (точкой конца титрования ).
12.2. Классификация титриметрических методов анализа и способов титрования
В зависимости от способа выполнения различают:
Если хотя бы одно из перечисленных требований к реакции не выполняется, приходится использовать другие способы титровани я. Так, например, прямое титрование иона NH4 + раствором щёлочи невозможно из-за малой константы равновесия реакции, титрование K2Cr2O7 раствором Na2S2O3 – из-за нестехиометрического протекания реакции и т.д.
Рис. 12.1. Метод отдельных навесок (1) и метод пипетирования (2)
12.3. Стандартные растворы и стандартные вещества
В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом (нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
Расчёты, связанные с приготовлением растворов
Количественный состав раствора можно описывать с помощью безразмерных величин и величин, имеющих размерность. Безразмерные величины иначе называются долями.
Из всех видов долей чаще всего, по крайней мере, в аналитической химии, используется массовая доля.
Доли могут выражаться в процентах. Процент – это не единица измерения, а всего лишь синоним величины «одна сотая».
К размерным величинам, используемым для описания количественного состава растворов, относят концентрации вещества в растворе и моляльность растворённого вещества.
Концентрация – это отношение массы или количества растворённого вещества к объёму раствора.
Массовая доля – это, согласно современному подходу, не концентрация и называть её «процентной концентрацией » не следует. Слово « концентрация » переводится на русский язык как «сосредоточение» и относится к растворённому веществу, а не к раствору, т.е. говорят « концентрация растворённого вещества в растворе», а не « концентрация раствора».
Моляльность растворённого вещества представляет собой отношение количества этого вещества, находящегося в растворе, к массе растворителя. Обозначают моляльность как m(В), b(В), Сm(В). Размерность моляльности – моль/кг. Её используют в тех случаях, когда раствор находится в неизотермических условиях.
Для количественной характеристики стандартных растворов обычно используют молярную концентрацию (вещества или эквивалента вещества). Иногда для этой цели пользуются титром раствора.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный раствор HCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (k), например, в данном случае он равен 1,005.
Пример 12.1. Какой объём раствора HCl с массовой долей растворённого вещества 16,5% и плотностью 1,08 г/мл необходимо взять для получения 500 мл 0,1 М HCl?
Если объём получаемого раствора брать в мл, а массовую долю вещества в исходном растворе в %, то формула для расчёта будет иметь следующий вид:
Расчёты, связанные с титрованием
В основе всех количественных расчётов в титриметрических методах анализа лежит закономерность: количество эквивалента определяемого вещества равно количеству эквивалента титранта
Согласно ИЮПАК эквивалентом называется реальная или условная частица, которая в конкретной кислотно-основной реакции эквивалент на тем или иным образом одному протону или в конкретной окислительно-восстановительной реакции одному электрону.
Понятие « эквивалент » можно применять только к конкретной реакции. Нельзя говорить об эквивалент е вещества вообще.
Аналогично понятиям «количество вещества» и «молярная масса» существуют понятия «количество эквивалента вещества» и «молярная масса эквивалента вещества». Например, в реакции 2 1 моль молекул серной кислоты соответствует 2 моль «половинок молекул» серной кислоты, а M(1/2 H2SO4) = 49 г/моль.
Понятие « эквивалент » отнюдь не является «священной коровой» в химии, а используется всего лишь для облегчения расчётов, так как позволяет проводить их без использования стехиометрических коэффициентов в уравнении соответствующей реакции. Для веществ, у которых формульная единица и эквивалент равны между собой (например, HCl или NaOH при кислотно-основном взаимодействии), лучше вообще не пользоваться понятием эквивалент а.
Пусть нам необходимо найти массовую долю вещества ω(В),% имеющего молярную массу M(В), г/моль, в некотором анализ ируемом объекте, имеющем массу g, г. Для титрования используют раствор с молярной концентрацией эквивалента титранта C(fэквBT). Для титрования израсходовано V’, мл этого раствора.
Пример 12.2. Навеску массой 1,9500 г образца глазной мази, содержащей HgO, поместили в делительную воронку и растворили мазевую основу в 10 мл диэтилового эфира. К образовавшейся смеси прибавили раствор KI, а затем 10,00 мл 0,1045 М HCl. Для титрования избытка кислоты потребовалось 7,00 мл 0,0998 М NaOH. Рассчитайте массовую долю HgO в анализ ируемом образце.
Титриметрический анализ
Лабораторная работа № 8
Цель работы: ознакомиться с основами титриметрического анализа, изучить основные методы и приёмы титрования.
1. Сущность титриметрического анализа. Основные понятия.
Титриметрический (объёмный) анализ является одним из важнейших видов количественного анализа. Его основными достоинствами являются точность, быстрота исполнения и возможность применения для определения самых разнообразных веществ. Определение содержания вещества в титриметрическом анализе осуществляется в результате проведения реакции точно известного количества одного вещества с неизвестным количеством другого, с последующим расчётом количества определяемого вещества по уравнению реакции. Реакция, которая при этом протекает должна быть стехиометрической, т. е. вещества должны реагировать строго количественно, согласно коэффициентам в уравнении. Только при соблюдении этого условия реакция может быть использована для количественного анализа.
Основной операцией титриметрического анализа является титрование – постепенное смешивание веществ до полного окончания реакции. Обычно в титриметрическом анализе используются растворы веществ. В ходе титрования раствор одного вещества постепенно приливается к раствору другого вещества до тех пор, пока вещества полностью не прореагируют. Раствор, который приливают, называется титрантом, раствор, к которому приливается титрант, называется титруемым раствором. Объём титруемого раствора, который подвергается титрованию, называется аликвотной частью или аликвотным объёмом.
Точкой эквивалентности называется момент, наступающий в ходе титрования, когда реагирующие вещества полностью прореагировали. В этот момент они находятся в эквивалентных количествах, т. е. достаточных для полного, без остатка, протекания реакции.
Для титрования применяются растворы с точно известной концентрацией, которые называются стандартными или титрованными. Различают несколько типов стандартных растворов.
Первичным стандартом называется раствор с точно известной концентрацией, приготовленный по точной навеске вещества. Вещество для приготовления первичного стандарта должно иметь определённый состав и быть определённой степени чистоты. Содержание в нём примесей не должно превышать установленных норм. Зачастую для приготовления стандартных растворов вещество подвергается дополнительной очистке. Перед взвешиванием вещество высушивается в эксикаторе над осушающим веществом или выдерживается при повышенной температуре. Навеску взвешивают на аналитических весах и растворяют в определённом объёме растворителя. Полученный стандартный раствор не должен изменять своих свойств при хранении. Стандартные растворы хранят в плотно закрытой посуде. При необходимости их предохраняют от попадания прямых солнечных лучей и воздействия высокой температуры. Стандартные растворы многих веществ (HCl, H2SO4, Na2B4O7 и др.) могут храниться годами без изменения концентрации.
Ввиду того, что подготовка вещества для приготовления стандартного раствора является длительным и трудоёмким процессом, химической промышленностью выпускаются т. наз. фиксаналы. Фиксанал представляет собой стеклянную ампулу, в которой запаяна определённая навеска вещества. Ампулу разбивают, и вещество количественно переносят в мерную колбу, доводя затем объём жидкости до метки. Применение фиксаналов значительно облегчает процесс и сокращает время приготовления стандартного раствора.
Некоторые вещества трудно получить в химически чистом виде (например, KMnO4). Из-за содержания примесей взять точную навеску вещества часто бывает невозможно. Кроме этого, растворы многих веществ при хранении изменяют свои свойства. Например, растворы щелочей способны поглощать углекислый газ из воздуха, в результате чего их концентрация со временем меняется. В этих случаях используют вторичные стандарты.
Вторичным стандартом называется раствор вещества с точно известной концентрацией, которая устанавливается по первичному стандарту. Вторичные стандарты (например, растворы KMnO4, NaOH и т. д.) хранятся при тех же условиях, что и первичные стандарты, но их концентрацию периодически проверяют по стандартным растворам так называемых установочных веществ.
2. Способы и виды титрования.
В процессе титрования аликвотная часть раствора отбирается обычно в колбу, затем к ней из бюретки малыми порциями приливается раствор титранта, до достижения точки эквивалентности. В точке эквивалентности измеряется объём титранта, израсходовавшийся на титрование раствора. Титрование может осуществляться несколькими способами.
Прямое титрование заключается в том, что раствор определяемого вещества А титруют стандартным раствором титранта В. Способом прямого титрования титруют растворы кислот, оснований, карбонатов и т. д.
При реверсивном титровании аликвотную часть стандартного раствора В титруют раствором определяемого вещества А. Реверсивное титрование применяется в том случае, если определяемое вещество неустойчиво при тех условиях, в которых производится титрование. Например, окисление нитритов перманганатом калия происходит в кислой среде.
NO2- + MnO2- + 6H+ ® NO3- + Mn2+ + 3H2O
Но сами нитриты в кислой среде неустойчивы.
2NaNO2 + H2SO4 ® Na2SO4 + 2HNO2
Поэтому стандартный раствор перманганата, подкисленный серной кислотой, титруют раствором нитрита, концентрацию которого хотят определить.
Обратное титрование применяют в тех случаях, когда прямое титрование не применимо: например, из-за очень низкого содержания определяемого вещества, невозможности определить точку эквивалентности, при медленном протекании реакции и т. д. В ходе обратного титрования к аликвотной части определяемого вещества А приливают точно измеренный объём стандартного раствора вещества В, взятый в избытке. Непрореагировавший избыток вещества В определяют титрованием стандартным раствором вспомогательного вещества С. По разности исходного количества вещества В и его количества, оставшегося после протекания реакции, определяют количество вещества В, вступившее в реакцию с веществом А, исходя из которого и рассчитывают содержание вещества А.
Косвенное титрование или титрование по заместителю. Основано на том, что титруют не само определяемое вещество, а продукт его реакции со вспомогательным веществом С.
Вещество D должно образовываться строго количественно по отношению к веществу А. Определив cодержание продукта реакции D титрованием стандартным раствором вещества В, по уравнению реакции рассчитывают содержание определяемого вещества А.
Реакции, которые используются в титриметрическом анализе, должны быть строго стехиометрическими, протекать достаточно быстро и по возможности при комнатной температуре. В зависимости от типа протекающей реакции различают:
Кислотно-основное титрование, в основе которого лежит реакция нейтрализации.
Окислительно-восстановительное титрование, основанное на окисчлительно-восстановительных реакциях.
Комплексонометрическое титрование, основанное на реакциях комплексообразования.
3. Кислотно-основное титрование.
В основе кислотно-основного титрования лежит реакция нейтрализации между кислотой и основанием. В результате реакции нейтрализации образуется соль и вода.
HAn + KtOH ® KtAn + H2O
Реакция нейтрализации протекает при комнатной температуре практически мгновенно. Кислотно-основное титрование применяется для определения кислот, оснований, а также многих солей слабых кислот: карбонатов, боратов, сульфитов, и т. д. При помощи данного метода можно титровать смеси различных кислот или оснований, определяя содержание каждого компонента в отдельности.
При титровании кислоты основанием или наоборот, происходит постепенное изменение кислотности среды, которое выражается водородным показателем рН. Вода представляет собой слабый электролит, который диссоциирует согласно уравнению.
Произведение концентрации ионов водорода на концентрацию ионов гидроксила есть величина постоянная, и называется ионное произведение воды.


В нейтральной среде концентрации водородных ионов и гидроксид-ионов равны и составляют 10-7м/л. Ионное произведение воды остаётся постоянным при добавлении в воду кислоты или основания. При добавлении кислоты увеличивается концентрация ионов водорода, что приводит к сдвигу равновесия диссоциации воды влево, в результате чего концентрация гидроксид-ионов уменьшается. Например, если [H+] = 10-3м./л., то [OH-] = 10-11м./л. Ионное произведение воды останется постоянным.
Если увеличить концентрацию щёлочи, то концентрация гидроксид-ионов увеличится, а концентрация ионов водорода уменьшится, ионное произведение воды также останется постоянным. Например, [OH-] = 10-2, [H+] = 10-12
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода.
Исходя из уравнения (1) можно заключить, что в нейтральной среде рН = 7.
В кислой среде рН 7. Аналогично выводится формула для рОН из уравнения (1).
В ходе кислотно-основного титования с каждой порцией приливаемого титранта изменяется рН раствора. В точке эквивалентности рН достигает определённого значения. В этот момент времени титрование необходимо прекратить и измерить объём титранта, пошедший на титрование. Для определения рН в точке эквивалентности строят кривую титрования – график зависимости рН раствора от объёма прибавляемого титранта. Кривую титрования можно построить экспериментально, измеряя рН в различные моменты титрования, или рассчитать теоретически, используя формулы (2) или (3). Для примера рассмотрим титрование сильной кислоты HCl сильным основанием NaOH.
Таблица 1. Титрование 100мл 0,1М раствора HCl 0,1М раствором NaOH.
nHCl (моль) вступившее в реакцию.
nHCl остающееся в растворе (моль)
По мере прибавления щёлочи к раствору кислоты, происходит уменьшение количества кислоты и рН раствора увеличивается. В точке эквивалентности кислота полностью нейтрализована щёлочью и рН = 7. Реакция раствора нейтральная. При дальнейшем добавлении щёлочи рН раствора определяется избыточным количеством NaOH. При добавлении 101 и 110мл. раствора NaOH избыток щёлочи составляет соответственно 1 и 10 мл. Kоличество NaOH в этих двух точках, исходя из формулы молярной концентрации раствора равно соответственно моль и 1 10-3моль
Исходя из формулы (3) для титруемого раствора с избытком щёлочи 1 и 10 мл. имеем значения рН соответственно 10 и 11. По рассчитанным значениям рН строим кривую титрования.
По кривой титрования видно, что в начале титрования рН раствора определяется присутствием в растворе соляной кислоты и слабо изменяется при добавлении раствора щёлочи. Вблизи точки эквивалентности происходит резкий скачок рН при добавлении очень малого количества щёлочи. В точке эквивалентности в растворе присутствует только соль и вода. Соль сильного основания и сильной кислоты гидролизу не подвергается и поэтому реакция раствора нейтральная рН = 7. Дальнейшее прибавление щёлочи приводит к увеличению рН раствора, которое также незначительно изменяется от объёма приливаемого титранта, как и в начале титрования. В случае титрования сильных кислот сильными основаниями и наоборот, точка эквивалентности совпадает с точкой нейтральности раствора.
При титровании слабой кислоты сильным основанием наблюдается несколько иная картина. Слабые кислоты в растворах диссоциируют не полностью и в растворе устанавливается равновесие..
Константа этого равновесия называется константой диссоциации кислоты.

Поскольку слабая кислота диссоциирует не полностью, то концентрацию ионов водорода нельзя свести к общей концентрации кислоты в растворе как это было в случае титрования сильной кислоты. (6)
При добавлении раствора щёлочи к раствору слабой кислоты в растворе образуется соль слабой кислоты. Растворы, содержащие слабый электролит и его соль называются буферными растворами. Их кислотность зависит не только от концентрации слабого электролита, но и от концентрации соли. По формуле (5) можно рассчитать рН буферных растворов.

СKtAn – концентрация соли в буферном растворе.
KD – константа диссоциации слабого электролита
СHАn – концентрация слабого электролита в растворе.
Буферные растворы обладают свойством сохранять определённое значение рН при добавлении кислоты или основания (отсюда происходит их название). Добавление сильной кислоты к буферному раствору приводит к вытеснению слабой кислоты из её соли и следовательно, к связыванию ионов водорода:
При добавление сильного основания, последнее сразу нейтрализуется присутствующей в растворе слабой кислотой с образованием соли,
что также приводит к стабилизации рН буферного раствора. Буферные растворы широко применяются в лабораторной практике в тех случаях, когда требуется создать среду с постоянным значением рН.
В качестве примера рассмотрим титрование 100 мл. 0,1М. раствора уксусной кислоты СН3СООН, 0,1М. раствором NaOH.
При добавлении щёлочи к раствору уксусной кислоты происходит реакция.
СН3СООН + NaOH ® СН3СООNa + H2O
Из уравнения реакции видно, что СН3СООН и NaOH вступают в реакцию в соотношении 1:1, следовательно количество вступившей в реакцию кислоты равно количеству щёлочи, содержащемуся в прилитом титранте. Количество образующегося ацетата натрия СН3СООNa также равно количеству щёлочи поступившему в раствор в ходе титрования.
В точке эквивалентности уксусная кислота полностью нейтрализована и в растворе присутствует ацетат натрия. Однако реакция раствора в точке эквивалентности не является нейтральной, поскольку ацетат натрия как соль слабой кислоты подвергается гидролизу по аниону.
Можно показать, что концентрация ионов водорода в растворе соли слабой кислоты и сильного основания может быть рассчитана по формуле.
После точки эквивалентности рН раствора определяется избытком приливаемой щёлочи. Если прилито 101 и 110 мл рН раствора составляет соответственно 11 и 12(см. табл. 1).
Таблица 2 Титрование 0,1М раствора СН3СООН, 0,1М раствором NaOH.
CH3COOH вступившее в реакцию.
CH3COOН остающееся в растворе
По полученным данным строим кривую титрования слабой кислоты сильным основанием.
 |
По кривой титрования видно, что точка эквивалентности при титровании слабой кислоты сильным основанием не совпадает с точкой нейтральности и лежит в области щелочной реакции раствора.
Кривые титрования позволяют точно определить рН раствора в точке эквивалентности, что является важным для определения конечной точки титрования. Определение точки эквивалентности можно производить инструментальным методом, непосредственно измеряя рН раствора при помощи прибора рН–метра, но чаще для этих целей используют кислотно-основные индикаторы. Индикаторы по своей природе являются органическими веществами, которые изменяют свою окраску в зависимости от рН среды. Сами по себе индикаторы являются слабыми кислотами или основаниями, которые обратимо диссоциируют согласно уравнению:
Молекулярная и ионная формы индикатора имеют различную окраску и переходят друг в друга при определённом значении рН. Пределы рН, в которых индикатор меняет свою окраску, называются интервалом перехода индикатора. Для каждого индикатора интервал перехода является строго индивидуальным. Например, индикатор метиловый красный меняет окраску в интервале рН = 4.4 – 6,2. При рН 6,2, в жёлтый. Фенолфталеин в кислой среде бесцветен, в интервале рН = 8 – 10 он приобретает малиновую окраску. Для того, чтобы правильно выбрать индикатор, необходимо сопоставить его интервал перехода со скачком рН на кривой титрования. Интервал перехода индикатора должен по возможности совпадать со скачком рН. Например, при титровании сильной кислоты сильным основанием скачок рН наблюдается в интервале 4-10. В данный промежуток попадают интервалы перехода таких индикаторов как метиловый красный (4,4 – 6,2), фенолфталеин (8 – 10), лакмус (5 – 8). Все эти индикаторы пригодны для установления точки эквивалентности в данном виде титрования. Такие индикаторы как ализариновый желтый (10 – 12), тимоловый голубой (1,2 – 2,8) в данном случае совершенно непригодны. Их использование даст совершенно неверные результаты анализа.
При выборе индикатора желательно, чтобы изменение окраски было наиболее контрастным и резким. С этой целью иногда применяют смеси различных индикаторов или смеси индикаторов с красителями.
3. Окислительно – восстановительное титрование.
К окислительно-восстановительным, относят обширную группу методов титриметрического анализа, основанных на протекании окислительно-восстановительных реакций. В окислительно-восстановительном титровании используются различные окислители и восстановители. При этом возможно определение восстановителей титрованием стандартными растворами окислителей и наоборот, определение окислителей стандартными растворами восстановителей. Благодаря большому разнообразию окислительно-восстановительных реакций этот метод позволяет определять большое количество самых разнообразных веществ, в том числе и тех которые непосредственно не проявляют окислительно-восстановительных свойств. В последнем случае используется обратное титрование. Например, при определении кальция его ионы осаждают оксалат – ионом
Ca2+ + C2O42- ® CaC2O4¯
Избыток оксалата затем оттитровывают перманганатом калия.
Окислительно-восстановительное титрование имеет ещё ряд достоинств. Окислительно-восстановительные реакции протекают достаточно быстро, что позволяет проводить титрование всего за несколько минут. Многие из них протекают в кислой, нейтральной и щелочной средах, что значительно расширяет возможности применения данного метода. Во многих случаях фиксирование точки эквивалентности возможно без применения индикаторов, поскольку применяемые растворы титрантов окрашены (KMnO4, K2Cr2O7) и в точке эквивалентности окраска титруемого раствора изменяется от одной капли титранта. Основные виды окислительно-восстановительного титрования различают по окислителю, используемому в реакции.
В данном методе окислительно-восстановительного титрования окислителем служит перманганат калия KMnO4. Перманганат калия сильный окислитель. Он способен вступать в реакции в кислой, нейтральной и щелочной средах. о различных средах окислительная способность перманганата калия неодинакова. Наиболее сильно она выражена в кислой среде.
MnO4- + 8H+ +5e ® Mn+ + 4H2O
MnO4- + 2H2O + 3e ® MnO2¯ + 4OH-
Перманганатометрическим методом можно определять самые разнообразные вещества: Fe2+, Cr2+, Mn2+, Cl-, Br-, SO32-, S2O32-, NO2,- Fe3+, Ce4+, Cr2O72+, MnO2, NO3-, ClO3-.и т. д. Многие органические вещества: фенолы, аминосахара, альдегиды, щавелевую кислоту и т. д.
Перманганатометрия имеет много достоинств.
1. Перманганат калия является дешёвым и легкодоступным веществом.
2. Растворы перманганата окрашены в малиновый цвет, поэтому точку эквивалентности можно установить без применения индикаторов.
3. Перманганат калия сильный окислитель и поэтому пригоден для определения многих веществ, которые не окисляются другими окислителями.
4. Титрование перманганатом можно проводить при различной реакции среды.
Перманганатометрия имеет и некоторые недостатки.
1. Перманганат калия трудно получить в химически чистом виде. Поэтому приготовить стандартный раствор по точной навеске вещества затруднительно. Для титрования используют вторичные стандарты перманганата, концентрация которых устанавливается по стандартным растворам других веществ: (NH4)2C2O4, K4[Fe(CN)6], H2C2O4 и др. которые называются установочными веществами.
2. Растворы перманганата неустойчивы и при длительном хранении меняют свою концентрацию, которую необходимо периодически проверять по растворам установочных веществ.
3. Окисление перманганатом многих веществ при комнатной температуре протекает медленно и для проведения реакции требуется нагревание раствора.
В йодометрическом титровании окислителем является йод. Йод окисляет многие восстановители: SO32-, S2O32-, S2-, N2O4, Cr2+, и т. д. Но окислительная способность у йода значительно меньше, чем у перманганата. Йод плохо растворим в воде, поэтому обычно его растворяют в растворе KI. Концентрацию стандартного раствора йода устанавливают стандартным раствором тиосульфата натрия Na2S2O3.
2S2O32- + I2 ® S4O62- + 2I-
При йодометрическом определении используются различные способы титрования. Вещества, легко окисляемые йодом, титруют непосредственно стандартным раствором йода. Так определяют: CN-, SO32-, S2O32-, и др.
Вещества, которые труднее окисляются йодом, титруют методом обратного титрования: к раствору определяемого вещества приливают избыток раствора йода. После окончания реакции избыточный йод отитровывают стандартным раствором тиосульфата. Индикатором в йодометрическом титровании служит обычно крахмал, который даёт с йодом характерное синее окрашивание, по появлению которого можно судить о присутствии в растворе свободного йода.
Методом косвенного йодометрического титрования определяют многие окислители: к раствору окислителя приливают определённый объём стандартного раствора йодида калия, при этом выделяется свободный йод, который затем отитровывается стандартным раствором тиосульфата. Методом косвенного титрования определяют Cl2, Br2, O3 KMnO4, BrO32- и т. д.
Достоинства йодометрического метода.
1. Йодометрический метод является очень точным и превосходит по точности другие методы окислительно-восстановительного титрования.
2. Растворы йода окрашены, что позволяет в некоторых случаях определять точку эквивалентности без применения индикаторов.
3. Йод хорошо растворим в органических растворителях, что позволяет использовать его для титрования неводных растворов.
Йодометрия имеет и некоторые недостатки.
1. Йод является летучим веществом и при титровании возможны его потери за счёт испарения. Поэтому йодометрическое титрование нужно проводить быстро и по возможности на холоду.
2. Йодид ионы окисляются кислородом воздуха, по этой причине йодометрическое титрование необходимо проводить быстро.
4. Реакции с участием йода протекают медленно.
5. Стандартные растворы йода и тиосульфата неустойчивы, при хранении их концентрацию необходимо проверять.
В хроматометрическом титровании окислителем служит стандартный раствор бихромата калия K2Cr2O7 или, реже хромата калия K2CrO4. Бихромат калия является сильным окислителем в кислой среде.
Cr2O72- + 14H+ + 6e ® Cr3+ + 7H2O
Бихромат калия используется для определения различных восстановителей U4+, Fe2+, Ti3+, NO2-, SO32-, а также окислителей, которые предварительно восстанавливаются до низших степеней окисления: Fe3+, Ce4+, MoO42+, V5+.
Достоинства этого метода следующие:
1. Бихромат калия легко получить в химически чистом состоянии.
2. Стандартные растворы бихромата готовят по точной навеске вещества.
3. Растворы бихромата очень устойчивы и не изменяются под действием света, кислорода воздуха, углекислого газа.
4. Бихромат калия является менее сильным окислителем чем перманганат, поэтому его растворы менее чувствительны к загрязнению органическими и неорганическими восстановителями, попадающими в дистиллированную воду.
1. Бихромат калия со многими веществами реагирует медленно, поэтому прямое титрование не всегда возможно. В этом случае применяют обратное титрование.
2. Конечную точку титрования по изменению окраски раствора, вызванному избытком титранта зачастую трудно установить, поэтому в этих случаях применяют индикаторный или инструментальный метод.
3. Бихромат калия менее сильный окислитель, чем перманганат, поэтому бихроматометрия применяется реже, чем перманганатометрия.
Ванадометрия, основанная на окислительной способности соединений ванадия
меркуриметрия и т. д.
Процесс окислительно-восстановительного титрования можно представить графически. Кривая окислительно-восстановительного титрования отражает зависимость окислительно-восстановительного потенциала системы от объёма прибавляемого титранта. Окислительно-восстановительный потенциал системы рассчитывают по уравнению Нернста.

Е0 – стандандартный элетродный потенциал системы.
2,3 – коэффициент перехода от десятичных логарифмов к натуральным.
R – универсальная газовая постоянная.
Т – абсолютная температура.
Z – число электронов, переходящих от окислителя к восстановителю.
[Ox] – концентрация окисленной формы в растворе.
[Red] – концентрация восстановленной формы в растворе.
а, в – стехиометрические коэффициенты в уравнении реакции.
F – константа Фарадея 96500 Кл.
Рассмотрим титрование 100мл. 0,1М. раствора сульфата железа (2) FeSO4 0,1М. раствором сульфата церия (4) Ce(SO4)2. ионы Fe2+ окисляются ионами Се+4 по уравнению.
Fe2+ + Се+4 ® Fe3+ + Се+3
До точки эквивалентности потенциал определяется ионами Fe3+/ Fe2+. По мере увеличения концентрации ионов церия потенциал системы постепенно возрастает. B точке эквивалентности, когда прибавлено 100 мл раствора Ce(SO4)2, сульфат железа (2) полностью окислен в сульфат железа (3). Потенциал в точке эквивалентности рассчитывается по формуле:
После точки эквивалентности потенциал определяется избыточным количеством ионов церия.
Таблица 4. Титрование 100 мл. раствора FeSO4 0,1 М раствором Ce(SO4)2.
Объём 0,1Mраствора Ce(SO4)2
Соотношение концентраций ионов.
По данным таблицы 4 строим кривую титрования.
В точке эквивалентности наблюдается резкий скачок потенциала. Кривая титрования позволяет точно определить значение потенциала в точке эквивалентности и объём титранта, необходимый для её достижения.
Фиксирование точки эквивалентности в окислительно-восстановительном титровании может осуществляться различными способами. Как уже упоминалось, в некоторых случаях возможно безиндикаторное определение точки эквивалентности по окраске раствора от избытка титранта. Точку эквивалентности можно определять инструментальным способом, напрямую измеряя потенциал системы потенциометром. И, наконец, фиксирование точки эквивалентности осуществляется при помощи окислительно-восстановительных индикаторов.
Окислительно-восстановительные индикаторы представляют собой органические соединения, окисляющиеся при определённом значении потенциала.
Indвосст. ± ne ® Indокисл.
Окисленная и восстановленная формы индикаторов обладают различной окраской, изменение которой обнаруживается невооружённым глазом. Окислительно-восстановительные индикаторы можно разделить на три группы:
2. Индикаторы, необратимо окисляющиеся при определённом значении потенциала и при этом изменяющие свою окраску. К числу таких индикаторов относятся метиловый оранжевый, метиловый красный и некоторые другие.
3. Индикаторы, реагирующие с окислителем или восстановителем с образованием специфически окрашенных соединений. Например, при йодометрии используется крахмал, дающий с йодом характерное синее окрашивание. Роданид-ион даёт характерное окрашивание с ионом железа Fe3+.
4. Комплексонометрическое титрование.
Метод комплексонометрического титрования основан на реакциях комплексообразования определяемых веществ с комплексонами. Комплексоны – большей частью органические вещества, выступающие в роли полидентантных лигандов и образующие с определяемыми веществами хелатные комплексы. Большинство комплексонов относится к аминокарбоновым кислотам и их производным. Наибольшее применение в комплексонометрии находит этилендиаминтетрауксусная кислота и её натриевая соль (ЭДТА).
Натриевая соль ЭДТА лучше растворима в воде, чем сама кислота, поэтому она более удобна для приготовления стандартных растворов и применяется чаще. Комплексонометрическое титрование применяется для определения содержания катионов металлов. Косвенными методами можно определять также анионы. ЭДТА образует с катионами металлов чрезвычайно устойчивые комплексы. Константа устойчивости их настолько велика, что ионы металлов не обнаруживаются в растворах комплексов с ЭДТА обычными аналитическими реакциями. Реакции с ЭДТА протекают строго стехиометрически, что позволяет широко использовать этот метод для определения различных металлов. Если обозначить натриевую соль ЭДТА как Na2H2Y, то реакции с ионами металлов будут следующими:
Сa2+ + H2Y2- ® CaY2- + 2H+
Ti4+ + H2Y2- ® TiY + 2H+
Из приведённых уравнений видно, что 1моль ЭДТА связывает 1 моль ионов металла независимо от их степени окисления.
В растворах ЭДТА за счёт комплексообразования растворяются такие малорастворимые соединения как BaSO4, PbSO4, CaCO3, и т. д. Поэтому комплексонометрическим титрованием можно определять содержание ионов металла и в малорастворимых соединениях.
Концентрация стандартного раствора ЭДТА обычно устанавливается по стандартным растворам солей ZnSO4, ZnCl2, MgSO4. Возможно приготовление стандартного раствора по точной навеске вещества. Промышленностью выпускаются также фиксаналы ЭДТА.
Мех+ + MgY2- ® MeY + Mg2+
Выделившиеся свободные ионы магния титруют стандартным раствором ЭДТА. В связи с тем, что при образовании комплексов в раствор выделяется эквивалентное количество ионов водорода, определение можно провести отитровав последние методами кислотно-основного титрования с применением соответствующих кислотно-основных индикаторов. Выделение ионов водорода приводит к изменению рН среды, что может повлиять на устойчивость комплексов и привести к искажению результатов анализа. Чтобы избежать этого рН стабилизируют добавлением буферных растворов или определение ведут в щелочной среде.
Для установки точки эквивалентности в комплексонометрическом титровании применяют специальные металл-индикаторы. Металл-индикаторы представляют собой комплексоны, которые образуют с определяемым ионом комплексы, менее устойчивые, чем комплексы с ЭДТА. Индикатор и его комплекс с металлом имеют различную окраску.
При титровании раствором ЭДТА комплекс индикатора с металлом разрушается, так как ионы металла связываются в более устойчивый комплекс с ЭДТА.
МеInd + H2Y2- ® МеH2Y + 2H+ + Ind
В точке эквивалентности все катионы оказываются связанными с ЭДТА, при этом индикатор меняет окраску. В комплексонометрическом титровании используют индикаторы: ксиленоловый оранжевый (переход от красной окраски к желтой), ПАН (пиридил-2-азонафтол), эриохром чёрный Т (переход синий-оранжевый) и другие.
5. Техника эксперимента.
При проведении следует выполнять ряд общих правил, несоблюдение которых повлечёт за собой ошибки в результатах анализа.
Вся посуда, используемая в эксперименте, должна быть тщательно вымыта – вода должна равномерно смачивать стенки посуды, не оставляя капель. Мерная посуда: (колбы, пипетки, бюретки) должна быть предварительно откалибрована, поскольку реальная ёмкость посуды часто отличается от той, которая обозначена на маркировке. Для калибровки посуду взвешивают на аналитических весах, затем заполняют дистиллированной водой и снова взвешивают. По массе воды определяют реальную ёмкость посуды.
Мерные колбы и пипетки нельзя брать за расширенные части т. к. от тепла рук происходит расширение стекла, и объём посуды может измениться. Набирают жидкость в пипетки, обычно засасывая её ртом. Однако этого нельзя делать в случае ядовитых или едких жидкостей. В этом случае используют различные приспособления: резиновые груши, дозаторы и т. д. Но при работе следует придерживаться какого-либо одного способа заполнения пипеток. Поверхность жидкости в пипетках и мерных колбах имеет вогнутую форму. Отсчёт объёма производится по нижнему краю мениска жидкости в случае прозрачных растворов и по верхнему краю в случае непрозрачных или сильно окрашенных.
Взятие аликвотных частей является ответственной операцией в титриметрическом анализе. Набрав пипеткой определённый объём жидкости дают ему свободно вытечь в колбу. Затем на несколько секунд прикасаются кончиком пипетки к стенке колбы. Выдувать остаток раствора, который всегда остаётся в пипетке не следует. Все растворы должны иметь одинаковую температуру примерно 200С. После взятия аликвотной части добавляют, если это необходимо индикатор. Поскольку индикатор не является нейтральным веществом, добавлять его нужно ровно столько, сколько предусмотрено методикой.
Рабочее место должно быть хорошо освещено. Под колбу, в которой производят титрование, подкладывают лист белой бумаги. Бюретка должна быть укреплена строго вертикально. Перед заполнением её 2-3 раза ополаскивают раствором титранта. Раствор в бюретку наливают при помощи воронки. Сначала наливают раствора несколько больше нулевого деления, после чего необходимо удалить воздух из кончика бюретки. Если бюретка с краном, то, открыв его, выливают некоторое количество раствора. Если бюретка снабжена резиновой трубкой, то необходимо, отогнув её вверх, выпустить воздух из кончика бюретки. После этого устанавливают уровень жидкости на ноль и обязательно вынимают воронку. Последнее необходимо делать потому, что на воронке всегда остаётся какое-то количество раствора, которое может попасть в бюретку и исказить объём, пошедший на титрование.
После того как произведены предварительные приготовления, приступают к титрованию. Колбу с титруемым раствором вносят под бюретку и начинают приливать титрант малыми порциями, перемешивая раствор круговыми движениями колбы. От момента начала титрования и до его окончания выносить колбу из-под бюретки нельзя, т. к. при этом часть раствора может пролиться мимо колбы, что приведёт к потерям и искажению результатов анализа. Приливать титрант из бюрентки следует таким образом, чтобы он непосредственно попадал в раствор, находящийся в колбе, а не стекал по стенке.
Если возникают сомнения в правильности определения точки эквивалентности, то нужно записать объём титранта, а затем прилить некоторое количество титранта в колбу. Если наблюдается резкое изменение окраски раствора, то записанный объём титранта считается объёмом, пошедшим на титрование. Если окраска не изменилась, продолжают приливать титрант по каплям.
Титрование проводят несколько раз. Первое титрование является приближённым. Оно ставит своей целью примерно определить объём титранта. При последующих титрованиях в целях экономии времени можно сразу вылить некоторое количество титранта и только вблизи точки эквивалентности титровать медленно по каплям. Титрование проводят обычно до получения не менее трёх сходящихся результатов.
Опыт 1 Кислотно-основное титрование. Определение концентрации раствора щелочи.
Концентрацию раствора щелочи определяют методом прямого титрования стандартным раствором кислоты в присутствии индикатора метилового красного или метилового оранжевого.
Оборудование и реактивы: бюретки. колба коническая, пипетки, фиксанал соляной кислоты, метиловый красный индикатор.
Приготовить стандартный раствор соляной кислоты из фиксанала. В мерную колбу на 1л. вставьте чистую воронку. В воронку вставьте стеклянный боек. Ампулу тщательно вымойте водопроводной, а затем дистиллированной водой. Аккуратно разбейте ампулу с одного конца о боек, вставленный в воронку. Другим бойком, не вынимая ампулы из воронки, разбейте ее сверху. Смойте содержимое ампулы в колбу дистиллированной водой: тщательно ополосните ампулу изнутри и снаружи, а также ополосните стенки воронки. Доведите объем дистиллированной водой до метки. Данный раствор является первичным стандартом.
В коническую колбу поместите аликвотную часть раствора щелочи. Прибавьте 4-5 капель индикатора метилового красного. Бюретку заполните стандартным раствором кислоты и титруйте раствор щелочи до изменения желтой окраски в оранжево-желтую.
Титруют 3-4 пробы, находят средний объем раствора титранта.
Молярную концентрацию раствора щелочи рассчитывают исходя из того, что растворы одинаковой молярной концентрации реагируют в объемах пропорциональных стехиометрическим коэффициентам в уравнении реакции.
NaOH + HCl = NaCl + H2O
Опыт 2 Окислительно-восстановительное титрование. Определение нитритов перманганатометрическим методом.
При перманганатометрическом определении нитритов используют метод реверсивного титрования, т. е. стандартный раствор перманганата калия титруют анализируемым раствором нитрита. Связано это с тем, что нитриты разлагаются кислотой с образованием оксидов азота: 2NO2- + H+ → 2HNO2 → NO + NO2 + H2O.
Реакцию окисления нитрита раствором перманганата калия в ионной форме можно записать:
5NO2- + 2MnO4- + 6H+ → 5NO3- + 2Mn2+ + 3H2O.
Исследуемый раствор, содержащий NaNO2, в мерной колбе разбавляют дистиллированной водой до метки и тщательно перемешивают. Этим раствором заполняют бюретку. В коническую колбу для титрования на 250мл переносят аликвотную часть стандартного раствора перманганата калия. Прибавляют 10мл. 2н раствора серной кислоты и 100мл. дистиллированной воды. Слегка подогрев колбу, титруют его раствором нитрита натрия до обесцвечивания розовой окраски раствора от одной капли титранта.
Oкисление нитрита натрия перманганатом калия в кислой среде идет по реакции:
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
Соотношение нормальных концентраций реагирующих веществ обратно пропорционально соотношению объемов:
Из данного соотношения находим концентрацию нитрита натрия в титранте:
Опыт 3 Комплексонометрическое титрование. Определение алюминия комплексонометрическим методом.
Комплексонометрическое определение алюминия основано на обратном титровании избытка ЭДТА сульфатом цинка с использованием в качестве индикаторов ксиленолового оранжевого или ПАН. При этом протекают реакции:
Al3+ + ЭДТАизбыток. ® АlЭДТА- + ЭДТА.
ЭДТАост + М2+ ® МЭДТА2- + 2Н+.
Реактивы: раствор ЭДТА 0,025М, раствор сульфата цинка 0,025М, раствор ацетата натрия 0,2М, соляная кислота 1М, ксиленоловый оранжевый индикатор: смесь с нитратом калия в соотношении 1:100.
Выполнение работы
Анализируемый раствор в мерной колбе на 100мл. доводят до метки дистиллированной водой и тщательно перемешивают. В коническую колбу для титрования переносят аликвотную часть раствора (10мл), добавляют 20мл. 0,025М раствора ЭДТА, 2мл 1М раствора НСl, нагревают до кипения и оставляют на кипящей водяной бане 10мин. После охлаждения раствора устанавливают рН=5 добавлением 0,2М раствора ацетата натрия. Добавляют на кончике шпателя индикатор ксиленоловый оранжевый и после полного растворения индикатора титруют раствором сульфата цинка до изменения окраски раствора от желтой к красной. Титрование повторяют до получения не менее трех сходящихся результатов.
Реакция ионов алюминия с ЭДТА происходит по уравнению:
Al3+ + ЭДТА2- ® [AlЭДТА]- + 2H+
при этом из 20 мл., прибавленного нами раствора ЭДТА расходуется только часть Vизр. Другая часть раствора ЭДТА является избыточной Vизб. и оттитровывается сульфатом цинка. Реакция с ионами цинка идет по уравнению:
Zn2+ + ЭДТА2- ® [ZnЭДТА]2- + 2H+.
Поскольку растворы сульфата цинка и ЭДТА взяты одинаковой молярной концентрации, то по уравнению реакции объем раствора сульфата цинка равен избыточному объему ЭДТА:
По уравнению реакции число молей ЭДТА равно числу молей ионов алюминия:
1. На каком принципе основано определение веществ в титриметрическом анализе?
2. Какие существуют способы титрования? Приведите примеры из лабораторной работы.
3. Дайте определения понятиям: первичный стандарт, вторичный стандарт, титрант, аликвотный объём, титрование.
4. Какие существуют виды титриметрического анализа, на чём основана их классификация?
5. Перечислите основные виды окислительно-восстановительного титрования. Дайте краткую характеристику перманганатометрии и йодометрии.
6. Что называется точкой эквивалентности? Какие существуют способы её установления, и какие из них использовались в данной лабораторной работе?
7. Для чего предназначены кривые титрования? Каковы принципы их построения в кислотно-основном и окислительно-восстановительном титровании?