что такое пвл у новорожденного
Перивентрикулярная лейкомаляция
При УЗИ в областях, примыкающих к желудочкам мозга, может выявляться так называемая перивентрикулярная лейкомаляция.
Происхождение термина – от «пери» — вокруг, «вентрикул» — относящийся к желудочку, «лейко» — белый, «маляция» — гибель путем размягчения)
Это изменения в ткани мозга, которые выглядят как небольшие полости, кисты. Поэтому наблюдение за ребенком становится еще более тщательным, так как они могут стать причиной развития детского церебрального паралича.
Однако судить о степени тяжести и типе ДЦП по таким изменениям сложно. Ведь все зависит от величины, расположения и количества кист. Одиночные кисты менее опасны, чем множественные. Маленькие кисты не так опасны, как большие.
Кисты расположены в ткани головного мозга на пути нервно-мышечных проводящих путей. И они обеспечивают связь головного мозга и мышечных волокон, поэтому перерыв этих путей может вызвать ДЦП. Тем не менее возможности человеческого мозга мало изучены. Часто бывает, что здоровые участки мозга берут на себя функцию поврежденных, и нарушения у ребенка сводятся к минимуму.
Перивентрикулярная лейкомаляция чаще развивается у недоношенных детей, и это связано с особенностями кровоснабжения перивентрикулярной области. Кроме того, к перивентрикулярной лейкомаляции приводят тяжелые внутрижелудочковые кровоизлияния 4 степени. Перивентрикулярная лейкомаляция нередко развивается на фоне врожденного сепсиса.
Предсказать появление кист бывает очень сложно. Поэтому, чтобы исключить их развитие, во многих клиниках перед выпиской ребенку, родившемуся с весом менее 1000 г, проводят магнитно-резонансную томографию головного мозга.
Крючко Дарья Сергеевна
Начальник Отдела анализа и координации работы по совершенствованию оказания неонатологической помощи
ФГБУ «Научный Центр Акушерства, Гинекологии и Перинатологии имени академика В. И. Кулакова Министерства здравоохранения Российской Федерации,
Директор дирекции социальных проектов Фонда социально-культурных инициатив.
Научный редактор журнала «Неонатология. Новости, мнения, обучение».
Что такое пвл у новорожденного
Наиболее распространенным гипоксически-ишемическим повреждением у недоношенных новорожденных является перивентрикулярная лейкомаляция (ПВЛ). Miller et al. (2000) сообщали об этом состоянии у доношенных детей. Термин ввели Banker и Larroche в 1962 г. в отношении размягчения (malacia) белого (leicos) вещества. Большинство детей в их исследовании были рождены после 28 недели гестации и на момент смерти были в возрасте нескольких недель. Аноксические эпизоды были зарегистрированы во всех случаях.
При патологоанатомическом исследовании встречались двусторонние, хотя необязательно симметричные, коагуляционные некрозы, примыкающие к наружному углу боковых желудочков. В последние годы классическая картина распознается реже и в работе Paneth et al. (1990) только 3 из 15 новорожденных с некрозами белого вещества имели классические изменения при ПВЛ. В настоящее время (Volpe, 2008) принято различать преимущественно очаговый тип повреждения белого вещества — с кистозными образованиями, ограниченными областью угла и затылочным рогом, вовлекающими в процесс зрительную лучистость, иногда распространяясь кпереди в область лобно-теменного белого вещества, и более диффузный тип, который сейчас чаще называют лейкоэнцефалопатией или повреждением перивентрикулярного белого вещества (periventricular white matter injury — PWMI), реже — ПВЛ (Leviton и Gilles, 1984, Back, 2006).
В то время как эволюция в кисты, хорошо различимые при ультразвуковом сканировании черепа, является отличительным признаком очагового типа, более диффузные изменения интенсивности сигнала МРТ являются информативным показателем для диагностики диффузных патологических изменений белого вещества (Counsell et al, 2003).
Кистозная перивентрикулярная лейкомаляция (к-ПВЛ) была впервые диагностирована с использованием краниальной ультрасонографии в 1982 г. (Hill et al., 1982а). По данным прежних патологических исследований, примерно 25% повреждений носили геморрагический характер (Levene et al., 1983). Как было отмечено, заболеваемость к-ПВЛ за последнее десятилетие снизилась (Hamrick et al., 2004) с 5-10% до менее 1% в некоторых центрах.
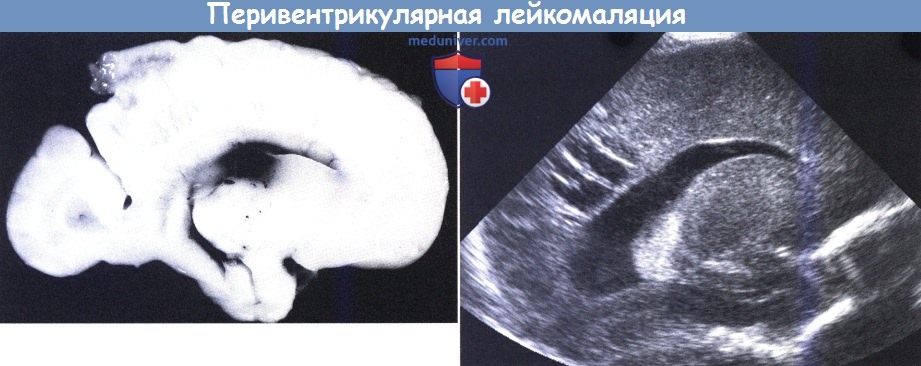
Новорожденный с гестационным сроком 28 недель (масса при рождении 945 г),
умерший в возрасте двух недель: многочисленные мелкие полости в перивентрикулярной области (с разрешения J-C Larroche, Maternite Port Royal, Paris).
Ультразвуковое сканирование другого ребенка, сагиттальная проекция: множественные полости около полостей желудочков.
а) Сопоставления с нейровизуализацией. Начальные изменения, видимые при ультразвуковом исследовании, представляют собой участки повышенной перивентрикулярной эхогенности (ПВЭ), которые относятся к очень субъективным находкам. Некоторые предлагают измерять ПВЭ при сравнении их с эхогенностью сосудистого сплетения. Учитывается продолжительность ПВЭ, при длительном присутствии возрастает вероятность, что они указывают на среднюю степень ПВЛ. Кроме того, может помочь определение гомогенности ПВЭ. В случаях неоднородности («пестрой» ПВЭ), наиболее вероятно повреждение белого вещества, а пестрые участки чаще коррелируют с небольшими петехиальными кровоизлияниями на MPT (Sie et al, 2000b, Childs et al, 2001). ПВЛ можно разделить на 4 подгруппы (de Vries et al, 1992a). Стадия I дополнительно может быть разделена на две подгруппы, (а) гомогенные, и (б) негомогенные (пестрые) перивентрикулярные эхогенности (ПВЭ).
Несколько исследований с применением МРТ показали, что имеется невыраженная корреляция между перивентрикулярной эхогенности (ПВЭ) и изменениями интенсивности сигнала в белом веществе (Maalouf et al., 2001, Debillon et al., 2003, Miller et al., 2003, Inder et al, 2003a). Раннюю ПВЭ можно было бы соотнести с диффузным сигналом сверхвысокой интенсивности (Diffuse excessive high signal intensity—DEHSI), который выявляется на Т2-взвешенных спин-эхо последовательностях у 70% недоношенных детей в приблизительном эквиваленте зрелого возраста. Измерение коэффициента диффузии (the apparent diffusion coefficient — ADC) подтвердило, что этот показатель действительно отражает повреждение белого вещества (Counsell et al., 2003).
У небольшого количества младенцев очаги перивентрикулярной эхогенности (ПВЭ) постепенно превратились в локализованные или более обширные кисты. Чем меньше и чем более ограниченна киста, тем больше времени требуется для ее развития. Мелкие кисты могут остаться не выявленными. Более 50% небольших кист впервые выявляли при еженедельном ультразвуковом исследовании после 28 дней (Pierrat et al., 2001, de Vries et al., 2004). Более чем у половины детей маленькие кисты разрешались к 40 неделям постконцептуального возраста, приводя к легкому расширению желудочков (вентрикуломегалии) в некоторых, но не во всех случаях. С уменьшением длительности вентиляции новорожденных и возрастанием числа пациентов большинство младенцев переводят в районные стационары до развития кистозных изменений и возвращают для наблюдения в клинику в 40 и более недель постконцептуального возраста.
Если ультразвуковое исследование не проводится в местных больницах, кисты могут оставаться не диагностированными, что, вероятно, является основной причиной плохой репутации краниального УЗИ как предиктора церебрального паралича (de Vries et al., 2004). В улучшении наблюдения за детьми группы риска по развитию кист МРТ, как было показано, может быть перспективным. Inder et al. (1999b) впервые продемонстрировали обширные изменения на ДВ-МРТ, предшествовавшие развитию кист. Получены немногисленные данные об очень ограниченном количестве детей с ПВЭ, обследованных на ранней стадии этого тяжелого расстройства (Bozzao et al., 2003).
Кисты, даже обширные, могут разрешаться от нескольких недель до месяцев, и МРТ играет главную роль в определении распространенности повреждений белого вещества на этапе позднего неонатального периода. Классическая картина в периоде младенчества может быть представлена в виде неравномерного расширения боковых желудочков, различной степени утраты белого вещества, извилин, прилегающих к желудочковым стенкам, задержки миелинизации и перивентрикулярного глиоза (Byrne et al., 1990, Truwit et al., 1992).
de Vries et al. (1993) обнаружили хорошую степень корреляции между тяжестью патологии при ультразвуковом исследовании новорожденных и глиозными изменениями на МРТ, в период младенчества. Современные технологии, использующие диффузионо-тензорное изображение (ДТИ), позволяют выполнить диффузионнотензорную трактографию (ДТТ) и таким образом отображать и подсчитывать белое вещество пирамидального тракта недоношенных новорожденных (Miller et al., 2002, Berman et al., 2005, Partridge et al., 2005). Counsell et al. (2006) указали на существенно повышенный радиальный коэффициент диффузии в задней части внутренней капсулы и утолщении мозолистого тела, а также значительно повышенный радиальный и аксиальный коэффициент диффузии в белом веществе семиовального центра, в белом веществе лобной, перивентрикулярной и затылочной областей. Эти данные, полученные Counsell et al. (2006), позволяют предположить, что DEHSI при стандартном МРТ отражает патологические изменения олигодендроцитов и/или аксонов белого вещества.
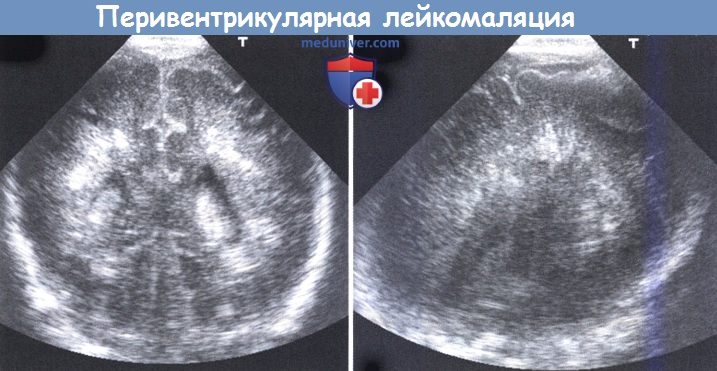
Ультразвуковое исследование полости черепа, выполненное на первый день: (слева) коронарный вид через передний родничок, и (справа) парасагиттальное сканирование через задний родничок.
На обоих изображениях видны «пятнистые» плотные эхогенности. 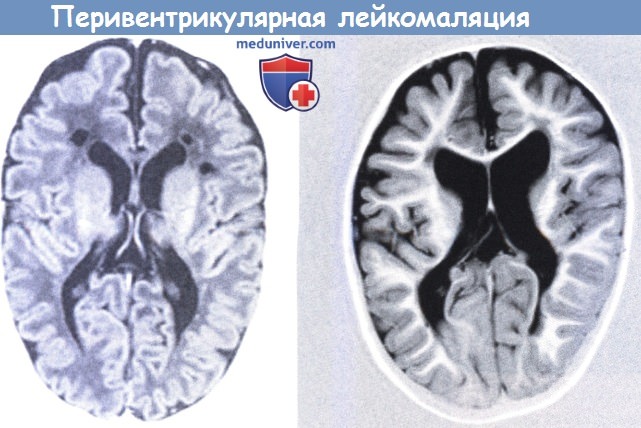
Кисты хорошо видны при ранней МРТ (левое), в то время при поздней МРТ выявлена угловатая желудочковая дилятация и тяжелая атрофия белого вещества.
б) Патогенез. Патогенез ПВЛ многофакторный и менее понятен, чем при кровоизлиянии в герминативный матрикс и внутрижелудочковом кровоизлиянии (КГМ-ВЖК). Первоначально это состояние связывали с гипоперфузией пограничных зон в белом веществе, но исследования с использованием непрерывного измерения кровяного давления до сих пор не в состоянии определить гипотензию как независимый фактор риска для повреждения белого вещества (Trounce et al., 1988, Watkins et al., 1989, Dammann et al., 2002). Тяжелая гипокапния, которая приводит к снижению мозгового кровотока, в нескольких исследованиях была выделена в качестве самостоятельного фактора риска для развития ПВЛ (Calvert et al., 1987, Greisen et al., 1987, Graziani et al., 1992, Fujimoto et al., 1994, Wiswell et al., 1996, Okumura et al., 2001, Shankaran et al., 2006). У детей с развитием ПВЛ было обнаружено заметное снижение как мозгового кровотока, так и доставки кислорода к мозгу (Pryds, 1994).
Результаты ближней инфракрасной спектроскопии (БИС), Tsuji et al. (2000) подтвердили дисфункцию церебральной ауторегуляции у 17 из 32 недоношенных детей; у 9 из них развились тяжелые внутричерепные повреждения по сравнению только с 2 из 15 с неизмененной ауторегуляцией.
В нескольких интересных исследованиях была обнаружена связь между восходящей внутриматочной инфекцией, продукцией воспалительных цитокинов и повреждением белого вещества (Leviton и Gilles, 1984, Bejar et al., 1988, Murphy etal., 1995, Perlman et al., 1996, Verma et al., 1997, Yoon et al., 1997, Minagawa et al., 2002). В недавнем обзоре (Leviton et al., 2005) выдвинута гипотеза, что поражение белого вещества возникает в результате взаимного усиления врожденной и приобретенной иммунных систем. При мета-анализе была установлена связь между хориоамнионитом и церебральным параличом, и хориоамнионит был выделен в качестве фактора риска как для церебрального паралича (КР 1,9; 95% ДИ 1,5-2,5), так и для ПВЛ (КР 2,6; 95% ДИ 1,7-3,9) (Wu и Colford, 2000). Yanowitz et al. (2002) смогли показать взаимосвязь между хориоамнионитом, повышенным уровнем ИЛ-1 р и ИЛ-6, а также снижением среднего и диастолического давления крови после рождения.
Уязвимость также зависит от степени зрелости белого вещества, называемой Back et al. (2001) «окном уязвимости развития». Они предположили важность гипоксически-ишемического/токсического повреждения метаболически активной олигодендроглии (Oka et al., 1993). На пике развития ПВЛ преимущественно представлены поздние предшественники олигодендроцитов. Кроме этого, Oka et al. указывали на то, что глютамат чрезвычайно токсичен в отношении дифференцирующейся олигодендроглии.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Что такое пвл у новорожденного
а) Клинические проявленияперивентрикулярной лейкомаляции (ПВЛ) у новорожденного. Клинические признаки нехарактерны и легко могут остаться незамеченными. Судороги часто протекают скрыто или субклинически. Положительные роландические острые волны специфически связаны с ПВЛ у недоношенных детей (Marret et al., 1992); одно из исследований показало лучшую чувствительность у недоношенных с гестиоцитарным возрастом более 28 недель (Baud et al., 1998). В недавней исследовательской работе была продемонстрирована связь низкого частотного спектра и патологических изменений белого вещества (Inder et al., 2003b). В острой фазе может присутствовать небольшая вялость или гипотония.
У некоторых детей с острым течением септицемии или некротизирующего энтероколита может наблюдаться зависимость от искусственной вентиляции. Характерная картина распознается обычно через несколько недель, когда ребенок становится все более возбудимым и демонстрирует гипертонус с выпрямлением нижних конечностей и сгибанием верхних. Характерны тремор и вздрагивания, а рефлекс Моро часто патологический. В исследованиях по общим движениям сообщается о картине так называемых «тесно синхронизированных» движений (Cioni и Prechtl, 1990). У таких детей достаточно часто обнаруживаются корковые зрительные расстройства в грудном возрасте (Lanzi et al., 1998), но (субкортикальные) нарушения слежения могут выявляться в эквиваленте зрелого возраста (Eken et al., 1994b, Cioni et al., 1996).
Неврологический исход у детей с обширными кистозными поражениями в белом веществе теменной и затылочной долей неизменно плохой из-за прерывания проводящих путей, идущих от внутренних структур и коры полушарий, которые связаны с функцией нижних конечностей и/или зрительной лучистости. Это объясняет вызываемые ими спастические диплегии и/или нарушения зрения. Самым значительным предиктором позднего церебрального паралича, обычно спастической диплегии, является к-ПВЛ. Обширное кровоизлияние III степени часто приводит к зависимости от инвалидной коляски и может быть связано с церебральным зрительным нарушением или проблемами со зрительным восприятием, особенно при вовлечении таламуса (Eken et al., 1996, van den Hout et al., 1998, Cioni et al., 2000, Ricci et al., 2006, van Elaastert et al., 2008).
Использование карт тестирования остроты зрения в раннем периоде новорожденности способствует ранней диагностике этих зрительных расстройств и, следовательно, раннему вмешательству. Одиночные кисты или кисты, ограниченные перивентрикулярным белым веществом лобно-теменной области имеют лучший прогноз с нормальным исходом или легкой диплегией. Даже ПВЭ без развития кист создает небольшой риск возникновения церебрального паралича в 8-10% случаев, чаще наблюдающегося у детей с более продолжительным ПВЭ (Appleton et al., 1990, Jongmans et al., 1993, Chen et al., 2004). Практически у половины детей с ПВЭ в группе, обследованной Jongmans et al., у которых не наблюдалось развития церебрального паралича, имелись транзиторные изменения в характере тонуса и отмечался более высокий общий показатель нарушений при повторном обследовании в возрасте 6 лет. У других тоже были выявлены патологические нейромоторные симптомы, а также и сниженные способности к обучению (Fawer и Calame, 1991).
Cornette et al. (2002) сообщали о благоприятном раннем исходе у 9 из 10 недоношенных новорожденных с точечными очагами в белом веществе, лишь с одним случаем задержки речевого развития. До настоящего времени только одно исследование было посвящено исходам в группе детей с DEHSI, в котором было показано отрицательное влияние на способность к обучению (Dyet et al., 2006). Важна отмеченная при проведении трехмерного МРТ утрата объема серого вещества в результате (некистозных) патологических изменений белого вещества в возрасте, эквивалентном зрелому (Inder et al., 1999а). В последних работах той же группы исследователей выводы подтвердились на большой когорте недоношенных детей (Inder et al., 2005).
б) Профилактика перивентрикулярной лейкомаляции (ПВЛ) у новорожденного. Очень мало данных по возможности предупреждения развития перивентрикулярной лейкомаляции, но за прошедшие годы отмечено снижение заболеваемости в несколько раз и распространенные кистозные формы в настоящее время стали редкой патологией (Hamrick et al., 2004). Совершенствование акушерской и неонатальной помощи, очевидно, играет важную роль. Во внутриутробном периоде важно более широкое использование антибиотиков при длительном безводном периоде и применение кортикостероидов (бетаметазона в особенности) в антенатальном периоде (Baud et al., 1999, Kenyon et al., 2001).
После рождения таким детям реже требуется (продленная) респираторная поддержка, что позволяет избежать гипокарбии как потенциального фактора риска и обеспечить лучший контроль артериального давления с помощью вживленного артериального катетера. Повышенные уровни гипоксантина в плазме крови и карбонильных групп белков в ликворе у детей с риском развития ПВЛ подтверждают активирование механизма повреждения свободными радикалами (Russell et al., 1992, Inder et al., 2002). Пока проведено только одно рандомизированное исследование с использованием аллопуринола, не показавшее защитного эффекта (Russell et al., 1995).
Ретроспективное исследование с контрольной группой выявило, что у новорожденных, которые внутриутробно получали сульфат магния, реже развивалась к-ПВЛ (Finesmith et al., 1997), но этот факт не подтвердился в проспективном рандомизированном многоцентровом исследовании, проведенном Crowther et al. (2003). Вероятно, в будущем определенную роль сыграет ограничение воспалительной реакции плода и новорожденного, например, с помощью блокады взаимостимуляции врожденной и адаптивной иммунной системы. (Leviton et al., 2005).

Новорожденный с гестационным сроком 28 недель (масса при рождении 945 г),
умерший в возрасте двух недель: многочисленные мелкие полости в перивентрикулярной области (с разрешения J-C Larroche, Maternite Port Royal, Paris).
Ультразвуковое сканирование другого ребенка, сагиттальная проекция: множественные полости около полостей желудочков.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
ПЕРИВЕНТРИКУЛЯРНАЯ ЛЕЙКОМАЛЯЦИЯ У НЕДОНОШЕННЫХ ДЕТЕЙ
| Патология недоношенных новорожденных, связанная с поражением головного мозга, становится все более актуальной для педиатрической практики нашей страны. Перивентрикулярная лейкомаляция (ПВЛ) (ишемические некрозы, перивентрикулярные инфаркты, энцефалодистрофия, перивентрикулярная энцефаломаляция) представляет собой локальный или распространенный асептический некроз белого вещества больших полушарий головного мозга, расположенного вдоль наружно-верхних отделов боковых желудочков. |
Первое описание ПВЛ было сделано Virchov в 1867 году. Термин «перивентрикулярная лейкомаляция» был введен B.Banker и J.Iarroche в 1962 году. Актуальность проблемы обусловлена прежде всего тяжелыми отдаленными неврологическими последствиями перивентрикулярной лейкомаляции, а также достаточно высокой частотой данной патологии.
Развитие ПВЛ у преждевременно родившихся детей связывается с неадекватным мозговым кровообращением из-за отсутствия у них концевых зон трех главных мозговых артерий, несовершенством механизмов ауторегуляции мозгового кровотока, а также с высокой чувствительностью к гипоксии белого вещества больших полушарий, вступающего в фазу миелинизации.
Гипоксия у недоношенных новорожденных не увеличивает мозговой кровоток, как это происходит у доношенных детей. Снижение системного артериального давления ведет к гипоперфузии мозга, прежде всего в зонах смежного кровообращения между вентрикулофугальными и вентрикулопетальными ветвями артерий, в так называемой watershed-области, на расстоянии 3-10 мм от стенок боковых желудочков, чаще всего в теменной области. Развитию коагуляционного некроза способствуют также свободные радикалы, выделяющиеся при окислении гипоксантина и вызывающие тканевую деструкцию. Гипоксемия, гиперкапния, метаболический ацидоз обусловливают нарушения микроциркуляции в виде венозных стазов и тромбозов мелких сосудов. Таким образом, основным механизмом развития ПВЛ является гипоксия в результате гипоксемии и гипоперфузии мозга, а также нарушение микроциркуляции.
Но возникновение очагов ПВЛ может вызвать не только гипоксемия и гиперкапния, но и гипероксия (при аппаратной искусственной вентиляции легких или других видах респираторной поддержки), так как повышение рН крови в мозговой ткани ведет к рефлекторному спазму прекапилляров. Особенно опасна резкая смена гипоксемии гипероксией, что отмечается при проведении оксигенотерапии без четкого контроля за газовым составом крови. Повреждение мозговой ткани усугубляется затруднением венозного оттока из полости черепа, отмечающимся у новорожденных с респираторным дистресс-синдромом, в особенности находящихся на ИВЛ, а также при сердечно-сосудистой недостаточности. Указывается также на гнойно-септическую инфекцию как возможный фактор развития ПВЛ.
В результате всех этих причин развивается коагуляционный некроз белого вещества перивентрикулярных зон головного мозга. В дальнейшем присоединяется дегенерация астроцитов с пролиферацией микроглии и скоплением липидсодержащих макрофагов в некротизированной ткани. Фагоцитоз некротических участков начинается с 5-7-го дня и приводит к образованию кист на протяжении двух первых недель и в более отдаленные сроки. В области некроза часто происходят вторичные кровоизлияния с развитием геморрагических инфарктов, пери-, интравентрикулярных кровоизлияний. Частота кровоизлияний составляет 28-59% всех случаев ПВЛ.
Различные авторы приводят данные о сочетании поражений перивентрикулярной зоны с уменьшением и уплотнением герминативного матрикса в области очага ПВЛ, ишемическими поражениями в сером веществе (гипокамп, зрительный бугор, хвостатое ядро, продолговатый мозг, кора мозжечка), размягчением в корковых ганглиях. Важно отметить редкость поражения коры полушарий головного мозга у преждевременно родившихся детей. К гипоксии менее чувствительна незрелая кора, чем зрелая, из-за большого количества анастомозов между артериями поверхности полушарий, характерных для головного мозга плода и недоношенного новорожденного.
Перивентрикулярная лейкомаляция во внутриутробном периоде вызывает деструкцию и нарушение формирования коры больших полушарий, а развитие ее в натальный и постнатальный периоды способствует поражению мотонейронов в области лучистого венца. Факторы риска развития можно условно разделить на две группы: патологическое течение беременности и родов.
Отмечена также зависимость частоты встречаемости ПВЛ от времени года. Так, лейкомаляция чаще развивается у детей, последние месяцы внутриутробного развития которых приходятся на зимне-весенний период, что может быть связано с влиянием гелиометеорологических колебаний на вынашивание плода, а также с гиповитаминозами.
В неврологическом статусе на этапе родильного дома у всех детей отмечался синдром угнетения ЦНС (снижение двигательной активности, мышечная гипотония, гипорефлексия), у 21% присутствовал судорожный синдром. Не чаще, чем в общей популяции, у этих детей выявляются врожденные пороки развития (почек, сердца и др.).
Морфология ПВЛ лучше изучена у доношенных детей. В.Власюк выделяет три стадии ее развития:
1. Фаза некроза, во время которой происходят гибель клеток глии, накопление продуктов распада и клеточного детрита, фрагментация и глыбчатый распад аксонов.
2. Резорбция, для которой характерна астроцитарная и макрофагальная реакция с накоплением зернистых шаров.
3. Формирование глиозного рубца или псевдокисты, обусловленное пролиферацией астроцитов. Чаще наблюдается кистозная дегенерация мозга. Кисты множественные, разнокалиберные, количество кист в процессе динамического наблюдения возрастает, и в тяжелых случаях ПВЛ кисты занимают практически всю перивентрикулярную зону боковых желудочков. В менее тяжелых вариантах кисты изолированные, локализуются в таких типичных отделах, как латеральные зоны передних и нижних рогов боковых желудочков.
По данным В.Banker, у недоношенных детей отмечаются следующие стадии ПВЛ:
1.Коагуляционный некроз и реактивная микроглиальная реакция, продолжающиеся около 3 часов.
Принято считать, что патогномоничных клинических симптомов ПВЛ не имеет (Н.Шабалов, F.Pidcock). Неспецифические изменения в неврологическом статусе выявляются, по данным Л.Казьминой, у 76% детей с ПВЛ.
У многих детей при этом отмечается синдром повышенной нервно-рефлекторной возбудимости (41,3%). Синдром угнетения нейро-рефлекторной деятельности был основным клиническим проявлением у 17,4% обследованных, мышечная гипотония отмечалась у 44% новорожденных. Судороги в неонатальном периоде проявились у 6% детей, приблизительно с той же частотой наблюдались стволовые симптомы.
В единичных публикациях (L.Graziani, M.Pasto, C.Standley e.a.) обращается внимание на отсутствие аномалий неврологического статуса в периоде новорожденности во многих наблюдениях.
В отдельных клинических вариантах при ПВЛ могут наблюдаться летальные исходы.
Есть основания считать, что практически вся патологическая неврологическая симптоматика при лейкомаляции у новорожденных обусловлена сочетанными поражениями стволовых образований за счет гипоксии, нарушения микроциркуляции, интоксикации и т.д., поскольку по мере стихания остроты процесса даже в случае развития массивных перивентрикулярных кист аномалий при неврологическом осмотре у большинства детей не выявляется до 3-5 месяцев жизни.
По данным А.Казьмина с соавт., у 89% детей за острым периодом поражения ЦНС следовал период «мнимого благополучия», длившийся до 3-4, а в отдельных случаях и до 8-9 месяцев, после окончания которого появлялись признаки церебральной недостаточности.
Мозговые расстройства отличались разнообразием. Преобладали двигательные нарушения. У 89% детей сформировался детский церебральный паралич разной степени выраженности. По наблюдениям J.Perlman c cоавт., при сочетании изменения перивентрикулярной плотности с большой кистой ДЦП развивается в 93% наблюдений. По этим же данным, ПВЛ не приводит к формированию церебрального паралича лишь в 7-31% случаев. Исследования И.Воронова с соавт. оценили вероятность развития ДЦП при перивентрикулярной лейкомаляции в 68,5%.
Косоглазие при этом было обнаружено у 60,8% детей (преимущественно сходящееся альтернирующее). Судорожный синдром появлялся в возрасте 4-7 месяцев жизни в виде адверсивных или фокальных судорожных припадков. Практически у всех детей с ПВЛ наблюдается стойкий цереброастенический синдром. Небольшая группа детей имеет в исходе минимальные мозговые дисфункции. Нарушения зрения у детей с ПВЛ встречаются редко и связаны прежде всего с ретролентальной фиброплазией, которая также развивается у недоношенных детей, перенесших тяжелую гипоксию. Описаны единичные случаи корковой слепоты и гемианопсии.
Практически здоровыми среди детей с ПВЛ, по данным А.М.Казьмина с соавт., были 4,3%.
Установлено, что характер хронической церебральной недостаточности при ПВЛ определяется прежде всего локализацией лейкомаляционных полостей, а выраженность различных психоневрологических нарушений зависит в основном от размеров псевдокист. Чем крупнее и многочисленнее лейкомаляционные полости, тем тяжелее церебральные расстройства. В случаях, когда поражение обширное, но лейкомаляционные очаги распределяются вокруг желудочков более тонко, прогноз более благоприятный. Наиболее тяжелые последствия, особенно в плане моторики, имеют случаи, когда толщина лезий достигает 1/ 2-1/ 3 толщины мантии.
И.Воронов, Е.Воронова обратили внимание на важность для прогноза временного периода, в который произошла ПВЛ, а также на своевременность и полноту проведения реабилитационных мероприятий детям с лейкомаляцией.
По-видимому, генетически детерминированные и морфологически оформленные уже у глубоконедоношенных детей проекционные (внутренняя капсула) и длинные ассоциативные (верхний продольный пучок) связи больших полушарий являются основными каналами передачи сигналов от коры больших полушарий к спинальным мотонейронам, между передними и задними полями неокортекса, соответственно. Поэтому повреждение этих структур у новорожденных приводит к стойкому церебральному дефициту.
Развитие церебрального паралича связано с повреждением центральной части внутренней капсулы, медиальных средне- и заднелобных сегментов белого вещества больших полушарий мозга, причем тяжесть двигательных расстройств четко коррелирует с количеством и размерами лейкомаляционных полостей. Косоглазие обусловлено поражением проекционных и комиссуральных связей заднего адверсивного поля. Задержка психического развития наблюдается при поражении латеральных лобных и теменных сегментов больших полушарий, с изменениями системы верхнего продольного пучка. Перивентрикулярная лейкомаляция приводит к малым неврологическим нарушениям в виде диспраксии, преходящих изменений мышечного тонуса или же не вызывает никаких неврологических отклонений у детей раннего возраста при изолированном одностороннем поражении мозга в медиальном заднелобном и теменных сегментах больших полушарий, а также при наличии единичных мелких псевдокист любой локализации.
Время манифестации мозговых расстройств при ПВЛ, по-видимому, соответствует нормативным срокам функционального «включения» соответствующих проводящих путей.
В последние годы появились данные о применении магнитно-резонансной томографии для контроля за структурными изменениями при ПВЛ. Применение этого метода убедительно подтвердило, что участки нарушения миелинизации оказываются более обширными, чем псевдокисты, выявляемые на нейросонографии.
Изменения на электроэнцефалограмме неспецифичны. При обширной перивентрикулярной лейкомаляции преобладали мощные колебания дельта- и тетрадиапазонов в нативной ЭЭГ. У новорожденных детей встречались спектральная и фазовая межполушарная асимметрия, пики, острые волны, вспышки медленных колебаний. В острой стадии лейкомаляции у многих пациентов обнаруживалась депрессия ЭЭГ и пароксизмальная активность. При ПВЛ с мелкими немногочисленными псевдокистами изменения ЭЭГ отсутствовали или были незначительными.
Известны случаи, когда при отсутствии ультразвуковых признаков лейкомаляции очаги были выявлены на аутопсии. Возможно, с появлением более совершенной диагностической аппаратуры для ультразвукового исследования и при более высокой квалификации врачей, проводящих исследование, подобных находок обнаруживаться не будет.
Ультразвуковое исследование позволяет оценить характер ишемического повреждения, его локализацию и стадийность, а также динамику процесса.
Картина первой стадии перивентрикулярной лейкомаляции представлена зоной повышенной эхогенности в проекции наружных углов боковых желудочков, к которым относятся латеральные отделы передних и нижних рогов, области желудочковых треугольников. В тяжелых вариантах в процесс вовлекается вся перивентрикулярная область боковых желудочков.
Повышение эхогенности перивентрикулярной паренхимы мозга достигает степени эхогенности сосудистых сплетений боковых желудочков и костных структур. Достаточно часто зоны повышенной эхоплотности имеют характерную треугольную форму с основанием, обращенным к корковым структурам и вершиной, направленной к желудочку. Подобные изменения ярко проявляются в коронарных плоскостях сканирования на уровне передней черепной ямки, а также в парасагиттальных сечениях через боковые желудочки. Процесс, как правило, двусторонний и симметричный. В случаях асимметричности поражения сторон и появления эхогенной структуры, распространяющейся па периферические отделы мозга, следует предполагать возможность геморрагического инфаркта и вторичного паренхиматозного кровоизлияния.
В процессе диагностики перивентрикулярной лейкомаляции у недоношенных детей следует помнить, что практически все преждевременно родившиеся дети при ультразвуковых исследованиях имеют зоны повышенной эхогенности над передними, затылочными рогами, телами боковых желудочков. Данные изменения обусловлены незрелостью структур мозга, а не ишемическим процессом. В отличие от ПВЛ эти изменения менее эхогенны, чем сосудистые
Сплетения желудочков однородны, они уменьшаются в процессе динамического наблюдения и полностью исчезают к 1-2 месяцам жизни.
Последующая стадия развития ПВЛ характеризуется кистозной дегенерацией мозга. Появлению псевдокист обычно предшествует понижение эхогенности перивентрикулярных областей. В связи с этим в период с 10-х по 14-е сутки жизни при обследовании может создаваться ложное впечатление благополучия.
Кисты при ПВЛ множественные, разнокалиберные, диаметр их колеблется от 2-3 мм и более. Область кистозных изменений обычно несколько меньше, чем ранее определяемые участки высокой эхогенности. Вероятно, это связано с тем, что не вся гиперэхогенная область является зоной некроза, часть ее представляет собой участки перифокального венозного застоя и отека. Однако количество кист в процессе динамического наблюдения нарастает, создавая ощущение прогрессирования процесса. Обычно кистозные изменения прогрессируют на протяжении 1-2 месяцев. Между стенкой бокового желудочка и стенкой псевдокисты почти всегда имеется неизмененная ткань мозга шириной от 2 до 4 мм.
В тяжелых вариантах ПВЛ анэхогенные полости занимают практически всю перивентрикулярную область боковых желудочков. В других, менее тяжелых случаях лейкомаляции кисты изолированные, локализуются в таких типичных местах, как латеральные зоны передних и нижних рогов боковых желудочков, где чаще бывают симметричными, но могут иметь асимметричный характер. Иногда псевдокисты окружены эхопозитивным венчиком, но чаще определяются на фоне паренхимы обычной эхогенности.
К 2-5-му месяцу жизни псевдокисты при нейросонографии не выявляются. Мелкие одиночные псевдокисты диаметром 2-3 мм могут спадаться с образованием небольших участков глиоза. Множественные перивентрикулярные кисты, захватывающие все отделы боковых желудочков, всегда вызывают атрофию паренхимы мозга.
Ультразвуковыми критериями атрофии мозга служат: расширение межполушарной щели и субарахноидального пространства, развитие вторичной вентрикуломегалии различной степени, расширение борозд мозга. В отдаленные сроки перивентрикулярной лейкомаляции кисты, как правило, прорываются в полость боковых желудочков, что приводит к развитию порэнцефалии.
Эволюция ПВЛ может протекать и без вентрикуломегалии. Первое ультразвуковое исследование целесообразно проводить на 1-3-и сутки жизни, повторный осмотр необходим на 7-10-е сутки. В прогностическом плане очень информативна нейросонография в возрасте 1,5-2 месяцев.
Радикальных методов лечения ПВЛ не существует ввиду необратимости изменений. Используются препараты, улучшающие мозговое кровообращение (ницерголин, винпоцетин, стугерон), ноотропы (пирацетам). Нет убедительных данных об эффективности гормональной терапии при ПВЛ. Неоднозначны данные о результатах применения антигипоксантов.
Впоследствии стараются добиться компенсации психомоторных нарушений симптоматическими средствами, применяются все известные способы коррекции двигательных нарушений и реабилитации больных с задержкой психомоторного развития.
Поскольку перивентрикулярная лейкомаляция встречается у недоношенных детей, важным звеном профилактики ПВЛ служит пролонгирование беременности и профилактика преждевременных родов.
При рождении недоношенного ребенка необходимо адекватное ведение его с контролем всех показателей гомеостаза с целью своевременной коррекции гипоксемии, ацидоза, предотвращения приступов апноэ и колебаний артериального давления, ведущих к нарушению мозгового кровообращения и ишемии мозга.
Так как наиболее частым заболеванием, осложняющимся перивентрикулярной лейкомаляцией, является респираторный дистресс-синдром, оптимизм внушает внедрение в лечение этих больных препаратов сурфактанта, который уменьшает тяжесть дыхательных расстройств и снижает потребность в аппаратной искусственной вентиляции легких. Оснащение отделений реанимации новорожденных современными аппаратами для проведения автономной искусственной вентиляции легких (АИВЛ) и мониторами также должно способствовать снижению частоты этой тяжелой патологии.
Профессор Владимир САПОЖНИКОВ,
заведующий кафедрой педиатрии Тульского государственного университета.
