что такое приобретенная резистентность
Антибиотикорезистентность: аргументы и факты
Устойчивость к антимикробным препаратам создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекций. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов антимикробных препаратов при лечении инфекций различной локализации.
За последние 100 лет врачам удалось справиться со многими болезнями и значительно увеличить среднюю продолжительность жизни людей. Ряд открытий и изобретений в области медицины по праву можно отнести к числу наиболее значимых в прошлом столетии. Примерами могут служить появление первых кровезаменителей и расшифровка ДНК. Но, по мнению многих экспертов, именно изобретение пенициллина, внедрение его в клиническую практику и последующее бурное развитие антимикробной терапии (АМТ) сыграли наиболее существенную роль в увеличении продолжительности жизни людей в XX веке. Сегодня невозможно представить нашу жизнь без антимикробных препаратов (АМП), помогающих бороться с большинством инфекционных заболеваний [1].
Вместе с тем, в настоящее время во всем мире наблюдается совершенно объективный процесс глобальный рост антибиотикорезистентности микроорганизмов к АМП. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием данных препаратов. Инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, предполагают применение комбинированной АМТ с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает условия для возникновения эпидемий. По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 миллонов человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тысячи умирают вследствие этих инфекций [2,3].
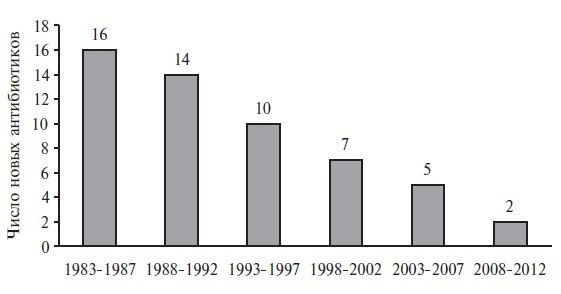
Несмотря на значительный прогресс в медицине, интенсивность разработки новых АМП за последние 30 лет значительно снизилась. Американское общество по борьбе с инфекционными болезнями в 2004 году сообщило, что за период 1998–2002 гг. количество одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) новых антибиотиков уменьшилось на 56% по сравнению с периодом 1983–1987 г.
Во втором квартале 2014 года Всемирная организация здравоохранения опубликовала отчет об антибиотикорезистентности в мире. Это один из первых детальных докладов за последние 30 лет, касающийся столь актуальной глобальной проблемы. В нем проанализированы данные из 114 стран, в том числе России, на основании которых сделан вывод о том, что резистентность к антибиотикам на сегодняшний день отмечается уже во всех странах независимо от уровня их благосостояния и экономического развития. Российская Федерация в 2014 году со своей стороны стала инициатором подписания документа, в котором закреплено, что оценка ситуации с антибиотикорезистентностью в стране является национальным приоритетом. Сложившаяся ситуация имеет большое социально-экономическое значениеи рассматривается как угроза национальной безопасности. При неэффективности стартовой терапии клиницисты вынуждены использовать альтернативные АМП, которые часто характеризуются более высокой стоимостью и худшим профилем безопасности.
Все более необходимым становится рациональное использование имеющихся АМП с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов АМП при лечении инфекций различной локализации [3,4].
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России [5].
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ. Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) [7,8].
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa [9].
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) [10].
Еще одним знаменательным событием 2016 года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе и подписана на сегодняшний день почти 100 фармацевтическими компаниями. Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются уменьшить воздействие производства АМП на окружающую среду; содействовать надлежащему применению новых и существующих АМП, в том числе за счет поддержки рекомендаций по применению АМП; продолжать и расширять научноисследовательские разработки по созданию новых АМП; поддерживать инициативы, направленные на обеспечение доступа к АМП во всех частях света при любых уровнях доходов.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ [1].
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии [4].
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет [11,12].
Без сомнения, эра АМП сыграла существенную роль в жизни современного общества. Однако только трезвый подход как к проблеме лечения АМП и ее принципам, так и к роли антибиотикотерапии в современном обществе способен обеспечить правильное планирование выпуска АМП и прогнозирование их эффективности в будущем.
Что такое приобретенная резистентность
Производится перенаправление с сайта
Всероссийской акции по тестированию на ВИЧ-инфекцию
Авторизация
Восстановление пароля
Во врачебной практике нередки случаи, когда ВИЧ-положительному пациенту назначается лечение антиретровирусной терапией, но улучшение не наступает. Проходят недели, иногда месяцы, а вирусная нагрузка по-прежнему остается высокой или даже растет. Чаще всего причиной такого состояния является резистентность. Если вы еще не знаете, что это такое, то самое время об этом поговорить.
Одним из наиболее опасных видов резистентности является кросс-резистентность. Она возникает в том случае, если из-за мутации вирус иммунодефицита человека становится невосприимчив не к одному препарату антиретровирусной терапии, а сразу к нескольким.
Возникнуть резистентность может несколькими способами. Чаще всего резистентность появляется уже в организме человека, когда вирус иммунодефицита человека не полностью контролируется применяемым АРВ-препаратом. Это зависит от множества факторов: пол, частота применения препаратов, схема применения, возраст, генетические особенности, наличие коинфекций, дозированность и многое другое. Все эти факторы учитываются при назначении терапии. Но если не соблюдать схемы, прописанные вашим лечащим врачом, то риск появления резистентности возрастает.
Гораздо реже резистентность бывает первичной, т.е. инфицирование происходит уже мутированным вирусом, который резистентен к тому или иному препарату. Однако сегодня отмечается рост первичной резистентности.
Определить резистентность можно, но очень сложно. Во-первых, потому, что далеко не везде делаются подобные исследования, во-вторых, стоимость анализа на резистентность до сих пор остается очень высокой. К тому же точность такого исследования далека от абсолютно точного результата – если в организме менее 20% копий мутированного вируса, то вероятность обнаружения резистентности очень мала. Однако сегодня ведется активная работа по разработке новых методов определения резистентности ВИЧ, они становятся дешевле и доступнее. Многие врачи сходятся во мнении, что в скором времени тесты на резистентность станут неотъемлемой частью лечения ВИЧ-положительных людей. Но в настоящее время, резистентность чаще всего определяется опытным путем – при росте вирусной нагрузки при АРВ-терапии.
Чтобы не возникало проблем с резистентностью, необходимо соблюдать несложные правила:
Как бактерии развивают устойчивость к антибиотикам и почему это так важно
Врачи предупреждают, что если не принимать меры, к 2050 году 10 000 000 человек в мире будут умирать от бактерий, которые стали устойчивыми к антибиотикам.
Именно по этой причине ВОЗ призывает все страны участвовать в борьбе с ростом резистентности к антибиотикам. Что касается России, то у нас уже разработан план мероприятий на 2019–2024 годы, в котором предусмотрены соответствующие шаги.
Но что еще важно знать о проблеме? «Аргументы и Факты» пригласили известных врачей, экспертов и ученых для обсуждения — и вот к каким выводам они пришли.
Как бактерии становятся устойчивыми
Заведующий кафедрой фармакологии Института клинической медицины Первого МГМУ им. И. М. Сеченова, доктор медицинских наук Владимир Фисенко рассказал, что бактерии, как и любые микроорганизмы, стремятся избежать гибели, используя разные механизмы для этого.
Создание новых антибиотиков направлено во многом на преодоление этих механизмов защиты бактерий.
С чего все началось
Генеральный секретарь Российского научного медицинского общества терапевтов, заместитель начальника управления науки ГБОУ ВПО «МГМСУ им. А. И. Евдокимова» Минздрава России, главный внештатный специалист-пульмонолог Министерства здравоохранения РФ по ЦФО Андрей Малявин заострил внимание на двух проблемах, которые привели к существенному росту антибиотикорезистентности.
Например, во Франции из-за этого синтетические антибактериальные средства – фторхинолоны — стали неэффективны при лечении пневмонии (воспаление легких). В России при этой инфекции активно использовали антибиотики из группы макролидов, и к ним пневмококки стали устойчивы. В новых рекомендациях для врачей по лечению пневмонии, снова советуем начинать лечение с пенициллинов, они сохранили свою эффективность.
Какие меры будут предпринимать
«Проблема устойчивости к антибиотикам имеет глобальное значение, — подчеркнула представитель ВОЗ в РФ, доктор Мелита Вуйнович. — Это очень важные и полезные лекарства, но только тогда, когда применяются рационально и по назначению. Сегодня в мире каждый год из-за инфекций, вызванных микроорганизмами, резистентными к антибиотикам, погибает 700 тысяч человек.
Важно, что стратегия «Единого здоровья» — единственно возможная мера для сохранения эффективности антибиотиков. Она охватывает сферы защиты здоровья людей, животных и окружающей среды, и разработана ВОЗ, FAO (Продовольственная организация ООН) и OIE (Всемирная организация по охране здоровья животных).
Один из эффективных способов защиты человека от резкого роста устойчивых бактерий, запрет на использование антибиотиков в качестве стимуляторов роста в животноводстве и применение их для лечения в сельском хозяйстве только в исключительных случаях. Конечно, необходимо правильное и рациональное использование антибиотиков в лечении человека».
Механизмы резистентности микроорганизмов
Механизмы резистентности к антибактериальным препаратам
ОБЩИЕ ЗАКОНОМЕРНОСТИ
Основой терапевтического действия антибактериальных препаратов является подавление жизнедеятельности возбудителя инфекционной болезни в результате угнетения более или менее специфичного для микроорганизмов метаболического процесса. Угнетение происходит в результате связывания антибиотика с мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма.
Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной.
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП
β-лактамные антибиотики
Ферментативная инактивация. Наиболее распространенным механизмом устойчивости микроорганизмов к β-лактамам является их ферментативная инактивация в результате гидролиза одной из связей β-лактамного кольца ферментами β-лактамазами. К настоящему времени описано более 200 ферментов, различающихся по следующим практически важным свойствам:
β-лактамазы встречаются у подавляющего большинства клинически значимых микроорганизмов, важным исключением являются микроорганизмы рода Streptococcus.
Все известные в настоящее время β-лактамазы делят на 4 молекулярных класса, в пределах которых ферменты характеризуются общностью свойств и выраженной гомологией. Предполагается, что β-лактамазы классов А, С и D эволюционировали из бактериальных пенициллиносвязывающих белков в почвенных экосистемах в результате селективного прессинга β-лактамных антибиотиков, продуцируемых некоторыми микроорганизмами. β-лактамазы перечисленных классов относятся к ферментам «серинового» типа (по аминокислоте, находящейся в активном центре фермента). Ферменты класса В относятся к металлоэнзимам, поскольку в качестве кофермента в них присутствует атом цинка, их происхождение менее ясно.
Наиболее важные ферменты и их свойства приведены в табл. 1.
Таблица 1. Наиболее распространенные β-лактамазы и их свойства
| Ферменты | Характеристика |
|---|---|
| Плазмидные β-лактамазы класса А стафилококков | Гидролизуют природные и полусинтетические пенициллины кроме метициллина и оксациллина. Чувствительны к ингибиторам. |
| Плазмидные β-лактамазы широкого спектра класса А грамотрицательных бактерий | Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I поколения. Чувствительны к ингибиторам. |
| Плазмидные β-лактамазы расширенного спектра класса А грамотрицательных бактерий | Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I-IV поколения. Чувствительны к ингибиторам. |
| Хромосомные β-лактамазы класса С грамотрицательных бактерий | Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I-III поколения. Не чувствительны к ингибиторам. |
| Хромосомные β-лактамазы класса А грамотрицательных бактерий | Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I-II поколения. Чувствительны к ингибиторам. |
| Хромосомные β-лактамазы класса В грамотрицательных бактерий | Эффективно гидролизуют практически все β-лактамы, включая карбапенемы. Не чувствительны к ингибиторам. |
| Плазмидные β-лактамазы класса D грамотрицательных бактерий (преимущественно P.aeruginosa) | Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I-II поколения. Многие способны также гидролизовать цефалоспорины III поколения. Большинство не чувствительны к ингибиторам. |
К наиболее распространенным ферментам относятся стафилококковые β-лактамазы (встречаются у 60-80% штаммов) и β-лактамазы широкого спектра грамотрицательных бактерий (среди штаммов E.coli встречаются в 30-40% случаев). Несмотря на широкое распространение перечисленных ферментов, они не представляют серьезной проблемы для терапии, поскольку многие современные β-лактамы (цефалоспорины II-IV поколений, ингибиторозащищенные пенициллины, карбапенемы) не чувствительны к гидролизу.
В настоящее время наибольшее значение для клинической практики имеют плазмидные БЛРС грамотрицательных бактерий, поскольку они способны разрушать цефалоспорины III и, в меньшей степени, IV поколения. Рутинные методы оценки антибиотикочувствительности очень часто не выявляют этот механизм устойчивости. Чаще всего БЛРС встречаются у микроорганизмов рода Klebsiella, достаточно часто у E.coli и Proteus spp., реже у других грамотрицательных бактерий. В России в отдельных учреждениях частота распространенности этих ферментов среди клебсиелл достигает 90%.
При тяжелых нозокомиальных инфекциях, вызванных Enterobacter spp., Citrobacter spp. и некоторыми другими микроорганизмами, в процессе лечения цефалоспоринами III поколения примерно в 20% случаев формируется резистентность к этим антибиотикам, обусловленная гиперпродукцией хромосомных β-лактамаз класса С. В таких ситуациях эффективность сохраняют цефалоспорины IV поколения и карбапенемы. К неблагоприятным тенденциям, наблюдаемым в последнее время, следует отнести мобилизацию ферментов класса С на плазмиды, что создает реальные предпосылки для их широкого распространения.
Хромосомные β-лактамазы класса В, разрушающие карбапенемы, распространены среди редких видов микроорганизмов, например, S.maltophilia.
Снижение проницаемости внешних структур грамотрицательных бактерий. Внешняя мембрана грамотрицательных микроорганизмов является препятствием для проникновения β-лактамов внутрь клетки. Транспорт антибиотика через внешнюю мембрану к чувствительным мишеням осуществляется через воронкообразные белковые структуры, получившие название «порины» или «пориновые каналы». В результате мутаций возможна полная или частичная утрата поринов, приводящая к выраженному в различной степени снижению чувствительности к β-лактамам. Указанный механизм устойчивости встречается практически среди всех грамотрицательных бактерий, обычно в сочетании с другими механизмами.
Активное выведение β-лактамов из микробной клетки. Ранее считалось, что β-лактамы активно не выводятся из микробной клетки, однако в последние годы появились сообщения о наличии у P.aeruginosa транспортных систем, осуществляющих активное выведение ряда из них и, прежде всего, карбапенемов.
Общее число описанных АМФ превышает 50, каждый из них характеризуется более или менее уникальным субстратным профилем. Гены ферментов локализуются, как правило, на плазмидах, что приводит к быстрому внутри- и межвидовому распространению устойчивости. Среди грамположительных и грамотрицательных бактерий распространены различные ферменты (табл. 2).
Таблица 2. Характеристика наиболее распространенных АМФ
| Ферменты | Устойчивость к антибиотикам |
|---|---|
| Грамположительные микроорганизмы | |
| APH (3′)-III | КАН, НЕО, АМК |
| ANT (4′)-I | ТОБ, АМК |
| ANT (6)-I | СТР |
| ААС (6′)-APH (2») | ГЕН, ТОБ, НТЛ, АМК |
| Грамотрицательные микроорганизмы | |
| ANT (2») | КАН, ГЕН, ТОБ |
| ААС (2′) | ГЕН, ТОБ, НТЛ |
| AAC (3)-V | ГЕН, ТОБ, НТЛ |
| AAC (3)-I | ГЕН |
| AAC (6′)-I | ТОБ, НТЛ, АМК |
| APH (3′)-I | КАН, НЕО |
| APH (3′)-II | КАН, НЕО |
| APH (3′)-VI | КАН, АМК |
На практике среди грамотрицательных бактерий могут встречаться практически все комбинации устойчивости к отдельным аминогликозидам. Это связано с разнообразием субстратных профилей отдельных ферментов и возможностью наличия у бактерии одновременно нескольких генов АМФ.
Для России характерна высокая частота распространения устойчивости среди грамотрицательных бактерий к гентамицину и тобрамицину, что, вероятно, связано с необоснованно широким применением гентамицина. Частота устойчивости к нетилмицину, как правило, несколько ниже. Устойчивость к амикацину встречается достаточно редко.
Число АМФ, встречающихся у грамположительных бактерий, не столь велико. Определенное клиническое значение имеет распространение среди грамположительных бактерий бифункционального фермента ААС (6′)-APH (2»), разрушающего большинство клинически значимых аминогликозидов, кроме стрептомицина и спектиномицина. Как следует из табл. 2, маркером наличия этого фермента является устойчивость к гентамицину, другие ферменты, распространенные среди грамположительных бактерий, не инактивируют этот антибиотик.
Снижение проницаемости внешних структур. Проникновение аминогликозидов через внешнюю и цитоплазматическую мембраны бактерий является сложным процессом. Низкая природная чувствительность к аминогликозидам некоторых микроорганизмов (например, B.cepacia) связана именно с недостаточной проницаемостью для АМП внешней мембраны этих микроорганизмов. Их мутации, приводящие к изменению структуры липополисахарида у E.coli и P.aeruginosa, могут обусловить значительное повышение устойчивости к аминогликозидам.
Природная устойчивость к аминогликозидам анаэробов объясняется тем, что транспорт этих антибиотиков через цитоплазматическую мембрану связан с системами переноса электронов, которые у анаэробов отсутствуют. По этой же причине факультативные анаэробы в условиях анаэробиоза, становятся значительно более устойчивыми к аминогликозидам, чем в аэробных условиях.
Практически важным фактом является природная устойчивость к аминогликозидам стрептококков и энтерококков, связанная с преимущественно анаэробным метаболизмом этих бактерий и, соответственно, невозможностью транспорта антибиотиков к чувствительным мишеням. При совместном воздействии на микробную клетку аминогликозидов и β-лактамов последние нарушают структуру цитоплазматической мембраны бактерий и облегчают транспорт аминогликозидов. В результате этого между β-лактамами и аминогликозидами проявляется выраженный синергизм.
Появляются данные о том, что аминогликозиды могут подвергаться активному выведению из микробной клетки.
Модификация мишени действия. Основной мишенью действия аминогликозидов является 30S субъединица бактериальной рибосомы, в некоторых случаях устойчивость может быть связана с ее модификацией. Распространение и клиническое значение устойчивости, связанной с модификацией мишени незначительно.
Поскольку топоизомеразы выполняют несколько различные функции, то для подавления жизнедеятельности микробной клетки достаточно ингибировать активность только одного фермента, активность второго может сохраняться. Эта особенность объясняет тот факт, что для всех хинолонов можно выделить первичную и вторичную мишень действия. Первичной мишенью является тот фермент, к которому данный хинолон проявляет наибольшее сродство. Хинолонов, которые бы проявляли абсолютно одинаковое сродство к обеим топоизомеразам не существует.
Основным механизмом устойчивости к хинолонам является изменение структуры топоизомераз в результате мутаций в соответствующих генах и аминокислотных замен в молекулах ферментов. Аминокислотные замены, в свою очередь, приводят к снижению сродства хинолонов к ферментам и повышению МПК препаратов. Частота возникновения мутаций, вероятно, мало зависит от воздействия хинолонов, однако, формирование устойчивых штаммов возможно лишь в результате селекции на фоне действия препаратов. В подавляющем большинстве случаев устойчивость формируется ступенеобразно. После возникновения и селекции мутаций в генах фермента, являющегося первичной мишенью действия хинолонов, МПК препаратов обычно повышается в 4-8 раз, а антибактериальный эффект проявляется за счет подавления активности фермента, являющегося вторичной мишенью. Если воздействие хинолонов на микроорганизм продолжается, то возможно возникновение и селекция мутаций во вторичной мишени и, как следствие, повышение МПК еще в 4-8 раз. У штаммов бактерий с высоким уровнем устойчивости обычно обнаруживают несколько мутаций в генах обеих топоизомераз.
Считается, что фторхинолоны, обладающие приблизительно одинаковым сродством к обеим топоизомеразам, в наименьшей степени способствуют селекции устойчивости. Это связано с тем, что для формирования устойчивого штамма мутации должны произойти одновременно в генах обоих ферментов, вероятность же двойных мутаций существенно ниже, чем одиночных.
Важно отметить, что, за некоторыми исключениями, мутации в генах топоизомераз приводят к приблизительно одинаковому снижению сродства к ферментам для всех хинолонов. Однако клиническое значение это приобретает лишь в том случае, если МПК становится выше фармакодинамически обоснованного критерия чувствительности. Так, например, при исходных величинах МПК левофлоксацина и моксифлоксацина в отношении штамма пневмококка 1,0 и 0,12 мг/л, соответственно, снижение сродства хинолонов к топоизомеразе IV в 8 раз приведет к увеличению МПК до 8,0 и 1,0 мг/л. По фармакодинамически обоснованным критериям мутантный штамм окажется устойчивым к левофлоксацину, но сохранит чувствительность к моксифлоксацину.
Активное выведение. В последние годы накапливаются данные о широком распространении среди грамположительных и грамотрицательных микроорганизмов устойчивости, связанной с активным выведением хинолонов. У штаммов с высоким уровнем устойчивости к фторхинолонам этот механизм часто сочетается с модификацией мишеней.
В России устойчивость к фторхинолонам (ципрофлоксацину и офлоксацину) является реальной проблемой при лечении нозокомиальных инфекций. Быстрее всего резистентность формируется у штаммов P.aeruginosa. Появляются данные о росте устойчивости к фторхинолонам среди пневмококков.
Макролиды, кетолиды и линкозамиды
Метилирование мишени действия макролидов обусловливает высокий уровень устойчивости к этим антибиотикам (МПК > 32-64 мг/л).
Описано два варианта синтеза метилазы: конститутивный и индуцибельный. При конститутивном типе синтез фермента не зависит от внешних условий. Соответственно, бактерии проявляют устойчивость ко всем макролидам и линкозамидам. При индуцибельном типе синтеза фермента для его начала необходима индукция. Синтез стрептококковых метилаз индуцируется всеми макролидами и линкозамидами, соответственно микроорганизмы проявляют устойчивость ко всем перечисленным антибиотикам. В отличие от этого, синтез стафилококковых метилаз способен индуцировать только 14- и 15-членные макролиды, соответственно микроорганизмы проявляют устойчивость к перечисленным антибиотикам, но сохраняют чувствительность к 16-членным макролидам и линкозамидам. Таким образом, в клинической практике могут встречаться стафилококки устойчивые как ко всем макролидам и линкозамидам, так и только к 14- и 15-членным макролидам.
Активное выведение. Активное выведение макролидов и линкозамидов осуществляют несколько транспортных систем. Основное клиническое значение имеет система выведения, кодируемая mef-геном, распространенная среди S.pneumoniae, S.pyogenes и многих других грамположительных бактерий. Соответствующий белок-транспортер выводит 14- и 15-членные макролиды и обеспечивает невысокий уровень резистентности (МПК от 1 до 32 мг/л). Линкозамиды и 16-членые макролиды сохраняют активность.
Гены mef локализованы на хромосомах в составе конъюгативных элементов, что обеспечивает достаточно эффективное внутри- и межвидовое распространение. У стафилококков и энтерококков активное выведение макролидов, но не линкозамидов, осуществляют транспортные системы другого типа, кодируемые генами msr. Существуют также транспортные системы, осуществляющие избирательное выведение некоторых препаратов, например, линкомицина или олеандомицина.
Ферментативная инактивация. Ферменты, инактивирующие макролиды и линкозамиды, описаны среди грамположительных и грамотрицательных микроорганизмов. Некоторые из них обладают широким субстратным профилем (макролидфосфотрансферазы E.coli и Staphylococcus spp.), другие инактивируют только отдельные антибиотики (эритромицинэстеразы, распространенные среди семейства Enterobacteriaceae, линкомицинацетилтрансферазы стафилококков и энтерококков). Клиническое значение ферментов, инактивирующих макролидные антибиотики, невелико.
Роль отдельных механизмов резистентности к макролидам не равноценна. Накапливаются данные о том, что при инфекциях, вызываемых S. pneumoniae и S. pyogenes с устойчивостью, обусловленной активным выведением, некоторые макролиды могут сохранять клиническую эффективность.
В России устойчивость к макролидам и линкозамидам закономерно распространена среди метициллинорезистентных стафилококков. Среди метициллиночувствительных стафилококков частота устойчивости, как правило, не превышает 10%.
В Европе в последние годы наблюдается тенденция к росту устойчивости к макролидам среди S.pyogenes, S.pneumoniae, что связывают со значительным увеличением объема применения современных макролидов (азитромицина, кларитромицина, рокситромицина) в качестве препаратов выбора для лечения инфекций ДП легкой степени. Целесообразность такого расширения показаний вызывает дискуссии.
Надежных данных о многолетней динамике устойчивости S.pneumoniae и S.pyogenes к макролидам в России нет. В Москве в период с 1998 г. по 2001 г уровень устойчивости пневмококков к макролидам колеблется в пределах 8-12%, преобладающим механизмом является активное выведение. Устойчивость достигает 18%, во всех случаях она связана с активным выведением. Фиксируемый в последние годы уровень частоты устойчивости должен вызывать настороженность.
Защита рибосомы. Известно семейство защитных белков, которые позволяют бактерии синтезировать белок, несмотря на связывание с рибосомой молекулы тетрациклина. Механизм подобной защиты неизвестен. Описано, по меньшей мере, 5 генов, кодирующих защитные белки, они распространены среди грамотрицательных и грамположительных бактерий и детерминируют устойчивость ко всем тетрациклинам.
Частота устойчивости к тетрациклинам среди клинически наиболее значимых микроорганизмов достаточно высока, что не позволяет рассматривать их как средства выбора для лечения большинства инфекций.
Модификация мишени действия. Механизм действия гликопептидов заключается в блокировании завершающей стадии синтеза пептидогликана путем связывания молекулы антибиотика с концевыми аминокислотами в боковой пептидной цепочке (D-аланин-D-аланин).
Механизм устойчивости к гликопептидам наиболее детально изучен у энтерококков, он связан с синтезом бактериями модифицированной боковой полипептидной цепи.
Устойчивость энтерококков к гликопептидам является серьезной проблемой в ОРИТ в США и Западной Европе. Чаще всего устойчивость отмечают у штаммов E.faecium, ее частота может достигать 15-20%. Достоверных данных о выделении VRE в России нет.
Сообщения о выделении единичных штаммов метициллинорезистентных и метициллиночувствительных S.aureus со сниженной чувствительностью к ванкомицину (GISA) начали появляться в различных странах с 1997г.. Для штаммов со сниженной чувствительностью характерно утолщение клеточной стенки, уменьшение аутолитической активности. Обсуждается возможность избыточной продукции мишеней действия гликопептидов. Снижение чувствительности к гликопептидам было описано ранее среди КНС.
Гены ферментов, устойчивых к ингибированию, часто находятся в составе подвижных генетических элементов (транспозонов) в ассоциации с генами, детерминирующими устойчивость к другим антибиотикам.
Модификация мишени действия. Устойчивость может также сформироваться в результате мутаций в генах указанных ферментов.
Полимиксины оказывают бактерицидное действие на грамотрицательные бактерии, нарушая целостность цитоплазматической мембраны, действуя подобно поверхностно активным веществам. Приобретенная устойчивость отмечается редко.
Механизм действия нитрофуранов изучен недостаточно полно. Считается, что приобретенная устойчивость к этим препаратам встречается крайне редко, о ее механизмах можно судить лишь предположительно.
Нитроимидазолы активируются в микробной клетке ферментом нитроредуктазой, возникающие при этом свободные радикалы, повреждают ДНК бактерий. Устойчивость у подавляющего большинства анаэробных бактерий отмечается крайне редко и не имеет практического значения.
Реальные проблемы возникают при развитии устойчивости у H.pylori, обусловленной инактивацией нитроредуктазы в результате мутаций в соответствующих генах.
МНОЖЕСТВЕННАЯ УСТОЙЧИВОСТЬ, СВЯЗАННАЯ СО СНИЖЕНИЕМ ПРОНИЦАЕМОСТИ
Снижение проницаемости внешних структур бактериальной клетки является наименее специфичным механизмом устойчивости и, обычно, приводит к формированию устойчивости одновременно к нескольким группам антибиотиков.
Снижение проницаемости за счет утраты или снижения количества пориновых белков встречается в ассоциации с продукцией β-лактамаз расширенного спектра. Утрата одного из пориновых белков (D2) P.aeruginosa приводит к избирательному снижению чувствительности микроорганизма к имипенему.
ЗАКЛЮЧЕНИЕ
В заключение целесообразно коротко суммировать данные о наиболее распространенных механизмах резистентности среди основных клинически значимых микроорганизмов.
Возбудители внебольничных инфекций
Механизмы резистентности к противотуберкулезным препаратам
Особенности патогенеза туберкулеза и биологии возбудителя (медленная пролиферация, длительное персистирование в организме и последующая реактивация инфекции) накладывают определенные отпечатки на формирование устойчивости у микобактерий. Из-за крайне ограниченных возможностей генетического обмена между микобактериями формирование у них резистентности практически всегда связано с накоплением хромосомных мутаций в генах, кодирующих мишени действия препаратов.
Терминология антибиотикоустойчивости микобактерий отличается некоторыми особенностями, что связано с чисто практическими задачами. Согласно рекомендациям ВОЗ, в зависимости от того, получал ли пациент специфическую противотуберкулезную терапию до выделения возбудителя, различают первичную и приобретенную устойчивость. К микроорганизмам с первичной устойчивостью относят штаммы, выделенные от пациентов, не получавших специфическую терапию. Если устойчивый штамм выделен у пациента на фоне противотуберкулезной терапии, то устойчивость расценивают как приобретенную. В тех случаях, когда невозможно достоверно установить факт применения противотуберкулезных препаратов, используют термин «начальная» устойчивость. К множественноустойчивым микобактериям относят микроорганизмы, устойчивые, как минимум, к рифампицину и изониазиду.


