что такое оксигемоглобин в биологии
ОКСИГЕМОГЛОБИН
Смотреть что такое ОКСИГЕМОГЛОБИН в других словарях:
ОКСИГЕМОГЛОБИН
см. Гемоглобин, Кровь, Дыхание.
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН, о к с и г е н и р о в а н н ы й гемоглобин, НbО2, продукт обратимого присоединения кислорода к «восстановленному» гемоглобину (НЬ); п. смотреть
ОКСИГЕМОГЛОБИН
Оксигемоглобин — см. Гемоглобин, Кровь, Дыхание.
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН оксигенированный гемоглобин, соединение гемоглобина (Нb) с мол. кислородом; переносит О2 от органов дыхания к тканям и определяет ярко-. смотреть
ОКСИГЕМОГЛОБИН
оксигемоглоби́н (см. окси. ) соединение гемоглобина с кислородом, образующееся при прохождении крови по капиллярам органов дыхания и легко распадающе. смотреть
ОКСИГЕМОГЛОБИН
1) Орфографическая запись слова: оксигемоглобин2) Ударение в слове: оксигемоглоб`ин3) Деление слова на слоги (перенос слова): оксигемоглобин4) Фонетиче. смотреть
ОКСИГЕМОГЛОБИН
(оксигенированный гемоглобин HbO2) соединение гемоглобина с кислородом. Переносит о2 от органов дыхания к тканям, определяет ярко-красный цвет артериальной крови. относительное содержание о. в крови зависит от парциального давления кислорода. При высоком парциальном давлении о2 (в капиллярах легких) гемоглобин (Hb) на 95 % находится в форме Hbо2. При прохождении крови по капиллярам тканей о. распадается с выделением кислорода. Гемоглобин отдает тканям свой кислород и затем забирает углекислый газ (Со2), выделяющийся в процессе жизнедеятельности тканей. Соединение гемоглобина с углекислым газом называется карбгемоглобином (HbСо2). в капиллярах легких карбгемоглобин легко распадается на Hb и Со2. См. также Карбоксигемоглобин, Оксид углерода. смотреть
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН, соединение ГЕМОГЛОБИНА из ЭРИТРОЦИТОВ (красных кровяных клеток) с кислородом, поступающим из легких. В этой форме кислород в крови пере. смотреть
ОКСИГЕМОГЛОБИН
Ударение в слове: оксигемоглоб`инУдарение падает на букву: иБезударные гласные в слове: оксигемоглоб`ин
ОКСИГЕМОГЛОБИН
(oxyhaemoglobin) ярко-красное вещество, образующееся благодаря обратимому соединению содержащегося в эритроцитах пигмента гемоглобина с кислородом. Оксигемоглобин является той формой, в которой кислород переносится из легких в различные ткани организма, где затем происходит его освобождение. Для сравнения: Метгемоглобин. смотреть
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
(Окси- + Гемоглобин;. син. гемоглобин оксигенированный)форма гемоглобина, в которой он обратимо соединен с кислородом и обеспечивает перенос последнего. смотреть
ОКСИГЕМОГЛОБИН
гемоглобин, связанный с кислородом; переносит кислород от органов дыхания к тканям, определяет ярко-красный цвет артериальной крови. Синонимы: гематог. смотреть
ОКСИГЕМОГЛОБИН
оксигемоглобин (окси- + гемоглобин; син. гемоглобин оксигенированный) — форма гемоглобина, в которой он обратимо соединен с кислородом и обеспечивает п. смотреть
ОКСИГЕМОГЛОБИН
(окси- + гемоглобин; син. гемоглобин оксигенированный) форма гемоглобина, в которой он обратимо соединен с кислородом и обеспечивает перенос последнего кровью от легких к тканям. смотреть
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН, гемоглобин, соединенный с кислородом; переносит кислород от органов дыхания к тканям, определяет ярко-красный цвет артериальной крови. смотреть
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН, гемоглобин, соединенный с кислородом; переносит кислород от органов дыхания к тканям, определяет ярко-красный цвет артериальной крови. смотреть
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
— гемоглобин, соединенный с кислородом; переносит кислородот органов дыхания к тканям, определяет ярко-красный цвет артериальнойкрови.
ОКСИГЕМОГЛОБИН
(2 м)Синонимы: гематоглобулин, гемоглобин
ОКСИГЕМОГЛОБИН
оксигемоглобинСинонимы: гематоглобулин, гемоглобин
ОКСИГЕМОГЛОБИН
氧络血红朊Синонимы: гематоглобулин, гемоглобин
ОКСИГЕМОГЛОБИН
ОКСИГЕМОГЛОБИН
Смотреть что такое «ОКСИГЕМОГЛОБИН» в других словарях:
оксигемоглобин — оксигемоглобин … Орфографический словарь-справочник
ОКСИГЕМОГЛОБИН — гемоглобин, соединенный с кислородом; переносит кислород от органов дыхания к тканям, определяет ярко красный цвет артериальной крови … Большой Энциклопедический словарь
ОКСИГЕМОГЛОБИН — оксигенированный гемоглобин, соединение гемоглобина (Нb) с мол. кислородом; переносит О2 от органов дыхания к тканям и определяет ярко красный цвет артериальной крови. О2 связывается с Нb через Fe2+ гема. Относит, содержание О. в крови зависит от … Биологический энциклопедический словарь
оксигемоглобин — сущ., кол во синонимов: 2 • гематоглобулин (1) • гемоглобин (6) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ОКСИГЕМОГЛОБИН — (оксигенированный гемоглобин HbO2) соединение гемоглобина с кислородом. Переносит О2 от органов дыхания к тканям, определяет ярко красный цвет артериальной крови. Относительное содержание О. в крови зависит от парциального давления кислорода. При … Российская энциклопедия по охране труда
оксигемоглобин — Форма гемоглобина hemoglobin, образующаяся при оксигенации, т.е. присоединение к одному из гемов молекулы кислорода; такая способность (например, у высших позвоночных) обусловлена присутствием двухвалентного иона железа в геме; образование О.… … Справочник технического переводчика
оксигемоглобин — гемоглобин, связанный с кислородом; переносит кислород от органов дыхания к тканям, определяет ярко красный цвет артериальной крови. * * * ОКСИГЕМОГЛОБИН ОКСИГЕМОГЛОБИН, гемоглобин, соединенный с кислородом; переносит кислород от органов дыхания… … Энциклопедический словарь
Оксигемоглобин — Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета Гем группа Гемоглобин (от др. греч. αἷμα кровь и лат. globus шар) сложный железосодержащий белок … Википедия
оксигемоглобин — (см. окси. ) соединение гемоглобина с кислородом, образующееся при прохождении крови по капиллярам органов дыхания и легко распадающееся в тканях тела, благодаря чему осуществляется перенос кислорода из органов дыхания к тканям. Новый словарь… … Словарь иностранных слов русского языка
Что такое оксигемоглобин в биологии
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
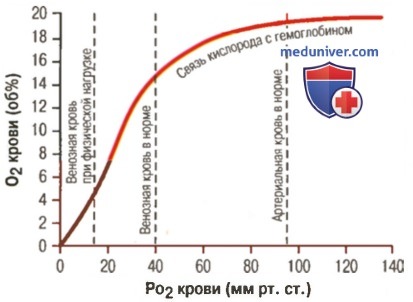
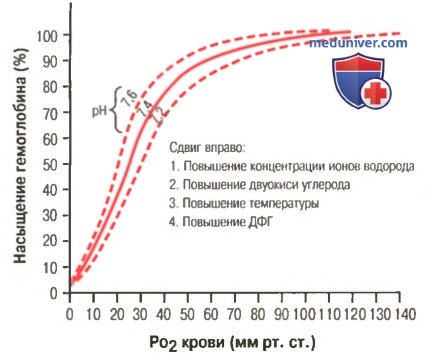
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое оксигемоглобин в биологии
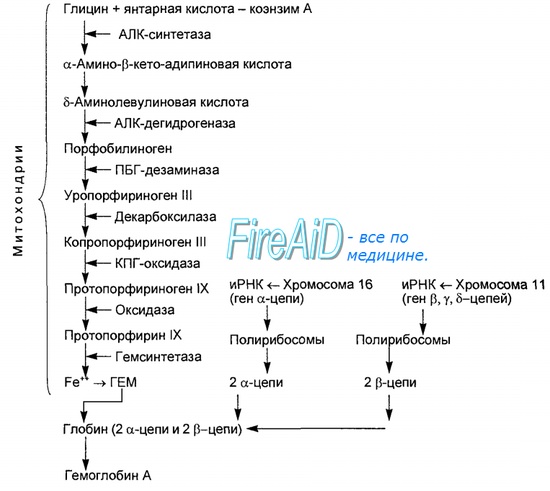
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Что такое оксигемоглобин в биологии
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
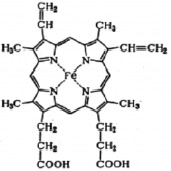
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].
Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HbA – это «зрелый» гемоглобин, который имеется у каждого человека. При рождении его содержание составляет 80 %, а затем повышается до 95–98 %.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
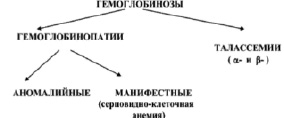
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].
Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Синдром матового стекла, обнаруживаемый в легких на КТ – это скопление [8], атакованного вирусом и утратившего способность к переноске кислорода [8]. Ученые обнаружили, что у пациентов наблюдается низкий уровень ферритина – белка, который является «хранилищем» железа в организме. На фоне недостаточного количества ферритина развивается анемия.
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
MetHb может образовываться как побочный продукт физиологической реакции в виде адаптивной повышенной передачи сигналов оксида азота (NO) вследствие острой анемии. Анемия может быть связана с инфекцией или системной воспалительной реакцией, называемой «анемией воспаления», как часть физиологической реакции на заболевание [9]. Согласно исследованию Bellmann-Weiler et al. [9] из 259 госпитализированных пациентов с COVID-19 24,7 % были анемичны при поступлении, причем большинство страдало воспалительной анемией (68,8 %). Во время госпитализации процент пациентов с анемией увеличился (около 68,8 % на 7-й день). Значительно более высокая смертность во время госпитализации была также обнаружена у пациентов с анемией при поступлении. Анемия связана с повышенной концентрацией NO, приводящей к вазодилатации. Она предотвращала тканевую гипоксию, но в то же время вызывала NO-основанное окисление Hb в MetHb. MetHb активирует путь NF-kB в эндотелиальных клетках, связанный с продукцией хемокинов (IL-8) и цитокинов (IL-6). Активация путей NF-kB и MAPK с последующим высвобождением хемокинов IL-8 и хемокинового моноцитарного хемоаттрактантного белка-1 (MCP-1) также наблюдалась в эндотелиальных клетках, подвергнутых воздействию MetHb [8]. Это подчеркивает, что повышение уровня MetHb в крови оказывает влияние на выработку цитокинов/хемокинов – факт, который может иметь особое значение для COVID-19, поскольку при тяжелом течении заболевания наблюдается «цитокиновый шторм». И следует иметь в виду, что гипоксия также вызывает выработку IL-8 и IL-6 [9].
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.