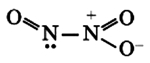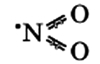что такое оксид азота в химии
Оксиды азота
Азот образует несколько оксидов:
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
Оксид азота NO(II)
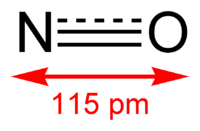
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
Монооксид азота используют для получения азотной кислоты.
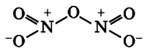
Оксид азота N2O3(III)
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксид азота

Оксид азота или окись азота, а также известный как монооксид азота представляет собой молекулу с химической формулой NO. Это свободные радикалы, которые является важным промежуточным продуктом химических реакций.
В организмах млекопитающих и человека оксид азота является важной составляющей клеточных сигнальных молекул, участвующих во многих физиологических и патологических процессах. Это мощный вазодилататор с коротким, в несколько секунд, периодом полураспада в крови.
В конце 80-х годов было доказано, что особые ферментные системы организмов способны синтезировать газ оксида азота. Это происходит в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом цитруллина.
Получение оксида азота
В лабораторных условиях получение оксида азота возможно путем проведения реакции разбавленной азотной кислоты с медью или восстановлением азотистой кислоты в виде нитрита натрия или нитрита калия.
Основным природным источником оксида азота являются электрические разряды молний в грозу. Оксид азота является побочным продуктом, возникающим при сгорании веществ в автомобильных двигателях и топлива на электростанциях.
Также получение оксида азота возможно из свободных элементов, для этого необходимо при температуре 1200-1300°C провести соединение азота с кислородом.
Применение оксида азота
Оксид азота используется в медицине для расширения кровеносных сосудов при ишемической болезни сердца путем уменьшения нагрузки на сердце.
Оксид азота используется при неотложной помощи для содействия капиллярному расширению легких для лечения первичной легочной гипертензии у новорожденных, связанной с врожденными дефектами. Терапия оксидом азота значительно повышает качество жизни и, в некоторых случаях, спасает жизнь детей с риском развития заболевания сосудов легких.
Оксид азота также вводится в виде спасительной терапии у больных с острой правожелудочковой недостаточностью, которая является вторичной по отношению к легочной эмболии.
В пищевой промышленности оксид азота известен под названием пищевая добавка Е942 и используется в качестве пропеллента и упаковочного газа.
Свойства оксида азота
Польза оксида азота

Вред оксида азота
Применение оксида азота у большинства людей не вызывает побочных эффектов, однако, в случаях передозировки он приводит к диарее, слабости, тошноте, головной боли, учащению пульса и сердцебиения, задержкам воды, усталости, раздражениям на коже и сухости во рту.
Также побочными эффектами применения оксида азота являются проблемы с дыханием, сильная аллергия или сыпь, крапивница, зуд, одышка, опасные для жизни осложнения астмы, внезапный озноб, потливость, тремор, рвота и обмороки. В некоторых случаях применение оксида азота приводит к вспышкам герпеса, расширению сосудов и кровотечениям.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Оксиды азота. Азотная кислота
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):

Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
В избытке кислорода образуется только нитрат натрия:
Ниже 22 0 С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0 С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0 С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
Как и все кислоты, она реагирует:
в) с солями более слабых кислот:
Окислительно – восстановительные свойства

Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:

Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
В промышленности получение азотной кислоты идет в три стадии:
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
*на изображении записи кристаллы нитрата меди (II)
Оксид азота
Оксиды азота — соединения азота с кислородом.
Содержание
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО2, N2O4
Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Полезное
Смотреть что такое «Оксид азота» в других словарях:
Оксид азота(II) — Оксид азота(II) … Википедия
Оксид азота(I) — Газ без цвета, со сладким вкусом и запахом Общие Систематическое наименование Оксонитрид азота(I) Химическая формула N2O Физические свойства … Википедия
Оксид азота(IV) — Оксид азота(IV) … Википедия
Оксид азота (II) — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Оксид азота(V) — Оксид азота(V) … Википедия
Оксид азота (IV) — Оксид азота(IV) Общие … Википедия
Оксид азота (I) — Оксид азота(I) Общие Систематическое наименование Оксид азота(I) Химическая формула N2O Отн. молек. масса 44 а. е. м … Википедия
Оксид азота (V) — Оксид азота(V) Общие Систематическое наименование Оксид азота(V) Химическая формула … Википедия
оксид азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen monoxide A colourless gas, soluble in water, ethanol and ether. It is formed in many reactions involving the reduction of nitric acid, but more convenient reactions… … Справочник технического переводчика
оксид азота (NO) — 3.5.3 оксид азота (NO): Продукт, относящийся к классу опасности 3. Источник: ГОСТ Р 51206 20 … Словарь-справочник терминов нормативно-технической документации
Окись азота
Окись азота
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Полезное
Смотреть что такое «Окись азота» в других словарях:
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
окись азота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN nitric oxide … Справочник технического переводчика
окись азота — azoto oksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Azoto junginys su deguonimi: N₂O, NO, NO₂, N₂O₃, N₂O₄, N₂O₅. atitikmenys: angl. nitric oxide; nitrogen monoxide vok. Stickoxid, n; Stickstoffmonoxid, n rus. окись азота, f … Ekologijos terminų aiškinamasis žodynas
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
азота окись — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
азота(II) оксид — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона