что такое очаговый фиброз стромы эндометрия
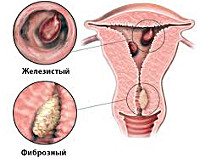
Хронический эндометрит
Хронический эндометрит (ХЭ) – воспалительное заболевание слизистой оболочки матки (эндометрия).
Заболевание встречается преимущественно у женщин репродуктивного возраста (26-35 лет), ведет к нарушению менструальной и генеративной функции, служит причиной бесплодия, невынашивания беременности. У женщин с бесплодием частота встречаемости ХЭ составляет от 12 до 68%, а у пациенток с привычным невынашиванием беременности – более 70%. У больных с неудачной попыткой ЭКО и ПЭ хронический эндометрит встречается в 60% случаях.
ХЭ чаще всего развивается после аборта или родов, в результате осложнений внутриматочных манипуляций, таких как выскабливание полости матки, биопсия эндометрия, гистероскопия, гистеросальпингография, использование ВМС. Развитию ХЭ также предшествуют воспалительные заболевания органов малого таза, инфекции влагалища и шейки матки, деформация полости матки с нарушением отторжения эндометрия во время менструации, перенесенные ИППП (инфекции, передающиеся половым путем).
Чаще всего возбудителями ХЭ в современных условиях являются микст – инфекции (сочетание вирусно-бактериальной и условно-патогенной флоры). Особое место занимает герпетическое поражение эндометрия, которое чаще всего бывает у женщин, страдающих различным формами генитального герпеса.
Длительное присутствие инфекционных агентов в эндометрии приводит к выраженным изменениям его структуры и свойств, что вызывает нарушение нормальной имплантации эмбриона и формирования плаценты. Морфологические изменения структуры эндометрия сопровождаются выраженной воспалительной реакцией, в результате которой нарушается местная микроциркуляция.
Клинически ХЭ проявляется циклическими маточными кровотечениями, перименструальными кровянистыми выделениями, болевым синдромом, выделениями из половых путей (гноевидные и серозные бели), бесплодием и невынашиванием беременности. У 9-38% пациенток с ХЭ могут отсутствовать какие-либо симптомы, и заболевание протекает субклинически и бессимптомно.
Диагностика ХЭ
Обязательным этапом диагностики данного заболевания является морфологическое исследование материала, которое проводят в среднюю и позднюю фазу пролиферации эндометрия – на 7-10 день менструального цикла.
Морфологические критерии диагностики ХЭ:
Важным методом диагностики ХЭ является ультразвуковое исследование органов малого таза, которое должно предшествовать морфологическому методу.
Исследование проводят дважды: в первые 1-3 дня после менструации и за 2-3 дня до начала месячных.
Наиболее частые эхографические признаки хронического эндометрита это:
Гистероскопия является инвазивным и окончательным методом при установлении диагноза и состоит из визуализации полости матки и биопсии эндометрия с последующим микробиологическим и морфологическим исследованием ткани.
Наиболее характерные гистероскопические признаки ХЭ:
Лечение ХЭ
На первом этапе необходимо удалить повреждающий агент. С этой целью используют антимикробные и противовирусные лекарственные препараты, обеспечивающие элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы и стрептококк. Оправдано назначение нескольких курсов этиотропного лечения со сменой групп препаратов.
Одновременно проводится коррекция иммунных нарушений.
Второй этап лечения направлен на коррекцию метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. С этой целью применяются физические факторы (электроимпульсная терапия, переменное магнитное поле низкой частоты и т.д.). Физиотерапию проводят с 5-7-го дня менструального цикла ежедневно. С целью метаболической терапии используются метаболические препараты не менее 3-4 недель.
Контроль эффективности терапевтических мероприятий проводится через 2 месяца после окончания лечения путем применения аспирационной биопсии эндометрия.
Необходимо помнить, что хороший эндометрий – одно из главных условий успешного прикрепления плодного яйца.
Источники: «Бесплодный брак» под редакцией, В.И.Кулакова, «Хронический эндометрит», Г.Т.Сухих, А.В.Шуршалина, «Женское бесплодие», В.А.Кулавский, «Патология полости матки», В.Н.Демидов, А.И.Гус.
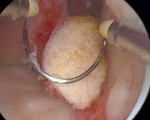
Фиброзный полип эндометрия
Фиброзный полип эндометрия — это доброкачественная соединительнотканная опухоль на широком основании или ножке, происходящая из внутренней оболочки матки. В большинстве случаев заболевание протекает бессимптомно и только при наличии крупного новообразования проявляется маточными кровотечениями и болями в нижней части живота. Для диагностики используют УЗИ и контрастную рентгенографию матки, гистероскопию, гистологическое исследование соскоба. Лечение — оперативное: трансцвервикальная гистерорезектоскопия с прижиганием ложа опухоли и последующим кюретажем матки либо лечебно-диагностическое выскабливание.
МКБ-10
Общие сведения
В отличие от других видов полипов эндометрия, фиброзные неоплазии образованы соединительной тканью и лишь в некоторых случаях имеют в составе небольшое количество желез. Размеры большинства новообразований не превышают 1 см, а сами опухоли являются единичными и развиваются на фоне атрофии слизистой матки. Такие новообразования отличаются низким уровнем васкуляризации и пролиферации. Как правило, полипы фиброзного типа нечувствительны к гормонам. Они крайне редко поражают пациенток репродуктивного возраста и обычно выявляются у женщин старше 40 лет в период пременопаузы, менопаузы и постменопаузы. У девочек до наступления менархе соединительнотканные неоплазии эндометрия не развиваются.
Причины
Хотя более чем в половине случаев доброкачественные опухоли эндометрия формируются на фоне гормонального дисбаланса, у пациенток с фиброзным полипозом уровень эстрогенов обычно нормальный или сниженный. По мнению многих специалистов в сфере гинекологии, основной причиной образования соединительнотканных полипов являются негормональные причины:
Патогенез
Точные механизмы формирования фиброзных полипов эндометрия на сегодняшний день не известны. Предположительно, этот процесс сопровождается сочетанным нарушением гуморального и клеточного иммунитета, при котором локальные атрофические, воспалительные и постравматические повреждения базального слоя эпителия стимулируют активную пролиферацию соединительной ткани. Важным звеном неогенеза является устойчивость морфологически измененных клеток к апоптозу (запрограммированной гибели), обеспечивающая постепенный рост полипа. По мере развития новообразования формируется его ножка, по которой проходят сосуды для питания медленно пролиферирующей ткани.
Симптомы фиброзного полипа
Неоплазии маленьких размеров обычно протекают бессимптомно и становятся случайной находкой при проведении УЗИ матки. В репродуктивном возрасте могут отмечаться незначительные кровянистые выделения из влагалища между менструациями. Женщины в период пременопаузы жалуются на длительные нерегулярные кровотечения, в менопаузе и постменопаузе возникают периодические скудные кровянистые выделения из половых путей, которые могут быть как кратковременными, так и длительными. Характерны небольшие контактные кровотечения во время полового акта.
При крупных новообразованиях наблюдаются тянущие или схваткообразные болевые ощущения в нижней части живота. Крайне редко при некробиозе опухоли появляются влагалищные бели в виде умеренных по количеству, молочно-белых выделений. Стоит отметить, что симптоматика фиброзного полипоза неспецифична — аналогичные проявления отмечаются при других формах полипов и ряде гинекологических заболеваний.
Осложнения
Фиброзные полипы матки осложняются крайне редко. У женщин детородного возраста новообразование, растущее в области устья маточной трубы, может стать причиной трубной внематочной беременности. Большие по размеру полипы препятствуют имплантации яйцеклетки и приводят к возникновению бесплодия. Если опухоль сопровождается кровотечениями, у пациентки развивается постгеморрагическая анемия. В некоторых случаях фиброзная неоплазия подвергается некрозу с последующим воспалением и появлением признаков общей интоксикации. Риск злокачественного перерождения фиброзного полипа невысокий — 0,5-1,5%, однако в период постменопаузы он возрастает до 7-8%.
Диагностика
С учетом неспецифичности клинических проявлений и данных гинекологического осмотра ключевую роль в постановке диагноза играют инструментальные методы. При подозрении на фиброзный полип эндометрия рекомендованы:
Фиброзный полип необходимо дифференцировать от других форм полипов тела и шейки матки, а также субмукозных миом. При обследовании крайне важно исключить озлокачествление новообразования. В сомнительных случаях к диагностике привлекают онкогинеколога.
Лечение фиброзного полипа эндометрия
Поскольку соединительнотканные новообразования эндометрия нечувствительны к действию гормонов, коррекция гормонального фона при таких опухолях неэффективна. При единичных неоплазиях размерами до 1 см и отсутствии клинических проявлений рекомендовано динамическое наблюдение с гистероскопическим и УЗИ-контролем. В остальных случаях используют один из хирургических методов лечения:
Прогноз и профилактика
Прогноз при фиброзных полипах эндометрия благоприятный. Однако удаление опухоли без прижигания ее ложа в 30% случаях сопровождается рецидивом заболевания. В профилактических целях рекомендуется своевременное лечение воспалительных заболеваний женской половой сферы, сопутствующих эндокринных заболеваний и гипертонической болезни, упорядоченная сексуальная жизнь, обоснованное назначение инвазивных лечебно-диагностических процедур, планирование беременности с отказом от абортов. Регулярный осмотр гинеколога и периодическое УЗИ матки позволяют вовремя диагностировать неоплазию и подобрать оптимальную тактику лечения для профилактики возможных осложнений.
Хронический эндометрит — проблема и решения
Рассмотрены факторы риска развития хронического эндометрита, клинические симптомы заболевания, методы диагностики и подходы к комплексной терапии.
An examination was performed on the factors of the risk of the development of chronic endometritis, clinical symptoms of disease, methods of diagnostics and approaches to complex therapy.
.jpg)
В настоящее время актуальность проблемы ХЭ приобретает не только медицинское, но и социальное значение, поскольку данное заболевание часто приводит к нарушению репродуктивной функции, являясь причиной бесплодия, неудачных попыток экстракорпорального оплодотворения (ЭКО), невынашивания беременности (НБ), осложненного течения беременности и родов [1].
Хронический эндометрит — клинико-морфологический синдром, характеризующийся комплексом морфофункциональных изменений эндометрия воспалительного генеза, приводящих к нарушению нормальной циклической трансформации и рецептивности ткани.
Среди пациенток с ХЭ 97,6% составляют женщины репродуктивного периода, что подчеркивает особую значимость данной патологии с точки зрения влияния на репродуктивную функцию [2].
У женщин с бесплодием ХЭ встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. У больных с неудачными попытками ЭКО и переноса эмбрионов (ПЭ) частота ХЭ возрастает до 60% и более. Наибольшие показатели распространенности ХЭ отмечены у больных с привычным невынашиванием беременности и составляют более 70% [5, 6].
По данным различных авторов, факторами риска развития ХЭ являются все инвазивные вмешательства в полости матки (гистероскопия, выскабливание полости матки, биопсия эндометрия, гистеросальпингография, манипуляции в программах вспомогательных репродуктивных технологий и др.), инфекционно-воспалительные осложнения после беременностей и родов, использование внутриматочных спиралей (ВМС), инфекции влагалища и шейки матки, бактериальный вагиноз, деформации полости матки с нарушением циклического отторжения эндометрия, лучевая терапия в области органов малого таза [1, 7, 8].
В современных условиях эндометрит характеризуется рядом особенностей: изменением этиологической структуры с увеличением значимости вирусной и условно-патогенной флоры, ростом резистентности флоры к фармакотерапии, трансформацией клинической симптоматики в сторону стертых форм и атипичного течения, длительными сроками терапии и высокой ее стоимостью [9]. Современная общепризнанная классификация ХЭ, выстроенная по этиологическому фактору, претерпела в последнее десятилетие значительные изменения в сторону расширения перечня специфических форм заболевания. Существуют вирусные (вирус папилломы человека — ВПЧ, цитомегаловирус, вирус иммунодефицита человека), хламидийные, микоплазменные, грибковые, протозойные и паразитарные специфические эндометриты, отдельно выделен саркоидоз эндометрия [1, 10]. Для идентификации инфекционного агента обязательно проводить тщательное микробиологическое исследование соскоба эндометрия с определением чувствительности флоры к антибактериальным препаратам. В одной трети случаев при гистологически верифицированном ХЭ выявляются стерильные посевы эндометрия, что может свидетельствовать о важной роли условно-патогенной флоры в развитии воспалительного процесса или недостаточной детекции возбудителя, особенно в случае вирусной инвазии [11]. Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, препятствуя нормальной имплантации и плацентации, формируя патологический ответ на беременность, а также вызывает нарушение пролиферации и нормальной циклической трансформации ткани [12]. По различным данным, у больных с бесплодием частота ХЭ составляет в среднем 10% (от 7,8 до 15,4%). Среди женщин с верифицированным ХЭ в 60% случаев диагностируется бесплодие (в 22,1% — первичное бесплодие, в 36,5% — вторичное бесплодие), неудачные попытки ЭКО и переноса эмбрионов в анамнезе отмечены у 40% женщин [4, 12]. Клиническая картина ХЭ в значительной степени отражает глубину структурных и функциональных изменений в ткани эндометрия. Неполноценная циклическая трансформация эндометрия на фоне воспалительного процесса, нарушение процессов десквамации и регенерации функционального слоя эндометрия приводят к появлению основного симптома заболевания — маточных кровотечений (перименструальные, межменструальные). Достаточно постоянными являются жалобы на тянущие боли внизу живота, дисменорею и диспареунию, нередко отмечаются серозные и серозно-гноевидные бели. Среди клинических симптомов особое место занимает бесплодие (преимущественно вторичное), неудачные попытки ЭКО и НБ. Более половины пациенток в анамнезе имеют инвазивные вмешательства в полости матки и на органах малого таза. Часто хронический эндометрит сочетается с хроническим сальпингоофоритом и спаечным процессом в малом тазе. Важно отметить, что использование минимальных критериев для диагностики воспалительных заболеваний органов малого таза (ВЗОМТ), предложенных CDC (Centers for Disease Control and Prevention, США, 1993), информативно в случае с хроническим эндометритом только в 33% [7]. В целом у 35–40% пациенток какие-либо клинические симптомы заболевания отсутствуют [8, 13]. Диагностика ХЭ основана на анализе клинических симптомов, данных анамнеза, эхографической картины [2, 11]. Обязательным этапом диагностики заболевания является морфологическое исследование эндометрия [14].
Эхографические критерии ХЭ впервые разработаны профессором В. Н. Демидовым с соавт. (1993 г.). Исследование проводят дважды на 5–7 и 17–21 день менструального цикла. Часто при ХЭ полость матки после менструации расширена до 0,4–0,7 см, в ряде случаев имеется асимметричность расширения полости матки и неровность внутренней поверхности эндометрия. Изменение структуры эндометрия также выражается в возникновении в зоне срединного М-эха участков повышенной эхогенности различной величины и формы. Внутри участков выявляются отдельные зоны неправильной формы и сниженной эхогенности. Другой важный признак — наличие пузырьков газа, иногда с характерным акустическим эффектом «хвоста кометы». В базальном слое эндометрия часто визуализируются четкие гиперэхогенные образования диаметром до 0,1–0,2 см, представляющие собой очаги фиброза, склероза или кальциноза. Довольно редким, но важным признаком эндометрита является асимметрия толщины передней и задней стенок эндометрия. О наличии патологии свидетельствует также истончение М-эха во второй трети менструального цикла менее 0,6 см. У каждой пятой больной отмечается наличие нескольких из перечисленных признаков [15].
В настоящее время для диагностики внутриматочной патологии широко используется гистероскопия [16]. Наиболее частыми признаками воспалительного процесса в эндометрии являются: неравномерная толщина эндометрия — 30% случаев, полиповидные нарастания — 32,2%, неравномерная окраска и гиперемия слизистой оболочки — 23% и 11,8%, точечные кровоизлияния — 9%, очаговая гипертрофия слизистой оболочки — 7%. Трудности гистероскопической интерпретации данных связаны с отсутствием типичных макроскопических признаков хронического эндометрита, с очаговым характером воспалительного процесса и стертыми формами заболевания [17]. По разным данным гистероскопия позволяет по макроскопическим признакам точно идентифицировать хронический эндометрит только в 16–35% случаев [7, 16]. При подозрении на ХЭ гистероскопия важна для исключения всего спектра внутриматочной патологии, но для верификации диагноза во всех случаях необходимо проведение морфологического исследования эндометрия [8].
«Золотым стандартом» диагностики ХЭ является морфологическое исследование эндометрия, которое должно быть обязательным звеном алгоритма обследования [7, 13]. Диагностическое выскабливание слизистой оболочки матки производят в среднюю и позднюю фазу пролиферации, на 7–10 день менструального цикла. В последние годы общепринятыми критериями морфологической диагностики ХЭ являются [1]:
Несмотря на значительное развитие фармакологической основы терапии, лечение ХЭ в настоящее время представляет значительные трудности для клиницистов [4].
Комплексная терапия ХЭ должна быть этиологически и патогенетически обоснованной, поэтапной и базироваться на результатах максимально тщательного обследования [5]. Алгоритм лечения должен учитывать все звенья патогенеза заболевания.
Необходимость использования этиотропных препаратов для элиминирования повреждающего агента или снижение вирусной активности не вызывает сомнения. Принимая во внимание, что почти в 70% случаев ВЗОМТ применение рутинных методов диагностики не позволяет выявить этиологический фактор, эмпирическая антимикробная терапия при ХЭ всегда оправдана и приводит к достоверному уменьшению частоты клинических симптомов. При этом она должна обеспечивать элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы, стрептококки и вирусы. Оправдано назначение нескольких курсов этиотропной терапии со сменой групп препаратов [5, 18].
Выбор группы лекарственных препаратов зависит от данных микробиологического исследования содержимого влагалища и полости матки, анамнестических указаний на использование антибактериальных препаратов в течение последнего года, от выраженности клинической симптоматики и обширности воспалительного процесса [16].
Основу базовой антибактериальной терапии должны составлять комбинации фторхинолонов и нитроимидазолов; цефалоспоринов III поколения, макролидов и нитроимидазолов, а также сочетание защищенных пенициллинов (амоксициллин/клавулановая кислота) с макролидами. При наличии вирусной инфекции (чаще вируса простого герпеса) в зависимости от клинической картины применяют современные аналоги нуклеозидов (Ацикловир или Валтрекс), как правило, в длительном режиме — в течение не менее 3–4 месяцев [3, 19].
Одновременно на основании данных иммунного и интерферонового статуса проводится коррекция иммунных нарушений [20].
Второй этап лечения ХЭ направлен на восстановление морфофункционального потенциала ткани и устранение последствий вторичных повреждений: коррекция метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. Данный этап лечения крайне важен, должен быть продуманным и достаточно продолжительным [11].
Метаболическая терапия при ХЭ направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в том числе угнетение анаэробного гликолиза [4, 12]. С этой целью используются комплексные метаболические препараты, длительность приема которых должна составлять не менее 3–4 недель. Представителем данной группы препаратов является Актовегин, полученный посредством диализа и ультрафильтрации, в состав которого входят низкомолекулярные пептиды и дериваты нуклеиновых кислот. Актовегин активирует клеточный метаболизм путем увеличения транспорта, накопления и усиления внутриклеточной утилизации глюкозы и кислорода, что приводит к ускорению метаболизма аденозинтрифосфата (АТФ) и повышению энергетических ресурсов клетки. Актовегин удобен для приема. Его выпускают и в таблетках, и в растворе для инъекций. Поэтому женщины, которые по каким-либо причинам не могут лечь в стационар или систематически приезжать на прием, принимают его дома по схеме, расписанной врачом. Актовегин таблетки принимают, не разжевывая, перед едой, запивая небольшим количеством жидкости, по 1 таблетке 2 раза в день в течение 30 дней [21]. При введении в форме инфузии к 200–300 мл основного раствора (0,9% раствор хлорида натрия или 5% раствор декстрозы) добавляют 10–20 мл Актовегина, раствор используют по следующей схеме: внутривенно через день в течение не менее двух недель. Скорость введения: около 2 мл/мин [22].
Положительное влияние Актовегина на кровообращение связано с улучшением доставки и утилизации кислорода, увеличением перфузии глюкозы и восстановлением аэробного метаболизма как в периферических тканях, так и в нейрональных структурах. Путем активации фермента супероксиддисмутазы препарат оказывает выраженное антиоксидантное и противоишемическое действие. Актовегин хорошо сочетается с другими лекарственными средствами, что очень удобно для комплексного лечения хронического эндометрита.
Традиционно в комплексной терапии ХЭ применяются физические факторы. Наиболее часто в комплексной терапии ХЭ применяют электроимпульсную терапию, интерференционные токи, переменное магнитное поле низкой частоты, ток надтональной частоты. Задачи физиотерапии при ХЭ заключаются в улучшении гемодинамики органов малого таза, стимуляции функции рецепторов, ускорении процессов регенерации эндометрия, повышении иммунологических свойств [4].
Дискуссионными остаются вопросы о целесообразности использования в комплексном лечении ХЭ циклической гормональной терапии. В настоящее время считается, что при хроническом эндометрите оправдано только дифференцированное назначение гормонотерапии при наличии гипофункции яичников или ановуляции. Потенциал к патологической регенерации ткани, который таит в себе хроническое воспаление, при назначении циклической заместительной гормональной терапии может быть усилен и реализован [3, 8].
Контроль эффективности терапевтических мероприятий должен проводиться не ранее чем через 2 месяца после окончания лечения с учетом эффекта последействия физиотерапии [2, 5]. При этом оценивается динамика клинических симптомов, проводится ультразвуковое исследование матки (допплерометрия сосудов матки) и аспирационная биопсия эндометрия (на 7–10 день менструального цикла) с последующим морфологическим исследованием эндометрия [1, 11].
Литература
А. З. Хашукоева, доктор медицинских наук, профессор
Н. Д. Водяник, кандидат медицинских наук, доцент
С. А. Хлынова, кандидат медицинских наук
Е. А. Цомаева
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва