что такое несолеобразующие оксиды
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
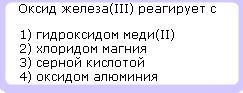
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
1) Степень окисления неметалла +1 или +2
Вывод: оксид несолеобразующий
Исключение: Cl2O не относится к несолеобразующим оксидам
1) Степень окисления металла равна +1, +2
Вывод: оксид металла основный
Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!!
2) Степень окисления больше либо равна +3
Вывод: оксид кислотный
Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1
2) Степень окисления металла +3, +4,
Вывод: оксид амфотерный.
Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов
3) Степень окисления металла +5,+6,+7
Вывод: оксид кислотный.
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
Оксиды, образованные металлами
Оксиды, образованные неметаллами
Основные
Кислотные
Несолеобразующие
— Na2O, CaO;
оксиды d-элементов в низших с.о. — CrO, FeO
d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2
1) оксиды неметаллов в высших и средних степенях окисления
CO2, N2O3, N2O5, SO3, SO2
2) оксиды d-элементов в высшей с.о.:
оксиды неметаллов в промежуточных степенях окисления:
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
1. + O2
если элемент, образующий оксид в средней с.о.:
2. + H2
восстановление до несолеобразующего оксида или простого вещества:
3. + вещества. образованные металлами:
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + H2O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
Что такое несолеобразующие оксиды
          Все неорганические вещества по составу делятся на простые и сложные. Простые вещества по свойствам делятся на металлы и неметаллы.
          Простые вещества металлы состоят из атомов химических элементов металлов, например натрий Na, калий К, железо Fe, магний Mg, серебро Ag и др. Простые вещества неметаллы состоят из атомов химических элементов неметаллов, например хлор Cl2, сера S8, фосфор Р4, кислород О2, озон О3, азот N2 и др. Простые вещества металлы и неметаллы имеют разные (часто противоположные) физические и химические свойства.
          Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твёрдом состоянии.
         Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
          По химическим свойствам сложные вещества делятся на классы: оксиды, основания, кислоты, соли.
          Оксидами называются вещества, состоящие из двух элементов, один из которых кислород в степени окисления – 2. В оксидах атомы кислорода соединяются только с атомами других элементов и не связаны между собой.
         По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Оксиды, которые не образуют солей, называются несолеобразующими : NO – оксид азота (II), N2O – оксид азота (I), SiO – оксид кремния (II) – это несолеобразующие оксиды. Несолеобразующих оксидов мало.
         Оксиды, которые при химических реакциях образуют соли, называются солеобразующими.
CO2 (оксид углерода (IV)) + Са(ОН)2 (гидроксид кальция) =
= СaСО3↓ (карбонат кальция) + H2O
MgO (оксид магния) + 2HCl (соляная кислота) =
= MgCl2 (хлорид магния) + Н2O
         СО2 и MgO – солеобразующие оксиды.
         Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
          Основными называются оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, основные оксиды образуют основания. Например, оксид кальция СаО реагирует с водой, образуя гидроксид кальция Са(ОН)2.
          Кислотными называются оксиды, взаимодействующие с основаниями (или с основными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, кислотные оксиды образуют кислоты. Так, триоксид серы SO3 взаимодействует с водой, образуя серную кислоту H2SO4.
         Один из способов получения кислотных оксидов – отнятие воды от соответствующих кислот. Поэтому кислотные оксиды иногда называют ангидридами кислот.
          Амфотерными называются оксиды, образующие соли при взаимодействии как с кислотами, так и с основаниями. К таким оксидам относятся, например, Аl2О3, ZnO, PbO2, Cr2O3.
          К кислотам относятся вещества, способные отдавать ион водорода, т. е. быть донорами протонов.
          Основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. основные гидроксиды.
КОН + НСl = КСl + Н2О