что такое мультифокальная сосудистая дегенерация мозга
Мультисистемная атрофия
Мультисистемная атрофия — прогрессирующая дегенеративная патология головного мозга с преимущественным поражением глиальных клеток базальных ганглиев, мозжечка, вегетативных центров. Клинически проявляется сочетанием паркинсонизма с мозжечковой, вегетативной и пирамидной недостаточностью. Диагностируется преимущественно по клиническим данным, дополнительно проводится церебральная МРТ, ортостатическая проба, ЭМГ сфинктеров. Терапия мультисистемной атрофии симптоматическая (сосудистая, нейрометаболическая), большинство случаев резистентны к лечению препаратами леводопы.
Общие сведения
Термин «мультисистемная атрофия» (множественная системная атрофия, МСА) был введён в 1969 году. В 1989 году были обнаружены патогномоничные для МСА цитоплазматические включения в олигодендроглиоцитах. Понятие мультисистемная атрофия объединяет три патоморфологически сходные нозологии, клинически представляющие собой сочетание паркинсонического синдрома, вегетативной дисфункции, мозжечковой атаксии и пирамидной недостаточности. Ранее специалисты в области неврологии относили указанные заболевания в группу «паркинсонизм-плюс». На МСА приходится 10-12% случаев паркинсонизма. Встречаемость патологии в 20 раз меньше чем болезни Паркинсона. Заболеваемость составляет 3 случая на 100 тыс. населения. Дебют клинических проявлений приходится на возраст 50-60 лет. Характерно быстрое прогрессирование симптоматики.
Причины мультисистемной атрофии
Наследственный характер МСА не прослеживается, текущие наблюдения не обнаруживают семейных случаев заболевания. Однако многие исследователи предполагают генетическую детерминированность патологии как предрасположенность к развитию МСА при воздействии неблагоприятных факторов. Отдельные учёные связывают повышенный риск возникновения МСА с полиморфизмом в гене альфа-синуклеина. Этиофакторы, провоцирующие заболевание, точно не определены. Одно из проведённых исследований выявило указания на контакт с токсическими веществами (пестицидами, органическими растворителями) в анамнезе 11% пациентов с МСА.
Патогенез
Механизм развития неизвестен. Особенностью дегенеративных изменений является преимущественное поражение глиальных клеток с накоплением альфа-синуклеина, тау-протеина и ряда других нейронных белков. Патологические включения обнаруживаются в олигодендроглиоцитах надсегментарных двигательных структур (пирамидная, экстрапирамидная система, моторная область коры, мозжечок) и вегетативных центров ЦНС. Наряду с поражением чёрной субстанции происходит дегенерация дофаминовых рецепторов скорлупы, обуславливающее развитие устойчивого к дофаминергической терапии «постсинаптического» паркинсонизма. Морфологическая картина характеризуется асимметричными атрофическими изменениями белого вещества, преобладанием поражения олигодендроглиоцитов, менее выраженным повреждением нейронов. Мультисистемная дегенерация затрагивает строго определённые структуры головного мозга. Каждая клиническая форма имеет свою типичную локализацию дегенеративного процесса.
Классификация
В соответствии с современными взглядами на проблематику мультисистемная атрофия включает три нозологические формы. В основу систематизации положены клинические особенности заболевания. В зависимости от превалирующего синдрома выделяют следующие варианты:
Симптомы мультисистемной атрофии
Манифестация приходится на возрастной период 45-60 лет. У 60% пациентов МСА стартует нарушениями двигательной сферы, у 40% вегетативной симптоматикой. В начальном периоде в 60% случаев наблюдаются симптомы паркинсонизма: брадикинезия, замедленность движений, шаркающая походка, гипомимия, монотонность голоса. Их отличительной особенностью является изначальная симметричность проявлений. У 30% больных отмечаются мозжечковые расстройства: постуральные нарушения, дисметрия, адиадохокинез, интенционный тремор. В 10% случаев мозжечковая атаксия сочетается с паркинсонизмом.
Развёрнутая мультисистемная атрофия протекает с паркинсоническим синдромом у 90% больных. Мозжечковые нарушения слабо проявлены из-за выраженной ригидности. Об их наличии свидетельствует широкая постановка стоп при ходьбе, скандированный тип речи, усиление тремора в руке при приближении к цели (например, при попытке взять чашку). Смешанное мозжечково-паркинсоническое нарушение речи при МСА, получившее название дизартрофония, представляет собой мозжечковую дизартрию, сочетающуюся с монотонностью и приглушенностью речи. Пирамидная симптоматика характеризуется повышением сухожильных рефлексов и появлением стопных знаков, классические спастические парезы отсутствуют.
Тремор носит постурально-кинетический характер, возникает в результате сочетания дрожательного гиперкинеза и небольших миоклонических подёргиваний. Возможны дистонические проявления (спастическая кривошея, лицевой гемиспазм, фокальные дистонии конечностей), в отдельных случаях наблюдающиеся уже в дебюте заболевания. Вегетативная недостаточность проявляется ангидрозом, расстройством тазовых функций, ортостатическим коллапсом с обмороками, иногда — триадой Горнера, синдромом Рейно. Выраженные нарушения когнитивной сферы нехарактерны.
Осложнения
Тазовые нарушения осложняются присоединением вторичной инфекции с возникновением восходящего воспаления органов мочевыводящей системы: уретрита, цистита, пиелонефрита. При отсутствии своевременного лечения возможно проникновение инфекционных агентов в кровь с развитием сепсиса. Вовлечение в патологический процесс черепно-мозговых нервов приводит к прогрессирующему бульбарному параличу с характерной для него дисфагией. Последняя может осложниться попаданием пищи в дыхательные пути с последующей аспирационной пневмонией. Бульбарный паралич голосовых связок опасен появлением асфиксии, которая может стать причиной внезапной смерти.
Диагностика
Мультисистемная атрофия диагностируется на основании клинических данных, сбор которых зачастую требует наблюдения пациента в динамике. Диагноз вероятной МСА устанавливается при сочетании вегетативной недостаточности с хотя бы одним из следующих синдромов: резистентный к препаратам леводопы паркинсонизм, мозжечковая дисфункция. Против диагноза МСА выступает дебют заболевания до 30-летнего возраста, семейный анамнез, расстройство когнитивной сферы (деменция), наличие другого заболевания, являющегося причиной аналогичной симптоматики. Достоверная диагностика возможна только в результате патоморфологической экспертизы. С целью подтверждения диагноза необходимо проведение следующих исследований:
Дифференцируется мультисистемная атрофия с болезнью Паркинсона, сосудистым паркинсонизмом, спиноцеребеллярными атаксиями. Главным отличием МСА от классической болезни Паркинсона является наличие дополнительных симптомов, выходящих за рамки расстройств экстрапирамидной системы, слабая эффективность дофаминергической терапии. Сосудистый паркинсонизм отличается сопутствующими когнитивными нарушениями. Спиноцеребеллярные атаксии имеют наследственный характер, в сложных диагностических случаях исключаются при помощи ДНК-диагностики.
Лечение мультисистемной атрофии
Поскольку этиопатогенез остаётся неясным, лечение осуществляется в рамках симптоматической терапии. На начальной стадии заболевания у трети пациентов эффективны фармпрепараты леводопы, однако они усугубляют дистоническую симптоматику и течение ортостатической гипотонии. При отсутствии терапевтического эффекта, выраженных побочных явлениях леводопу отменяют. Применяют средства, улучшающие метаболизм церебральных тканей: вазоактивные, нейрометаболические препараты. Лечение ортостатической дисфункции осуществляется путём наложения компрессионных бинтов на нижние конечности, повышения содержания соли в рационе, приподнимания головного конца кровати.
Прогноз и профилактика
На сегодняшний день мультифокальная атрофия относится к неизлечимым заболеваниям. Симптоматическая терапия позволяет несколько облегчить состояние больного, но не может остановить прогрессирование дегенеративных процессов. Длительность жизни пациентов не превышает 7 лет. Летальный исход обусловлен осложнениями бульбарного синдрома, интеркуррентными инфекциями, сердечно-сосудистой недостаточностью. Профилактические мероприятия не разработаны, поскольку отсутствуют точные данные об этиологии поражения.
Энцефалопатия
Энцефалопатия – это собирательное название, включающее однотипные поражения головного мозга, возникающие под действием различных причин. Патологический процесс сопровождается гибелью отдельных нейронов и разрушением связей между ними. При отсутствии медицинской помощи приводит к прогрессирующему ухудшению состояния вплоть до полной деградации личности.
Общие сведения
Энцефалопатия возникает на фоне нарушения метаболизма в клетках головного мозга. Вне зависимости от причины, патология протекает по единому сценарию. Сначала происходит снижение активности нейронов, затем – постепенная их гибель. Очаги дистрофии располагаются по всему головному мозгу, что вызывает разнообразную симптоматику.
Повреждения носят необратимый характер, но при своевременном обращении к специалисту и качественном лечении состояние пациента может улучшиться. Оставшиеся неповрежденными нейроны частично берут на себя функцию погибших клеток, и работа головного мозга значительно улучшается. Если заболевание было застигнуто на ранней стадии, пациент сохраняет полную ясность ума.
Причины
Поражение нервных клеток может возникнуть на фоне воздействия разнообразных патологических факторов.
Врачи выделяют врожденную и приобретенную энцефалопатию. Первая возникает на фоне неправильного течения беременности или родов и, зачастую, развивается еще во время пребывания плода в утробе матери. Ее признаки обнаруживаются сразу после родов или появляются в первые недели жизни. Диагностикой и лечением этого состояния занимаются неонатологи и педиатры.
Приобретенная энцефалопатия встречается уже во взрослом возрасте. Она подразделяется на несколько видов в зависимости от причины гибели нейронов:
В зависимости от скорости развития процесса выделяют энцефалопатию острую и хроническую. Первая может развиться в течение нескольких дней или часов, чаще возникает на фоне сильной интоксикации, травмы, инфекционного процесса. Хронический процесс может протекать годами и десятилетиями.
Степени
Границы между степенями тяжести энцефалопатии условны, но для удобства врачи пользуются следующей классификацией:
Симптомы
Признаки энцефалоптии зависят от локализации очага разрушения, а также степени развития заболевания. Наиболее часто пациенты и их родственники сталкиваются со следующими симптомами:
У одних пациентов преобладают расстройства поведения, другие перестают нормально владеть своим телом; у третьих страдают, в основном, органы чувств. В тяжелых случаях человек требует постоянного ухода и наблюдения окружающих.
Осложнения
Осложнения энцефалопатии связаны с сильным и необратимым поражением головного мозга и представляют собой предельную степень наблюдаемых симптомов:
Диагностика
Диагностикой и лечением энцефалопатии занимается врач невролог. Обследование пациента включает в себя:
При необходимости могут быть назначены другие анализы и обследования, а также консультации специалистов для точного определения причины энцефалопатии.
Лечение
Чем раньше будет начато лечение энцефалопатии, тем больше шансов остановить прогрессирование патологии и восстановить полноценную работу головного мозга.
В первую очередь, необходимо устранить причину поражения нейронов:
Лечение непосредственно энцефалопатии требует назначения препаратов, улучшающих кровоток в сосудах головного мозга и обмен веществ внутри клетки. В зависимости от причины и степени поражения, врачи могут назначить:
При энцефалопатии курсы лечения проводятся регулярно, минимум 2 раза в год. Это позволяет держать заболевание под контролем. Подбор конкретных препаратов и определение дозировки осуществляется только врачом. Единой схемы лечения для всех больных не существует.
Для усиления действия лекарственных препаратов используются немедикаментозные методы лечения:
В отдельных случаях (при сосудистой природе энцефалопатии) приходится прибегать к хирургическому лечению:
Профилактика
Энцефалопатия – сложное заболевание. Не существует четкой методики, позволяющей предупредить ее появление и устранить все факторы риска. Врачи рекомендуют придерживаться следующих правил:
Лечение в клинике «Энергия здоровья»
Врачи клиники «Энергия здоровья» всегда готовы принять пациента любого возраста. Мы проведем тщательное обследование, выявим возможные причины энцефалопатии и примем все меры по ее устранению:
Наши неврологи будут контролировать состояние пациента и корректировать лечение при необходимости. Лечение энцефалопатии – это длительный и сложный процесс, но мы готовы за него взяться.
Преимущества клиники
Если Вам требуется полноценное обследование и качественное лечение, добро пожаловать в клинику «Энергия здоровья». Здесь Вас ждут:
Если у Вас или Ваших родственников появились признаки энцефалопатии, не затягивайте с обращением к врачу. Чем будет начато лечение, тем лучше результат. Запишитесь в клинику «Энергия здоровья» и позвольте нашим врачам подобрать оптимальную терапию.
Мультисистемная атрофия
1. Общие сведения
Одной из наиболее острых, актуальных, – и по сей день далеких от решения, – проблем в неврологии остаются нейродегенеративные заболевания. Этим термином объединяются патологические процессы, с развитием которых «рабочая» ткань центральной и/или периферической нервной системы вырождается, утрачивает первоначальную структуру, уменьшается в объеме и постепенно отмирает (соотв., дегенерация, атрофия, некроз). В норме такая ткань образуется нейронами (нервными клетками), их отростками (аксонами и дендритами) и сложнейшей перекрестной сетью точек электрохимического контакта между ними (синапсов). В организме человека функционируют несколько регуляторных систем; упрощенно можно сказать, что гормоны управляют работой внутренних органов, ферменты отвечают за переработку питательных веществ и пр., – но высший уровень контроля всех происходящих в организме процессов принадлежит именно нейронной ткани. Наиболее очевидным это становится на примере явления, которое мы привыкли называть венцом эволюции – человеческой психики, включая такие ее феномены, как сознание и абстрактное мышление. Однако «сфера ответственности» биологических нейронных сетей отнюдь не ограничивается высшими функциями коры головного мозга. И активность желез внутренней секреции, и координация моторных (двигательных) актов, и весь безбрежный спектр доступных человеку ощущений, и огромное число безусловных, не зависящих от сознания рефлексов, – обеспечивающих оптимальное автоматическое реагирование и, соответственно, выживание в окружающем мире, – управляются и контролируются головным и спинным мозгом (ЦНС) и относительно автономными периферическими нейронными узлами. Поэтому дегенерация и атрофия нейронных тканей на любом участке – это процесс, для организма всегда катастрофический.
Нейродегенеративные заболевания характеризуются сравнительно медленными темпами развития (5-20 лет) и к терминальной стадии, как правило, сопровождаются тотальной деменцией – утратой интеллекта, памяти, личности, базовых навыков, контакта с окружающими. Непреодолимой, на сегодняшний день, сложностью таких болезней является то, что некоторые из них носят наследственный, хромосомный характер; другие являются полиэтиологическими процессами, т.е. в их «запуске» и развитии участвуют, по всей вероятности, многие факторы одновременно, причем не все они на сегодняшний день выявлены и изучены. Наиболее известными и распространенными нейродегенеративными процессами можно считать болезни Альцгеймера, Пика, Паркинсона, кортикобазальную дегенерацию и пр.
К этой же группе заболеваний относится редкая патология, отличающаяся дегенерацией мозговых нейронов в тех зонах и в таких масштабах, при которых одновременно поражаются сразу несколько функциональных систем организма, – что и акцентируется диагностическим термином «мультисистемная атрофия» (уст. «синдром Шая-Дрейджера»). Заболевание распространено в мире на уровне около 5 чел на 100 000 населения. В отличие от перечисленных выше сходных болезней, которые традиционно (и не вполне верно) воспринимаются как сугубо «старческие», мультисистемная атрофия диагностируется у лиц старше 50 лет лишь чуть более чем в половине случаев; другая половина приходится на прочие возрастные категории.
2. Причины
Нам выпало жить в эпоху, когда стремительное развитие медицинской науки неуклонно сокращает число как неизлечимых болезней, так и болезней непонятных, этиологически неясных. Мультисистемная атрофия относится и к тем, и к другим.
Несмотря на исследовательские усилия, – которые существенно затрудняются редкостью заболевания и многообразием возможных вариантов клинической картины, – этиопатогенетические факторы и механизмы мультисистемной нейронной атрофии пока не известны. Кроме того, не удается выявить статистическую значимость каких бы то ни было условий или индивидуальных особенностей, которые можно было бы назвать факторами риска и, соответственно, профилактическими мишенями. Результаты попыток дешифровать мультисистемную атрофию на хромосомном уровне до последнего времени носят гипотетический, предположительный характер. Достоверно подтверждено преобладание мужчин среди заболевших (по разным оценкам, в 1,5-2 раза), но и эта тенденция пока не получила удовлетворительного объяснения.
3. Симптоматика, диагностика
Осевыми, главными в клинике мультисистемной атрофии принято считать следующие группы симптомов. Постепенно утрачивается способность к координированным сложным движениям и, как при болезни Паркинсона, появляются непроизвольные движения (тремор) на фоне повышенного мышечного тонуса. Нарушается походка, моторика становится все более беспорядочной (атаксия). Кроме того, страдают т.н. вегетативные функции, контролируемые периферической нервной системой: возникают и усугубляются те или иные проблемы с мочеиспусканием и дефекацией, водным и температурным балансом кожи, дыханием (особенно во время сна), артериальным давлением (что при принятии вертикального положения может проявляться головокружениями и кратковременными потерями сознания с падением); нарушаются и деградируют речевые и сексуальные функции, затрудняется фиксация взора и снижается острота зрения; уменьшается продуктивность слезных, слюнных и потовых желез. Прогрессирует деменция. В большинстве случаев через несколько лет пациента приходится инвалидизировать. Процесс результирует летальным исходом; в терминальной стадии больные, как правило, пребывают в сугубо вегетативном статусе.
Учитывая полиморфизм возможной симптоматики, мультисистемную атрофию необходимо дифференцировать, прежде всего, с «чистой» болезнью Паркинсона и другими видами нейродегенерации. В дополнение к стандартному неврологическому осмотру и изучению анамнеза, в диагностических целях (поиск и локализация участков дегенерации) могут назначаться томографические методы визуализации (КТ, МРТ). Более специфические, «прицельные» в отношении мультисистемной атрофии диагностические методики, будь то аппаратные или лабораторно-аналитические методы, на сегодняшний день не разработаны.
4. Лечение
Поскольку не установлены причины заболевания и факторы, влияющие на его динамику, этиопатогенетическая терапия мультисистемной атрофии невозможна. Проводится симптоматическое лечение тех нарушений, которые доминируют на конкретной стадии и поддаются коррекции (например, назначаются препараты для стабилизации давления, улучшения нейротрофики и пр.). Больные на средних и поздних этапах мультисистемной атрофии нуждаются в уходе и тотальной опеке.
Что такое мультифокальная сосудистая дегенерация мозга
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) до недавнего времени считалась редким быстро прогрессирующим демиелинизирующим заболеванием ЦНС, вызванным активацией кольцевого вируса рода Polyomavirus семейства Polyomaviridae (полиомавирусов) ― вируса Джона Каннингема (John Cunninghamvirus ― JC-вируса), названного в честь пациента, у которого в 1971 г. он впервые был обнаружен и носителями которого являются около 80% населения мира [1―2]. Современные данные свидетельствуют, что ПМЛ развивается у лиц со сниженным иммунитетом (у иммунокомпрометированных лиц): при неопластических заболеваниях (лейкемия, болезнь Ходжкина, лимфосаркома, миелопролиферативные заболевания), туберкулезе, саркоидозе, при иммунодефиците, СПИДе, лекарственной иммуносупрессии цитостатиками при пересадке органов или новообразованиях различной локализации [3]. ПМЛ часто встречается при терапии демиелинизирующих заболеваний моно-клональными антителами, возможно также развитие ПМЛ в качестве опасного осложнения в рамках системного воспалительного ревматического заболевания на фоне иммуносупрессивной терапии [4]. В то же время в ряде случаев развитие ПМЛ происходит и при отсутствии тяжелого иммунодефицита. ПМЛ по сути является оппортунистической вирусной инфекцией. Для неврологов актуальность изучения ПМЛ связана с активным использованием иммуносупрессивной терапии и широким распространением ВИЧ-инфекции. После введения в практику высокоактивной антиретровирусной терапии (ВААРТ) частота ПМЛ увеличилась и составила 1,3 на 1000 ВИЧ-инфицированных в год [5].
В клинической практике ранняя диагностика ПМЛ сложна из-за отсутствия выраженной симптоматики, так как инфицирование JC-вирусом происходит в детском возрасте и вирус находится в организме пожизненно [6]. Точное место его персистенции до конца не выяснено ― предположительно, это почки и костный мозг. При ослаблении иммунитета вирус транспортируется лейкоцитами в ЦНС, где начинает свою репликацию в белом веществе мозга, а точнее, в олигодендроцитах. Разрушение миелиновых оболочек макроскопически проявляется мультифокальной демиелинизацией. Чаще поражается белое вещество полушарий головного мозга, но возможно поражение мозжечка и серого вещества.
Клинические проявления ПМЛ
Клинические проявления ПМЛ не имеют специфической картины. Начало появления неврологической и психопатологической симптоматики подострое (несколько дней) или постепенное (несколько недель). Первым развивается быстро прогрессирующий психотический синдром. Позже присоединяются моно- или гемипарезы, нарушение речи и выпадение полей зрения (гемианопсия). Значительно реже встречаются головная боль, головокружение, атаксия и эпилептические приступы. Характерно отсутствие общеинфекционных и менингеальных симптомов. На ранних этапах заболевания возникают прогрессирующие когнитивные нарушения, но в отличие от деменции при ВИЧ-инфекции они сопровождаются очаговой неврологической симптоматикой [7]. У пациентов иногда встречается атипичный вариант заболевания (спинальный), который протекает без нарушения психики [8]. Течение вариабельно, летальный исход наступает в течение 6—12 мес [9]. В терминальной стадии заболевания развиваются тяжелая деменция, кома и гибель больного. Наибольшие диагностические трудности возникают при СПИДе, когда клиника и признаки картины МРТ сходны при ПМЛ и ВИЧ-ассоциированной энцефалопатии [10]. В данных случаях только выявление JC-вируса в цереброспинальной жидкости (ЦСЖ) и биоптате головного мозга позволяет установить диагноз.
Диагностика ПМЛ
Постановка диагноза ПМЛ базируется на критериях, рекомендованных Американской академией неврологии в 2013 г. [11] (табл. 1). 
Иногда для точного подтверждения ПМЛ проводится биопсия ткани мозга с выявлением классической гистопатологической триады: увеличение ядер олигодендроцитов, изменение размеров и формы астроцитов, которые становятся крупными, причудливой формы с гиперхроматическими ядрами.
Таким образом, алгоритм действий врача при подозрении на ПМЛ состоит из нескольких этапов (рис. 1) 
Дифференциальный диагноз ПМЛ
Дифференциальный диагноз ПМЛ в первую очередь необходимо проводить с инфекционными энцефалопатиями (Herpes simplex, вирус CMV, Varicella zoster, Cryptocoсcus, Aspergillus), с лимфомой, с подострым склерозирующим панэнцефалитом. В отличие от вышеназванных инфекций, при ПМЛ нет общеинфекционных и менингеальных симптомов.
Лекарственная ПМЛ
В 2015 г. L. Calabrese и соавт. [18] предложили условную градацию рисков, разработанную для лекарственной ПМЛ. В 1-й класс были включены натализумаб и эфализумаб (снят с производства) как препараты, обладающие высоким риском развития ПМЛ (1/10 000—1/100). Ко 2-му классу (низкий риск) отнесены ритуксимаб, белимумаб, азатиоприн, микофенолатамофетил, метотрексат. В 3-й класс (очень низкий риск) вошли ингибиторы фактора некроза опухоли-α (иФНО-α), абатацепт, тоцилизумаб, анакинра, устекинумаб и тофацитиниб. Использование этих препаратов требует особого тщательного наблюдения за пациентами и необходимости информирования их о риске развития ПМЛ.
Терапия ПМЛ
Специфическая терапия ПМЛ до настоящего времени не разработана. Для лечения применяются следующие препараты: противовирусные средства, цитостатики, антагонисты серотониновых рецепторов, ВААРТ-терапия у ВИЧ-инфицированных больных [19]. При развитии этой патологии целесообразно максимально снизить дозу глюкокортикоидов и цитостатических препаратов. Описан положительный эффект от сочетания плазмафереза (5 сеансов через день) с последующим приемом аминохинолинового препарата мефлоцина и миртазапина (антидепрессант, ингибитор обратного захвата серотонина, замедляющий распространение JC-вируса путем блокирования специфических рецепторов) [19]. Очень часто проводится симптоматическая терапия (противоотечная, нейропротективная, антиоксидантная).
Таким образом, ПМЛ — это заболевание, которое может встретиться в практике врача-невролога. Оно может имитировать острое нарушение мозгового кровообращения (ОНМК), хроническую ишемию головного мозга с выраженными когнитивными нарушениями. Клиницисту следует постоянно помнить, что развитие этой патологии возможно у пациентов с демиелинизирующими заболеваниями, ВИЧ, нейроинфекциями.
Приводим данные собственных наблюдений.
Пациент А., 35 лет. Поступил в ГКБ № 15 им. О.М. Филатова по направлению скорой медицинской помощи (СМП) с диагнозом ОНМК. При поступлении предъявлял жалобы на дезориентацию в пространстве, эмоциональную лабильность, снижение памяти на текущие события.
Анамнез жизни: женат, имеет двоих здоровых детей. Курит с 17 лет. Два года назад, после командировки в Таиланд, резко похудел, это связывал с переходом на «здоровый образ жизни»: сбалансированное питание, усиленные тренировки. Стал чаще болеть простудными заболеваниями. К врачам не обращался.
Анамнез заболевания: со слов пациента и его жены, около 6 мес назад перенес правостороннюю бронхопневмонию (диагностирована при проведении КТ легких).
Ухудшение самочувствия, со слов жены больного, началось с 12.01.17, когда возникли головокружение, снижение памяти на текущие события. Со слов супруги пациента, показатели артериального давления (АД) варьировали от 90/60 до 140/90 мм рт.ст. Госпитализирован в отделение реанимации и интенсивной терапии (ОРИТ) для больных ОНМК 19.01.17. После стабилизации состояния 20.01.17 переведен для дальнейшего лечения и обследования в неврологическое отделение.
Состояние при поступлении средней степени тяжести, кожные покровы и видимые слизистые оболочки обычной окраски и влажности. В легких жесткое дыхание, хрипов нет. Частота дыхательных движений (ЧДД) 16 в минуту. Тоны сердца приглушены, ритмичные, частота сердечных сокращений (ЧСС) 76 уд/мин, АД 115/80 мм рт.ст. Живот мягкий, безболезненный при пальпации во всех отделах. Мочеиспускание самостоятельное. Моча светлая, прозрачная.
Неврологический статус: в сознании, контактен, ориентирован. С трудом подбирает слова при ответе на несложные вопросы. Менингеальных знаков нет. Глазные щели S=D. Зрачки S=D. Фотореакции и корнеальные рефлексы сохранены. Движение глазных яблок в полном объеме. Нистагма нет. Лицевая мускулатура симметрична. Глотание не нарушено. Язык по средней линии. Парезов нет. Мышечный тонус D=S, не изменен. Сухожильные рефлексы D=S, низкие. Рефлекс Бабинского с двух сторон. Координаторные пробы выполняет удовлетворительно. Чувствительных нарушений нет, функции тазовых органов контролирует.
Антитела к гепатиту С (аHCV) обнаружены. Иммуноблот (ИБ) + от 26.01.17 № 136240.
На электрокардиограмме (ЭКГ) ритм синусовый правильный, ЧСС 57 уд/мин. Неполная блокада правой ножки пучка Гиса. Ультразвуковое исследование (УЗИ) органов брюшной полости и почек показало признаки спленомегалии, диффузных неспецифических изменений печени. Электроэнцефалограмма (ЭЭГ) без особенностей.
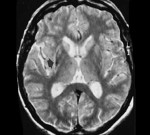
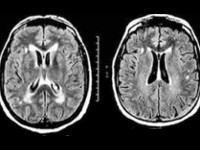
Мультиспиральная КТ (МСКТ) головного мозга от 19.01.17: картина может соответствовать зоне ишемии в правой теменно-затылочной области. МСКТ головного мозга от 20.01.17: КТ-картина (сравнительно с МРТ от 18.01.17, представленной пациентом) с большей вероятностью соответствует лейкоэнцефалопатии после перенесенной нейроинфекции. Менее вероятна ПМЛ. МРТ головного мозга от 21.01.17: картина прогрессирующей мультифокальной лейкоэнцефалопатии головного мозга. Признаки внутричерепной гипертензии. На рис. 2 

На основании клинической картины, положительного ИБ и характерных изменений на МРТ головного мозга пациенту для уточнения диагноза было выполнено ПЦР-исследование ЦСЖ на JC-вирус, которое оказалось положительным.
Больному был выставлен диагноз: очаговое поражение головного мозга (ПМЛ). ИБ (+) от 26.01.17 № 136240.
Было проведено симптоматическое лечение: мексидол (этилметилгидроксипиридина сукцинат) 500 мг внутривенно (в/в); диакарб (ацетазоламид) 500 мг/сут; кортексин (полипептиды коры головного мозга скота) 10 мг внутримышечно (в/м); рекогнан (цитиколин) 1000 мг в/в. На фоне проводимой терапии состояние с положительной динамикой. Стабилизированы показатели А.Д. Жалоб на нарушения памяти нет. Пациенту рекомендовано продолжить лечение в специализированном лечебно-профилактическом учреждении. Описанный клинический случай заслуживает особого внимания в связи с тем, что социально благополучный пациент не знал или сознательно утаил причину своих проблем со здоровьем, попав в клинику, получал лечение от сосудистого заболевания и последствий перенесенной нейроинфекции. К сожалению, иммуноферментный анализ (ИФА; ELISA) — лабораторное исследование, позволяющее определить присутствие в крови ВИЧ-антител часто дает ложноположительные результаты. Для уточнения диагноза проведен иммуноблот на антитела к ВИЧ и HCV. По рекомендации ВОЗ, иммуноблоттинг (вестерн-блот) используется при диагностике ВИЧ-инфекции в качестве дополнительного экспертного метода, который должен подтверждать результаты ИФА. Иммуноблоттинг — дорогостоящая и длительная методика. Результаты этого анализа были получены практически перед выпиской пациента из стационара. В то же время назначение симптоматической терапии позволило стабилизировать состояние пациента, улучшить когнитивные функции. Выбор лекарственных средств основывался на принципах терапии сосудистых поражений головного мозга.
Пациент Р., 52 года. Поступил в ГКБ № 15 им. О.М. Филатова с диагнозом ОНМК.
При поступлении жалобы сформулировать не мог из-за речевых нарушений.
Анамнез жизни: женат. Длительно злоупотребляет алкогольными напитками, курит с 16 лет. Артериальная гипертония последние 10 лет.
Анамнез заболевания: считал себя практически здоровым. В августе 2016 г. отметил головокружение, двоение в глазах. Амбулаторно была выполнена МРТ головного мозга с контрастированием, консультирован в ГКБ № 24, где ему выставлен диагноз: рассеянный склероз под вопросом, объемное образование головного мозга, ишемический инсульт. Лечился в стационаре с диагнозом «транзиторная ишемическая атака». Прошел курс сосудистой, нейрометаболической терапии с нестойким положительным эффектом. Рекомендованную терапию (антиагреганты, статины, антигипертензивные препараты) не принимал. Ухудшение состояния отметил 16.11.16, около 14:00 нарушилась речь. В связи с отсутствием улучшения состояния госпитализирован бригадой СМП в ГКБ № 15 им. О.М. Филатова.
Состояние при поступлении средней степени тяжести, кожные покровы и видимые слизистые оболочки обычной окраски и влажности. В легких жесткое дыхание, хрипов нет. ЧДД 16 в минуту. Тоны сердца приглушены, ритмичные, ЧСС 68 уд/мин, АД 160/90 мм рт.ст. Живот мягкий, безболезненный при пальпации во всех отделах. Мочеиспускание самостоятельное. Моча светлая, прозрачная.
Неврологический статус: в сознании, продуктивному контакту доступен ограниченно из-за выраженных речевых нарушений. Когнитивные функции оценить не удается. Менингеальных знаков нет. Глазные щели S=D. Зрачки S=D. Фотореакции и корнеальные рефлексы сохранены. Движение глазных яблок в полном объеме. Нистагм и диплопия отсутствуют. Лицевая мускулатура симметрична. Глотание не нарушено. Язык по средней линии. В пробе Барре пронирует правую руку. Парезы отсутствуют. Мышечный тонус D=S, не изменен. Сухожильные рефлексы D>S, низкие. Патологических стопных знаков нет. Чувствительность достоверно оценить не удалось из-за речевых нарушений, функции тазовых органов контролирует. Четких нарушений чувствительности и координации не выявлено. Проба Ромберга не проводилась. Оценка по шкале инсульта (NIHSS) — 2 балла.
Лабораторные методы исследования: без особенностей, аHCV, поверхностный антиген вируса гепатита В (HBsAg), антитела к Treponema pallidum не обнаружены. Метод ИФА: aHCV — «+», ИБ — «+» от 23.11.16.
На ЭКГ ритм синусовый правильный, ЧСС 78 уд/мин. По данным ЭЭГ, на фоне умеренных диффузных изменений — дисфункция неспецифических структур головного мозга. Пароксизмальной активности и очаговой патологии не выявлено. УЗИ органов брюшной полости и почек выявило признаки диффузных неспецифических изменений печени, поджелудочной железы и кисты левой почки.
По заключению логопеда, у пациента присутствуют амнестико-семантическая афазия, афферентная моторная афазия, смешанная агнозия, дискалькулия, компонент дизартрии, дефект средней степени выраженности.
Нейровизуализация: при МСКТ на момент исследования свежих зон ишемии и кровоизлияний не выявлено. При МРТ головного мозга — картина подострой ишемии в левой теменной доле головного мозга, признаки центрального понтинного миелинолиза. Энцефалопатия. Признаки внутричерепной гипертензии. При наличии клинических и лабораторных данных может соответствовать ПМЛ. На рис. 3 

ПЦР-исследование ЧСЖ на JC-вирус положительное.
Диагноз: ИБ+ № 131988 от 23.11.16. Очаговое поражение головного мозга (ПМЛ).
Было проведено симптоматическое лечение: 25% раствор магнезии сульфата 10,0 мл + 0,9% раствор натрия хлорида — 200,0 мл в/в капельно; гепарин 5000 ЕД 3 раза в день подкожно; рекогнан (цитиколин) 1000 мг в/в; кортексин (полипептиды коры головного мозга скота) 10 мг в/м; бисопролол 5 мг утром; эналаприл 5 мг 2 раза в день; аторвастатин 20 мг вечером; аспирин 125 мг вечером; омез (омепразол) 20 мг 2 раза в день; диакарб (ацетазоламид) 500 мг. С целью профилактики гиподинамических и гипостатических нарушений, расширения двигательного режима назначен комплекс лечебной физкультуры.
На фоне проводимой терапии состояние с положительной динамикой. Стабилизированы показатели АД, скорректирована антигипертензивная терапия. Очаговый неврологический дефицит регрессировал частично. Сознание ясное. Речевые нарушения (амнестико-семантическая афазия, афферентная моторная афазия, смешанная агнозия, дискалькулия, компонент дизартрии) сохраняется, выраженность незначительно уменьшилась. Мимика симметрична, парезов конечностей нет.
Пациент имел типичный сосудистый анамнез, что, вероятнее всего, и затруднило постановку правильного диагноза. Положительный эффект от сосудистой терапии носил кратковременный характер, но в то же время позволил стабилизировать состояние перед переводом в специализированное лечебное учреждение.
Обсуждение проведенной терапии
ПМЛ является достаточно частым заболеванием для пациентов со сниженным иммунным статусом. Диагноз, как правило, ставится на основании типичной клинической картины, данных МРТ и положительного исследования ЦСЖ на JC-вирус методом ПЦР. Лечение до конца не разработано и носит симптоматический характер.
При энцефалопатии любого генеза происходит поражение нейроваскулярной единицы с развитием оксидантного стресса, для борьбы с которым применяли этилметилгидроксипиридина сукцинат. Этот препарат является антиоксидантом, оказывающим антигипоксическое, мембранопротективное, ноотропное, противосудорожное и анксиолитическое действие [21]. Этилметилгидроксипиридина сукцинаты разрешены для широкого медицинского применения для лечения ОНМК, энцефалопатии различного генеза (гипертоническая, атеросклеротическая, травматическая и т. д.), невротических и неврозоподобных расстройств с проявлением тревоги, для купирования абстинентного синдрома при алкоголизме, для лечения острой интоксикации нейролептиками и ряда других заболеваний. Производные янтарной кислоты обладают выраженным стресспротективным действием, которое проявляется в нормализации постстрессового поведения, соматовегетативных нарушений, восстановлении циклов сон—бодрствование, нарушенных процессов обучения и памяти, снижении дистрофических изменений в различных структурах головного мозга. Препараты включены в Федеральное руководство по использованию лекарственных средств. Существенным преимуществом сукцинатов является то, что они имеют незначительные побочные эффекты и низкую токсичность. У пациентов с минимально выраженными проявлениями цереброваскулярной патологии в качестве превентивной терапии рекомендованы курсы препарата в дозе 100 мг в/м в течение 2 нед, схему можно повторять 1 раз в 6 мес. Следует особо отметить тот факт, что эти дозы не оказывают влияния на системную гемодинамику, не требуют коррекции антигипертензивных препаратов, совместимы практически со всеми лекарственными средствами.
Кортексин (полипептиды коры головного мозга скота) — препарат с доказанной эффективностью на клиническом, биологическом, клеточном, генетическом и молекулярном уровнях [22]. Он воздействует на все этапы патологической цепи молекулярных событий, приводящих к гибели нейронов. Центральным звеном патологических процессов, протекающих в головном мозге на фоне гипоксии, является уменьшение содержания АТФ в нейронах мозга. Снижение синтеза увеличения расхода АТФ доказано сразу после стимуляции глутаматных рецепторов токсическими концентрациями глутамата. Известно, что снижение концентрации АТФ в нейронах во время гиперстимуляции глутаматных рецепторов может нарушить систему внутри- и межклеточной сигнализации в нейронах мозга, в частности ионный гомеостаз, активность ферментов гликолиза и окислительного фосфорилирования, захват Са 2+ митохондриями и синтез белков. Эти процессы могут лежать в основе гибели нейронов после гипоксии и токсического действия избыточно присутствующего в синаптической щели глутамата. Кортексин способен восстанавливать содержание АТФ после действия токсических концентраций глутамата в молодых и старых нейронах. Пептиды препарата оказывают прямое и опосредованное нейротрофическое воздействие на клетки, стимулируя рост нейритов или снижая гибель нейронов, культивируемых в среде, лишенной ростовых факторов. Основные механизмы этого влияния, вероятно, базируются на изменении экспрессии генов, регулирующих синтез собственных нейротрофических факторов, таких как мозговой нейротрофический фактор (BDNF) и фактор роста нервов (NGF). Препарат обладает множественными эффектами, в том числе осуществляет каскадную регуляцию апоптоза, экспрессию нейротрофических факторов, активацию энергетического обеспечения нервной клетки и митохондриального потенциала, улучшает функционирование рецепторов глутамата и регулирует концентрацию Са в клетке. Через систему противовоспалительных цитокинов кортексин улучшает нейротрофическое обеспечение нервного волокна и уменьшает аутоиммунную агрессию, способствуя восстановлению и росту аксонов. Предполагается, что положительный эффект кортексина объясняется не только действием полипептидных составляющих, но и нейрохимической активностью макро- и микроэлементов, а также витаминов (А, Е, В1 и РР) [22]. В отличие от многих препаратов ноотропного действия, кортексин оказывает стимулирующий эффект на психические функции, а в ряде случаев корригирует аномальную биоэлектрическую активность мозга (подтверждено психологическими тестами и ЭЭГ). Препарат отличают также практически полное отсутствие побочных реакций и исключительно благоприятная переносимость пациентами любого возраста [22]. В 2009 г. The Open Neuropsychopharmacology Journal опубликовал исследование о применении препарата кортексин и его влиянии на когнитивные функции и поведенческие реакции (в условиях эксперимента) [23]. Недавно появились новые данные об опосредованном иммуностимулирующем действии кортексина [24]. Сбалансированность пептидов препарата, многоплановость тонких механизмов действия объясняют не только терапевтическую эффективность, но и отсутствие побочного действия препарата. Курс лечения составляет от 10 до 20 дней.
Однако при наличии у пациентов выраженной неврологической симптоматики (острые инсультоподобные эпизоды с общемозговой и очаговой симптоматикой, когнитивные нарушения, эпизоды головокружения или внезапного падения и т. д.) из-за использования на этом этапе синтезированных химически, чужеродных лекарственных средств рекомендуется добавление в схему терапии других препаратов. В то же время естественные метаболиты биохимических процессов в организме позволяют уже на ранних стадиях заболевания уменьшить прогрессирование процесса и предотвратить дальнейшую дегенерацию нейрона. Приоритетно назначение препаратов, влияющих на фосфолипиды и продукты их метаболизма — поскольку фосфолипиды являются основным структурным компонентом всех клеточных мембран, то от них напрямую зависят многочисленные функции клетки. Кроме фосфолипидов и холестерина в мембрану также встроены различные белки, которые являются рецепторами для гормонов, ферментов, биологически активных веществ. Нормальное функционирование белков, в том числе лекарственных препаратов пептидной природы, напрямую зависит от окружающих их фосфолипидов. С этой точки зрения несомненный интерес представляют данные исследований по использованию цитиколина. Рекогнан (цитиколин) — лекарственное средство, хорошо изученное и широко применяющееся при разных формах цереброваскулярной патологии в странах Западной Европы, США и Японии в течение последних 30 лет [25]. Цитиколин — естественный метаболит биохимических процессов в организме, т. е. он не является чужеродным химическим соединением, ксенобиотиком, как большинство лекарственных средств. В его состав входят цитидин и холин, связанные дифосфатным мостиком, и он является необходимым промежуточным соединением в синтезе фосфатидилхолина, основного мозгового фосфолипида, в пути синтеза фосфолипидов (путь Кеннеди). Цитиколин уменьшает потерю фосфатидилхолина, входящего в состав клеточной мембраны, участвует в синтезе нейромедиатора ацетилхолина, стимулирует активность тирозингидроксилазы и секрецию дофамина. В экспериментах цитиколин снижал нейронную дегенерацию в гиппокампе крыс, вызванную инъекцией бета-амилоидного белка [26]. Бета-амилоид является нормальным белком организма. Степень когнитивных расстройств прямо пропорциональна его накоплению. Холин в сочетании с цитидином стимулирует секрецию нормального нейротрофного амилоидного белка-предшественника мозговыми клетками крыс. Цитиколин способен снижать отложение бета-амилоида в головном мозге, что клинически проявляется в улучшении интегральных показателей когнитивных функций. Кроме воздействия на бета-амилоид, нейропротективное действие цитиколина, вероятно, обусловлено перераспределением основного транспортера глутамата EAAT2 в микродомены липидных рафтов, которое приводит к повышению усвоения глутамата. С учетом этих данных было проведено множество клинических исследований оценки эффективности цитиколина в лечении когнитивных расстройств, связанных со старением головного мозга, цереброваскулярными заболеваниями и деменцией [27]. В европейских клинических исследованиях установлено, что введение препарата в разных дозах при разной продолжительности лечения более существенно улучшало неврологические функции, способствовало раннему восстановлению двигательной и когнитивных функций [28]. В терапии пациентов с ПМЛ цитиколин играет еще одну немаловажную роль: он оказывает иммуномодулирующее действие, которое основывается на снижении плазменных уровней гистамина, при одновременном повышении ФНО-α [29]. Курс лечения длительный (до 6—12 мес).
Заключение
ПМЛ — заболевание, которое встречается у пациентов с различной патологией, включая нейроинфекции, ревматоидный артрит, при использовании некоторых лекарственных препаратов, поэтому врачу-клиницисту крайне важно знать диагностические критерии этой нозологии, уметь правильно поставить диагноз, как можно раньше начать симптоматическую терапию. Это позволит улучшить состояние пациента с учетом того, что эффективного лечения ПМЛ до сих пор не существует. До настоящего момента широко используются противовирусные препараты, цитостатики, антагонисты серотониновых рецепторов, плазмаферез. Однако следует заметить, что все вышеописанные методы возможны лишь после установления причин ПМЛ, в то время как пациент нуждается в экстренной помощи. Поэтому целесообразно применять схемы патогенетической терапии с использованием препаратов, обладающих плейотропными эффектами.
Авторы заявляют об отсутствии конфликта интересов.
1 Письмо Федеральной службы по надзору в сфере здравоохранения от 7 февраля 2014 г. № 02И-110/14 «О новых данных по безопасности лекарственного препарата Бенлиста». [The letter of the Federal service for supervision in the sphere of health № 02И-110/14 dated February, 07 2014»About new data about safety of drug Benlysta». (in Russ.)]. http://www.garant.ru/products/ipo/prime/doc/70485650/#ixzz3OWJlGxDT
2 Инструкция по медицинскому применению препарата диакарб.