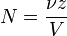что такое молярная концентрация раствора
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Что такое молярная концентрация раствора
§7.7 Концентрация раствора.
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Во-вторых, многие химические реакции проводят в растворах. И здесь ошибки могут приводить к печальным результатам. Например, если фотограф ошибется при растворении проявителя, то фотографии либо не проявятся, либо будут испорчены. Другой пример: если залить в аккумулятор раствор, в котором содержание серной кислоты будет меньше или больше требуемого, то аккумулятор либо не будет работать, либо выйдет из строя.
Еще один пример из лабораторной практики. Для получения бромистого калия (KBr) взяли два раствора: HBr и KOH. Из-за ошибки при приготовлении растворов гидроксид калия KOH добавили в воду в гораздо большем количестве, чем это требовалось для реакции обмена:
H Br + K OH = K Br + H 2 O
В результате полученный водный раствор KBr оказался безнадежно испорченным примесью непрореагировавшего, очень едкого гидроксида калия KOH.
Во всех перечисленных случаях было не учтено или нарушено заданное содержание вещества в растворе. Давайте разберемся в том, как правильно выражать это содержание и как правильно готовить раствор, если содержание вещества в растворе задано.
Массовая доля растворенного вещества – это отношение массы растворенного вещества m 1 к общей массе раствора m, выраженное в процентах.
Как же приготовить 25%-ный раствор? Надо взвесить на весах 25 г безводного сульфата магния и отмерить мензуркой 75 мл воды (либо взвесить на весах 75 г воды, что одно и то же). Затем сульфат магния надо высыпать в воду и перемешать до полного растворения. Получится 100 г раствора (25 г + 75 г = 100 г), в котором массовая доля сульфата магния составляет точно 25 %.
** Если для взвешивания 25 г MgSO 4 не найдется безводной соли, а в наличии окажется только более распространенный кристаллогидрат MgSO 4 . 7H 2 O, то необходимо взять больше соли. Предварительно следует рассчитать, в каком количестве MgSO 4 . 7H 2 O содержится 25 г MgSO 4 и взвесить именно это рассчитанное количество MgSO 4 ·7H 2 O. Соответственно, на приготовление такого раствора пойдет меньше воды, потому что часть ее уже имеется в кристаллогидрате.
Разумеется, 100 г раствора – слишком маленькое количество для автомобильного аккумулятора, поэтому приготовим 10 кг раствора. Для этого увеличим все цифры в 100 раз. Итак, нам потребуется взвесить на весах (36 г х 100) = 3600 г или 3,6 кг крепкой (безводной) серной кислоты и отмерить (64 г х 100) = 6400 г или 6,4 л дистиллированной воды.
Осторожно смешаем серную кислоту с водой (происходит сильный разогрев). Получим 10 кг 36%-ного раствора серной кислоты, который после охлаждения можно заливать в аккумулятор.
** Водитель, который не очень усердно изучал в школе химию, может легко ошибиться, взяв вместо 3,6 кг серной кислоты 3,6 л серной кислоты. В этом случае аккумулятор будет испорчен, потому что количество H 2 SO 4 в растворе окажется намного больше требуемого.
Дело в том, что серная кислота – довольно «тяжелая» жидкость, ее плотность 1,84 кг/л. Можно подсчитать, какой объем займет серная кислота массой 3,6 кг:
1 л H2 SO 4 весит 1,84 кг (плотность серной кислоты)
х л H2 SO 4 весят 3,6 кг
Отсюда х = 1 л . 3,6 кг/1,84 кг = 1,956 л – такой объем (меньше двух литров!) занимает концентрированная кислота весом 3,6 кг.
Массовую долю растворенного вещества называют также ПРОЦЕНТНОЙ КОНЦЕНТРАЦИЕЙ раствора.
Концентрация – это относительное количество растворенного вещества в растворе.
Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
Единица молярной концентрации – моль/л. Зная число молей вещества в 1 л раствора, легко отмерить нужное количество молей для реакции с помощью подходящей мерной посуды.
В качестве примера рассмотрим получение нерастворимого в воде хлорида серебра (AgCl) с помощью реакции обмена:
AgNO 3 + NaCl = Ag Cl (осадок) + Na NO 3
Кстати, не нужно запоминать, какие соли растворимы, а какие нерастворимы в воде. Для этого существует таблица растворимости (теперь она есть и в меню левого окна).
По уравнению реакции на 1 моль AgNO 3 нужен 1 моль NaCl. Следовательно, если мы смешаем одинаковые объемы растворов AgNO 3 и NaCl одинаковой концентрации 1 моль/л, то реакция пройдет до конца и в реакционной колбе окажется только раствор нитрата натрия (NaNO 3 ) в воде, а на дно сосуда выпадет осадок хлорида серебра AgCl. При этом исходных соединений в сосуде не останется.
Рис. 7-4. Последовательность приготовления молярного раствора хлорида натрия (1моль/л NaCl): а) берут мерную колбу емкостью 1 л; б) помещают в колбу навеску кристаллического NaCl. в) в колбу добавляют немного дистиллированной воды, растворяют кристаллы и доливают раствор водой до метки 1 л, после чего тщательно перемешивают.
Мерная колба представляет собой сосуд с тонкой шейкой, на которой по стеклу нанесена кольцеобразная метка. Если заполнить мерную колбу жидкостью до метки, то ее объем составит ровно 1 л. Возьмем такую колбу и приступим к приготовлению нужного нам раствора NaCl.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5. Следовательно, молярная масса NaCl (масса 1 моль) равна 58,5 г. Взвесим это количество NaCl на весах и поместим кристаллы в мерную колбу. Затем добавим немного воды и растворим кристаллы, покачивая колбу. Когда вся соль растворится, дольем раствор водой до метки. Мерные колбы делают таким образом, что объем раствора достигает точно 1 л, когда водный мениск (уровень воды, слегка изогнутый силами поверхностного натяжения) касается метки своей нижней частью. После этого раствор аккуратно перемешаем.
Молярные концентрации в общем виде иногда обозначают следующим образом:
На фотографии слева показан опыт, который мы обсуждаем. Видно, как при смешивании растворов исходных солей выпадает белый осадок AgCl.
Если бы мы взяли не молярные, а, например, 10%-ные растворы AgNO 3 и NaCl (одинаковые объемы), то в них бы содержалось разное число молекул этих веществ и одна из этих солей не израсходовалась бы полностью и осталась в растворе. Какая же из двух солей оказалась бы в избытке? Та, число молей которой больше. Это будет NaCl – соль с меньшим молекулярным весом, поскольку в одинаковой массе солей число более легких молекул (и молей) NaCl оказывается б о льшим.
Каждый способ выражения концентрации раствора удобен в зависимости от цели, которую преследует химик или технолог. Процентные концентрации более удобны в технике, медицине, экологии. Молярные концентрации чаще встречаются в лабораторной практике.
Молярная концентрация
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Содержание
Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
Массовое процентное содержание компонента, m%
В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в аккумуляторных) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров.
Молярность (молярная объёмная концентрация)
Моляльность (молярная весовая концентрация)
Моляльность — число молей растворённого вещества в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как 0,1 н.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата KHSO4, и двухнормальным в реакции с образованием K2SO4.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, т.к. при этом изменяется плотность растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т.п.
Формулы перехода от одних выражений концентраций растворов к другим
Наиболее распространённые единицы
| Измеряемая величина | Запись | Формула | Типичная единица |
|---|---|---|---|
| Атомный процент (A) | at.% | 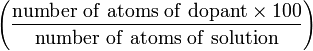 | % |
| Атомный процент (B) | at.% | 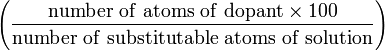 | % |
| Массовый процент | wt% | 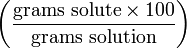 | % |
| Mass-volume percentage | — | 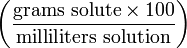 | % though strictly %g/mL |
| Volume-volume percentage | — | 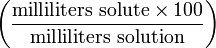 | % |
| Молярность | M | 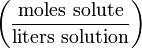 | mol/L (or M or mol/dm 3 ) |
| Molinity | — | 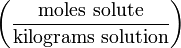 | mol/kg |
| Моляльность | m | 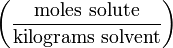 | mol/kg (or m**) |
| Мольная доля | Χ (chi) | 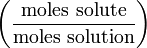 | (decimal) |
| Formal | F | 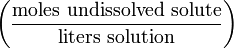 | mol/L (or F) |
| Нормальность | N | 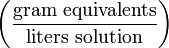 | N |
| Частей на сто (Parts per hundred) | % (or pph) | 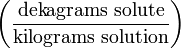 | da.g/kg |
| Частей на тысячу (Parts per thousand) | ‰ (or ppt*) | 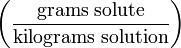 | g/kg |
| Частей на миллион | ppm | 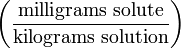 | mg/kg |
| Частей на миллиард (Parts per billion) | ppb | 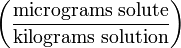 | µg/kg |
| Parts per trillion | ppt* | 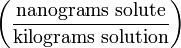 | ng/kg |
| Parts per quadrillion | ppq | 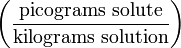 | pg/kg |
Полезное
Смотреть что такое «Молярная концентрация» в других словарях:
молярная концентрация — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN molar concentration … Справочник технического переводчика
молярная концентрация — – способ выражения концентрации растворов, определяемый как отношение количества растворенного вещества к объему раствора. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
молярная концентрация — molinė koncentracija statusas T sritis fizika atitikmenys: angl. molar concentration; molarity vok. molare Konzentration, f; Molarität, f; Stoffmengenkonzentration, f rus. мольная концентрация, f; молярная концентрация, f; молярность, f pranc.… … Fizikos terminų žodynas
молярная концентрация — molinė koncentracija statusas T sritis Standartizacija ir metrologija apibrėžtis Ištirpusios medžiagos molių kiekis 1 l tirpalo. atitikmenys: angl. molar concentration; molarity vok. molare Konzentration, f; Molarität, f; Stoffmengenkonzentration … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярная концентрация — molinė koncentracija statusas T sritis chemija apibrėžtis Medžiagos molių kiekis vienetiniame tūryje (ppr. mol/l). atitikmenys: angl. molar concentration; molarity rus. молярная концентрация; молярность … Chemijos terminų aiškinamasis žodynas
МОЛЯРНАЯ КОНЦЕНТРАЦИЯ — растворённого вещества физ. величина, равная отношению кол ва растворённого в ва к объёму р ра. Единица М. к. (в СИ) моль/м3. В химии применяют внесистемную единицу моль/л (1 моль/л = 103 моль/м3). Так, для H2SО4 2 моль/л означает р р серной к ты … Большой энциклопедический политехнический словарь
молярная концентрация — молярность, мольность … Cловарь химических синонимов I
молярная концентрация влаги — Нрк. молярно объемная концентрация парциальная молярная плотность Отношение количества влаги, содержащейся в веществе, к объему этого влажного вещества. Единица измерения моль/м3 [РМГ 75 2004] Недопустимые, нерекомендуемые молярно объемная… … Справочник технического переводчика
Молярная концентрация эквивалента — Величина Сэквх, численно равная частному от деления массовой концентрации вещества х на молярную массу его эквивалента и рассчитываемая по формуле где Стх массовая концентрация вещества х, г; Мэквх молярная масса эквивалента вещества х, г.… … Словарь-справочник терминов нормативно-технической документации
молярная концентрация влаги — 29 молярная концентрация влаги (Нрк. молярно объемная концентрация, парциальная молярная плотность): Отношение количества влаги, содержащейся в веществе, к объему этого влажного вещества, моль/м3. Источник … Словарь-справочник терминов нормативно-технической документации