что такое миелолейкоз у человека
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
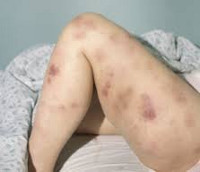
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
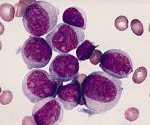
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Что такое миелолейкоз у человека
Миелолейкоз – это злокачественное заболевание крови и костного мозга, при котором образуется избыточное количество гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников. Гранулоциты являются разновидностью лейкоцитов и отвечают за защиту организма от инфекций. При миелолейкозе они перестают выполнять свои функции и вытесняют из крови и костного мозга нормальные клетки крови, проникают в другие органы, нарушая их работу.
Существует множество разновидностей миелолейкоза, различаемых в зависимости от скорости развития патологического процесса, зрелости лейкозных клеток, изменений в хромосомах. Чаще всего выделяют два основных типа заболевания: острый миелобластный лейкоз и хронический миелоидный лейкоз.
При любом типе миелолейкоза применяется комплексное и достаточно длительное лечение. С каждым годом появляются все более эффективные методы терапии этого вида рака крови. Прогноз заболевания зависит от типа миелолейкоза, стадии болезни, на которой начато лечение, возраста пациента. В целом прогноз при остром миелолейозе благоприятный, особенно у детей. При хроническом миелолейкозе прогноз хуже, однако при своевременном начале лечения современные методы терапии позволяют надолго приостановить прогрессирование патологического процесса.
Лейкемия миелоидная, Ph-положительный хронический миелолейкоз, лейкоз гранулоцитарный, миелоидный лейкоз, миелолейкоз, миелоз, миеломная болезнь, острый миелобластный лейкоз, острый нелимфобластный лейкоз, острый нелимфобластный лейкоз у взрослых.
Childhoodacutemyeloidleukemia, adultacutemyeloidleukemia, acutemyeloidleukemia, acutemyeloblasticleukemia, acutegranulocyticleukemia, acutenonlymphocyticleukemia, chronicmyeloidleukemia, chronicgranulocyticleukemia.
Острый миелолейкоз обычно развивается стремительно – в течение нескольких недель. Его основными симптомами являются:
Хронический миелолейкоз развивается постепенно и проходит 3 стадии:
1) хроническая – симптомы обычно отсутствуют;
2) прогрессирующая – появляются слабость, боли в животе;
3) бластный криз – на этом этапе заболевание протекает со всеми симптомами острого миелолейкоза.
Общая информация о заболевании
Все клетки крови развиваются из единой стволовой клетки, которая затем дает начало миелоидным и лимфоидным стволовым клеткам. Из лимфоидных формируются лимфоциты, миелоидные дают начало предшественникам эритроцитов, тромбоцитов и миелобластам. Именно из миелобластов в результате цепочки последовательных делений формируются гранулоциты и моноциты.
Гранулоциты представляют собой разновидность лейкоцитов и называются так из-за своего вида – под микроскопом в них видны характерные темные гранулы, а также ядро, состоящее из нескольких сегментов. Существует несколько видов гранулоцитов – эозинофилы, базофилы и нейтрофилы. Моноциты также имеют сегментированное ядро, но их гранулы светлые. Основная задача гранулоцитов и моноцитов – борьба с вредными для организма чужеродными агентами (вирусами, бактериями).
При миелолейкозе костный мозг вырабатывает избыточное количество патологических гранулоцитов. Постепенно они вытесняют из крови и костного мозга нормальные клетки крови, что приводит к появлению характерных симптомов. При подавлении деления и роста эритроцитов возникают симптомы анемии – бледность, головокружение, слабость, – при подавлении роста тромбоцитов – нарушения свертываемости крови, частые кровотечения. Лейкозные клетки могут проникать в другие органы – печень, селезенку, лимфатические узлы, головной и спинной мозг, – вызывая нарушение их функций и характерные проявления. Патологические миелоидные клетки также могут образовывать скопления в надкостнице, средостении, органах желудочно-кишечного тракта (хлоромы).
Злокачественные нарушения кроветворения происходят из-за повреждения ДНК миелоидных клеток. ДНК клетки содержит информацию о ее росте, делении и гибели и представлена в клетке в виде хромосом. Факторы, повреждающие ДНК миелоидных клеток, до конца не изучены. Доказано вредное воздействие ионизирующей радиации, предшествующей химиотерапии, токсических веществ, например бензола. Выявлены также характерные изменения структуры и количества хромосом при определенных видах миелолейкоза.
При остром миелолейкозе часто наблюдаются повреждения 8-й, 15-й, 16-й, 17-й и 21-й хромосом. Характерным признаком хронического миелолейкоза считается наличие филадельфийской хромосомы. Она встречается в 95 % всех случаев хронического миелолейкоза и образована в результате присоединения к 22-й хромосоме участка 9-й хромосомы. Филадельфийская хромосома активирует синтез специальных белков тирозинкиназ, которые нарушают деление миелоцитов. В результате в крови появляются как зрелые гранулоциты, так и бластные клетки.
Острый миелолейкоз встречается как у взрослых, так и у детей. При нем в крови и костном мозге находят большое количество миелобластов. При хроническом миелолейкозе миелоидные клетки более зрелые и «специализированные». Средний возраст пациентов с хроническим миелолейкозом – 55-60 лет.
Кто в группе риска?
Лабораторные методы обследования
Другие методы обследования
Специфической профилактики миелолейкоза нет. Для своевременной диагностики необходимо регулярно проходить профилактические осмотры, а при возникновении тревожных симптомов сразу обращаться к врачу.
Хронический миелолейкоз
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «3» октября 2019 года
Протокол №74
Хронический миелолейкоз (ХМЛ) – клональное миелопролиферативное заболевание, развивающийся в результате злокачественной трансформации в ранних гемопоэтических предшественниках. Цитогенетическим маркером ХМЛ является приобретенная хромосомная транслокация t(9;22), которая получила название филадельфийской хромосомы (Ph+). Выявление Ph`-хромосомы происходит в результате обмена генетическим материалом между хромосомами 9 и 22 t (9;22). В результате переноса генетического материала с 9 на 22 хромосому на ней образуется слитный ген BCR—ABL1.
Хронический миелоидный лейкоз (ХМЛ) составляет 15% от общего числа лейкозов у взрослых. Средний возраст начала заболевания составляет 67 лет; однако ХМЛ встречается во всех возрастных группах (статистика SEER).
Код(ы) по МКБ-10:
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| аллоТКМ | – | аллогенная трансплантация костного мозга |
| БФ | – | бластная фаза |
| БМО | – | большой молекулярный ответ |
| ГСК | – | гемопоэтические стволовые клетки |
| ГГТП | – | гаммаглютамилтранспептидаза |
| Ед | – | единица измерения |
| ИТК | – | ингибиторы тирозинкиназ |
| ИФА | – | иммунноферментный анализ |
| ИФТ | – | иммуннофенотипирование |
| КП | – | клинический протокол |
| КТ | – | компьютерная томография |
| ЛДГ | – | лактатдегидрогеназа |
| Мл | – | миллилитр |
| МЕ | – | международная единица |
| Мг | – | миллиграмм |
| МКБ | – | международная классификация болезней |
| ОАК | – | общий анализ крови |
| ОБП | – | органы брюшной полости |
| ПХТ | – | полихимиотерапия |
| ПЦР | – | полимеразная цепная реакция |
| ПГО | – | полный гематологический ответ |
| ПМО | – | полный молекулярный ответ |
| РКИ | – | рандомизированное клиническое исследование |
| СЦИ | – | стандартное цитогенетическое исследование |
| ТКМ | – | трансплантация костного мозга |
| УД | – | уровень доказательности |
| УЗИ | – | ультразвуковое исследование |
| ЭКГ | – | электрокардиограмма |
| ФА | – | фаза акселерации |
| ХФ | – | хроническая фаза |
| ХМЛ | – | хронический миелолейкоз |
| ЦО | – | цитогенетический ответ |
| BCR/ABL | – | белок с повышенной тирозинкиназногй активностью, продукт гена BCR/ABL |
| EBMT | – | European Group for blood and Marrow |
| ELN | – | Европейская организация по лечению лейкозов |
| ESMO | – | Европейское общество медицинской онкологии |
| NCCN | – | Национальная онкологическая сеть США |
| Ph+ | – | клетки, содержащие филадельфийскую хромосому |
| FISH | – | флуоресцентная гибридизация |
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности [1]:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GCP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Классификация 4
В течении ХМЛ выделяют 3 фазы: хроническую, переходную (фазу акселерации) и терминальную фазу (бластной трансформации или бластный криз). 4 Критерии фаз акселерации и бластного криза представлены в таблице.
Фазы ХМЛ по классификации ELN [6]:
| Фаза ХМЛ | Классификация ELN |
| Хроническая | Отсутствие признаков фазы акселерации и бластного криза |
| Акселерации | 15-29% бластных клеток в периферической крови и/или костном мозге; сумма бластов и промиелоцитов ≥30% (при этом бластов |
| Бластный криз | Наличие в периферической крови или костном мозге ≥30% бластных клеток появление экстрамедулярных инфильтратов бластных клеток |
Стратификация пациентов по группам риска ELN 2017.
Группа риска ХМЛ – понятие, применимое только для хронической фазы (ХФ) ХМЛ. Группа риска с этой фазе оценивается только на момент диагностики заболевания, до начала терапии. Она рассчитывается на основании прогностически значимых характеристик: низкий, промежуточный, высокий риск (УД – А).
Таблица 3.
| Шкала | Формула расчета | Группа риска | Конечная точка |
| Eutos | 7 × число базофилов (%) + 4 ×размеры селезенки* (см) | Низкий ( | Полный цитогенетический ответ |
| Euro | 0,6666 × возраст (0-при 50 лет/) +0,0420 × размеры селезенки- (см) +0,0584 × бластных клеток (%) +0,0413 ×число эозинофилов (%) +0,2039 × чило базофилов (0- при 3) +1,0956 × число тромбоцитов (0 – при 1500×109/л) × 1000 | Низкий (≤ 87) Промежуточный (781-1480) Высокий (≥1481) | Выживаемость |
| ELTS | 0,0025 × (возраст/10)3 +0,0615 × размеры селезенки* (см) +0,1052 × число бластных клеток (%) + 0,4104 × число тромбоцитов × 109/л /1000-0,5 | Низкий (≤ 1,5680) Промежуточный(>1,5680, но ≤ 2,2185 ) Высокий (>2,218) | ХМЛ-специфическая выживаемость |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 12
Диагностические критерии
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
Диагноз хронического миелолейкоза в классических случаях не представляет затруднений. Трудности обычно возникают в начальном периоде заболевания, когда еще нет четких лейкемических изменений со стороны крови и выраженных признаков системной метаплазии в органах.
Основным патогномоничным признаком заболевания является обнаружение при цитогенетическом исследовании филадельфийской хромосомы (t(9;22)) и химерного гена BCR-ABL1.
Таблица 6.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [13-15,21,22]
Принципы выбора ИТК
При использовании препаратов ИТК улучшились показатели общей выживаемости, достижение хорошего качества жизни, восстановления нормального кроветворения, путем подавления лейкозного клона.
Эффективность иматиниба доказана положительным опытом применения в клинических исследованиях (IRIS, CML IV). Однако, резистентные к лечению иматинибом и подобными препаратами больные ХМЛ нуждаются в раннем переводе на другую терапию.
Необходимо отметить, что абсолютных противопоказаний к использованию ИТК у пациентов с ХМЛ нет. При выборе конкретного препарата в первую и последующие линии лечения необходимо учитывать фазу ХМЛ, сопутствующие заболевания и риск развития побочных эффектов в процессе терапии, а также мутационный спектр.
Выбор терапии ИТК первой линии у пациента должен основываться на оценке риска, профиле токсичности ИТК, возрасте пациента, способности переносить терапию и наличии сопутствующих заболеваний.
Терапия ИТК первой и второй линии должна быть выбрана с учетом наибольшей эффективности и наименьшего риска побочных явлений. Аллогенная трансплантация гемопоэтических стволовых клеток должна быть обязательно рассмотрена для ХМЛ ХФ с высокой группой риска прогрессии, у больных с неудачей терапии первой линии, а также в продвинутых фазах ХМЛ, но в гематологической ремиссии. Ранняя оценка ответа на лечение, предупреждение развития резистентности и быстрое переключение на максимально эффективную терапию при отсутствии оптимального ответа должны быть основаны принципами современной терапии ХМЛ (УД – А).
Нилотиниб (150 мг, 200мг, таблетка/капсула).
Противоопухолевый препарат, ингибитор протеин-тирозинкиназы. Нилотиниб мощно ингибирует тирозинкиназную активность BCR-ABL1 онкопротеина клеточных линий и первично положительных по филадельфийской хромосоме (Ph-положительных) лейкозных клеток. Оказывает выраженное ингибирующее влияние на BCR-ABL1 онкопротеин дикого типа, а также демонстрирует активность в отношении 32 и 33 основных иматинибрезистентных мутантных форм BCR-ABL1-тирозинкиназы, за исключением Т3151 мутации.
В первой линии терапии показан больным ХФ ХМЛ в начальной дозе 600 мг/сут и в ФА ХМЛ в дозе 800 мг/сут. Во второй линии терапии назначается в дозе 800 мг/сут в ХФ и ФА. Независимо от фазы ХМЛ принимается 2 раза в сутки в равных дозах с интервалом 12 часов. Прием рекомендуется осуществлять натощак или не ранее чем через 2 часа после еды, после приема нилотиниба пищу следует принимать не ранее чем через 1 час. Капсулы запивать достаточным количеством воды. При развитии токсических проявлений доза может быть снижена до 400 мг 1 раз в сутки. При недостаточной эффективности препарата возможно повышение дозы до 800 мг в сутки больным в ХФ.
С осторожностью применять при панкреатите в анамнезе, сахарном диабете, атеросклерозе сосудов, окклюзионной болезни периферических артерий.
Дазатиниб (20 мг, 50 мг, 70 мг, 100 мг, таблетка/капсула).
Противоопухолевое средство, многоцелевой препарат, ингибитор протеинтирозинкиназ: BCR-ABL1, семейство SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2 и PDGFR бета. Связывается со многими формами ABL киназы, активен в лейкозных клеточных линиях, как чувствительных, так и резистентных к иматинибу. Дазатиниб подавляет активность не только ABL-тирозинкиназы, c-Kit- и PDGFR-киназ, но и активность около 30 других различных киназ: семейства SRC (SRC, LCK, YES, FIN), семейства TYR и SER/THR (GAK, MAPK14, MAP3K, MAP3K4), DDR1, EPHA, ZAK и др., может связываться как с активной, так и неактивной конформацией киназного домена ABL. Активен в отношении мутантных форм BCR-ABL-тирозинкиназы, за исключением T315I. Рекомендуемая доза дазатиниба для ХФ составляет 100 мг/сут, а для ФА и БК – 140 мг/сут. При явлениях токсичности доза дазатиниба больным в ХФ может быть снижена до 80 мг 1 раз в сутки, больным в ФА и БК – до 100 мг 1 раз в сутки, при повторных эпизодах токсичности – до 80 мг/сут. При недостаточной эффективности препарата возможно повышение дозы до 140 мг 1 раз в сутки больным в ХФ. С учетом фармакокинетики Дазатиниб характеризуется приемом, вне зависимости от приема пищи. Показана возможность Дазатиниба проникать через гематоэнцефалический барьер.
С осторожностью применять при хронических сердечно-сосудистых заболеваниях, хронических обструктивных заболеваниях легких, бронхиальной астме, пневмонии, травма грудной клетки, хронических заболеваниях ЖКТ с высоким риском развития кровотечений.
Рекомендации по лечению ХМЛ.
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия | |
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия | |
4Пациентам с высоким риском в хронической фазе ХМЛ возможно использование нилотиниба и дазатиниба в первой линии терапии (при сумме баллов >1480 по EURO, >87 по EUTOS.
Терапия при неудаче лечения первой и второй линии:
Возможности терапии при неудаче первой и второй линии лечения, а также при прогрессии ХМЛ до продвинутых фаз ограничены. При получении клинико-гематологической ремиссии, достижении редукции опухолевого клона (клинико-гематологического, цитогенетического ответа) при третьей линии терапии вопрос о выполнении аллоТКМ необходимо решать незамедлительно, так как этот метод является единственным, способным в этой ситуации дать шанс на длительную безрецидивную выживаемость (УД – А).
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина. Препаратом, при применении которого показана возможность получения цитогенетических и молекулярных ремиссий у пациентов с ХМЛ с мутацией T315I, является недавно одобренный к применению в США понатиниб [21], однако в настоящее время препарат не доступен в Казахстане (нет регистрации).
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (уровень доказательности А) [20]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Варианты ответа на терапию при хроническом миелолейкозе.
Таблица 9.
| Вариант ответа | Определение | |
| Гематологический | ||
| Полный | Лейкоциты | |
| Цитогенетический | ||
| Полный* Частичный** Малый Минимальный Отсутствие ответа | Ph-хромосома в метафазах не определяется Ph-хромосома в 1–35 % метафаз Ph-хромосома в 36–65 % метафаз Ph-хромосома в 66–95 % метафаз Ph-хромосома в > 95 % метафаз | |
| Молекулярный*** | ||
| Большой (МО3.0) | Соотношение BCR-ABL1/ABL ≤ 0,1 и > 0,01 % по шкале IS | |
| Глубокий | МО4.0 | |
| МО 4 | МО 4.5 | МО 5 |
| Минимальная сумма эталонных транскриптов гена независимо от того, обнаружен ли BCR-ABL1 или нет 1 |
уровень BCR-ABL1 для положительных образцов 2
1Количество транскриптов референсного гена в том же объеме кДНК, который тестируется на BCR / ABL1. Минимальное количество в каждом отдельном экземпляре должно быть 10 000 ABL1 или 24000 GUSB
2Минимальные референсные генные копии в строке выше выполнены
Рекомендации по оценке ответа в хронической фазе ХМЛ в зависимости от длительности и характера ответа на предшествующую терапию ИТК в первой линии [21].
Таблица 11.
терапии
аномалии в клетках Ph+
Ph+ ≤ 35 % (ЧЦО)
BCR-ABL1
Факторы риска неудачи:
Ph+ > 65 % (менее МЦО) и BCR-ABL1 ≥ 10 %*
BCR-ABL1
BCR-ABL1 1–10 %
BCR-ABL1 ≥ 10 %
BCR-ABL1 ≤ 0,1 % (БМО)
BCR-ABL1 0,1–1,0 %
BCR-ABL1 ≥ 1 %
Мутации BCR-ABL1
ДХА в клетках Ph+
ДХА — дополнительные хромосомные аномалии; МЦО — малый цитогенетический ответ; ЧЦО — частичный цитогенетический ответ.
* При выполнении только молекулярного анализа рекомендуется повторное исследование в течение 1–2 мес. для подтверждения результата.
** Подтвержденная потеря БМО (уровень BCR-ABL1 > 0,1 % в двух и более последовательных анализах, в одном из которых BCR-ABL1 > 1 %).
Эффект терапии первой линии может быть расценены как оптимальный, неудача терапии, предупреждение (УД – А) [20].
Оптимальный ответ свидетельствует о благоприятном прогнозе, ожидаемой высокой безрецидивной выживаемости и возможности достичь более глубокого ответа вплоть до выздоровления. При оптимальном ответе продолжают лечение тем же препаратом ИТК.
Предупреждение указывает на необходимость тщательного мониторинга и готовность к смене терапии с учетом биологических признаков более агрессивного течения с анализом результатов мутационного статуса.
Неудача терапии служит показанием к смене препарата на следующую линию препарата ИТК. Потеря достигнутой ранее ремиссии, новые мутации, появление ДХА в Ph-позитивных клетках при терапии ИТК также свидетельствуют о неудаче лечения. При констатации неудачи терапии необходимо подтверждение приверженности пациента к ней и возможного лекарственного взаимодействия, целесообразен анализ на мутации BCR-ABL1.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь | А | |
| Левофлоксацин | Внутривенное введение Внутрь | — | |
| Ципрофлоксацин | Внутривенное введение Внутрь | С | |
| Сульфаметоксазол /триметоприм | Внутривенное введение Внутрь | А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь | В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь | С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь | А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь | А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь | А | |
| Хлоргексидин | Наружное применение | — |
Хирургическое вмешательство: нет.
Дальнейшее введение: перспективой лечения ХМЛ представляется переход от пожизненного приема ИТК к возможности прекращения терапии под динамическим наблюдением. В связи с этим одной из задач терапии ХМЛ можно считать получение глубоких молекулярных ответов (М04 и М04.5). Такая стратегия вполне обоснована, учитывая ожидаемую долгую продолжительность жизни больных ХМЛ и многолетний прием лекарственных средств.
Индикаторы эффективности лечения: см. таб. 8,9.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [21,22,24,25]
Рекомендации по лечению ХМЛ
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. | |
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. | |
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина [21].
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (УД – А) [22]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12.
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь | А | |
| Левофлоксацин | Внутривенное введение Внутрь | — | |
| Ципрофлоксацин | Внутривенное введение Внутрь | С | |
| Сульфаметоксазол /триметоприм | Внутривенное введение Внутрь | А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь | В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь | С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь | А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь | А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь | А | |
| Хлоргексидин | Наружное применение | — |
Тактика проведения аллоТКМ при ХМЛ.
Таблица 14.
| Фаза ХМЛ | Клиническая ситуация | Линия ИТК | HLA- типирование доноров | Проведение аллоТКМ |
| Хроническая фаза | Неудача ИТК-1 Имматинибом, высокий риск | Вторая линия ИТК | Да | Нет |
| Неудача терапией Нилотинибом или Дазатинибом | Вторая линия ИТК | Да | Да | |
| Неудача 2-х линий ИТК | Третья линия ИТК | Да | Да | |
| Мутация Т315I | Понатиниб или Омацетаксин | Да | Да | |
| Фаза акселерации | ИТК1 | Вторая линия ИТК ± химиотерапия | Да | Да |
| ИТК 1, без достижения оптимального ответа | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Предлеченность ИТК | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Бластный криз | ИТК1 или предлеченность | Индукционная ХТ + ИТК | Да | Да |
Особенности лечения у беременных.
Основная цель — предотвратить прогрессирование заболевания у матери при минимизации воздействия проводимой терапии на плод.
Учитывая, что до 15-й недели беременности превалирует риск развития внутриутробных аномалий при применении ИТК, до этого срока предусмотрено наблюдение без терапии. Применение ИТК должно быть исключено в I триместре в период органогенеза в связи с тератогенным риском. При этом возможны зачатие на фоне приема ИТК и ранняя отмена ИТК сразу же после подтверждения беременности. После 15 нед. беременности органогенез в основном завершен, плацентарный барьер ограничивает воздействие препаратов на плод. При быстром нарастании уровня BCR-ABL1 следует обсудить вопрос о целесообразности начала терапии.
Планирование беременности у женщин с ХФ ХМЛ целесообразно после терапии длительностью 3 года и более при полной клинико-гематологической ремиссии и подтверждении стабильного глубокого МО (МО4–МО4.5) в течение минимум 2 лет наблюдения.
У женщин с ФА ХМЛ в дебюте заболевания, полной клинико-гематологической ремиссией и стабильным глубоким МО длительностью 3 года и более во время терапии планирование беременности возможно с осторожностью, т. к. нет данных по прерыванию терапии ИТК и безопасному наблюдению без лечения при ФА ХМЛ; данный подход является спорным. При бластном кризе (БК) ХМЛ планирование беременности нецелесообразно, учитывая ожидаемую низкую выживаемость, необходимость проведения курсов химиотерапии в сочетании с ИТК или трансплантации аллогенных гемопоэтических стволовых клеток после достижения ремиссии заболевания.
Диагностированный на ранних сроках беременности БК ХМЛ считается показанием к прерыванию беременности, на поздних сроках беременности это показание к досрочному родоразрешению и немедленному началу терапии.
До получения стабильного глубокого МО всем пациенткам, получающим ИТК, рекомендована контрацепция.
Отсутствие воздействия ИТК в период органогенеза в I триместре — наиболее важный фактор благоприятного исхода беременности.
После 15 нед. беременности, в период, когда уже сформирован плацентарный барьер, ограничивающий проникновение препаратов к плоду, возобновление терапии ИТК целесообразно при значительной опухолевой массе с целью предупредить прогрессирование заболевания.
Уровень BCR/ABL1 > 1 % (потеря МО2) считается оптимальным показанием к возобновлению приема ИТК в интересах матери, поскольку при таком объеме опухолевой массы, соответствующем потере полного цитогенетического ответа, возрастает риск развития гематологического рецидива и появления резистентных клонов. Потеря гематологической ремиссии во время беременности служит показанием к терапии ИТК.
Трансфузионная поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней (в фазе бластного криза).
| | Возраст (лет) | | Триггерный уровень Hb (г/л) |
| | | 35-45 | |
| | 25-50 | | 40-50 |
| | 50-70 | | 55 |
| | >70 | | 60 |
Хирургическое вмешательство: при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Дальнейшее ведение см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: