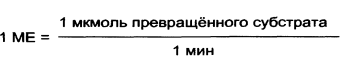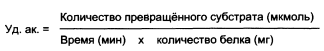что такое международная единица активности фермента ме
Что означает выражение «активность фермента»?
Прежде чем обсуждать свойства ферментов и зависимость ферментов от каких-либо факторов необходимо определиться с понятием активность ферментов.
Таким образом при определении активности ферментов нужно одновременно учитывать три переменные:
Для понимания соотношений указанных факторов наглядным и простым примером может служить строительство двух зданий. Здания приравняем к продукту реакции, рабочие – это ферменты, бригада пусть соответствует объему биологического материала. Итак, задачи из 3-го класса:
1. На постройке одного здания трудилась бригада из 10 человек, другого такого же здания – бригада из 5 человек. Строительство закончено одновременно и в полном объеме. Где выше активность рабочих?
2. На постройке одного здания из 3 этажей трудилась бригада из 10 человек, другого здания из 12 этажей – бригада тоже из 10 человек. Строительство закончено одновременно и в полном объеме. Где выше активность рабочих?
3. На постройке одного здания из 5 этажей трудилась бригада из 10 человек, другого такого же здания – бригада тоже из 10 человек. Строительство первого здания заняло 20 дней, второе построено за 10 дней. Где выше активность рабочих?
Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
В практике обычно используют:
В настоящее время в основном уже применяются единицы активности – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
Принципы количественного определения активности ферментов
2. Необходимо наличие избытка субстрата, чтобы в течение установленного времени работали все имеющиеся в растворе молекулы фермента.
Единицы измерения активности и количества фермента



1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
В практике обычно используют:
Взаиморасчёт этих величин выглядит следующим образом:
1 катал = 1 моль/сек = 60 моль/мин = 60х10 6 мкмоль/мин = 6х10 7 ME
1ME = 1 мкмоль/мин = 1/60 мкмоль/сек = 1/60 мккатал = 16, 67 нкат
Удельная активность фермента численно ровна количеству единиц активности фермента в биологическом образце (МЕ), делённому на массу (мг) белка в этой ткани. Обычно используется для оценки очистки фермента.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
При определении активности ферментов необходимо создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях – оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом. Кроме того необходимо при этом наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
5. От чего зависит активность ферментов?
Международная единица
Несмотря на название, МЕ не является частью международной системы измерения. Количества вещества в 1 МЕ для разных классов веществ — совершенно разные. Единицы действия, ЕД, чаще всего совпадают с МЕ.
Точное определение одной МЕ различается для различных веществ и установлено международным соглашением. Комитет биологической стандартизации при Всемирной организации здравоохранения предоставляет эталонные заготовки определённых веществ, (произвольно) устанавливает количество единиц МЕ содержащихся в них, и определяет биологические процедуры для сравнения других заготовок с эталонными. Целью таких процедур является то, чтобы различные заготовки, имеющие одинаковую биологическую активность, содержали равное количество единиц МЕ.
Для некоторых веществ со временем были установлены массовые эквиваленты одной МЕ, и от измерения в этих единицах иногда отказывались. Однако, единицы МЕ даже в этом случае может оставаться в широком применении из-за удобства. К примеру, витамин E существует в восьми различных формах, отличающихся своей биологической активностью. Вместо точного указания типа и массы витамина в заготовке, иногда удобно просто указать его количество в МЕ. То же относится к другим витаминам, инсулину и т. п.
Массовые эквиваленты 1 МЕ для некоторых классов веществ:
* 1 МЕ витамина A: биологический эквивалент 0,3 мкг ретинола, или 0,6 мкг β-каротина
* 1 МЕ витамина C: 50 мкг аскорбиновой кислоты
* 1 МЕ витамина D: биологический эквивалент 0,025 мкг холе- или эргокальциферола
* 1 МЕ витамина E: биологический эквивалент 2/3 мг d-α-токоферола или 1 мг ацетата dl-α-токоферола
1 МЕ препаратов инсулина: биологический эквивалент 34,7 мкг человеческого инсулина (28,8 МЕ/мг).В документах разных стран обозначение локализовано на язык страны, как и в русском. В английском часто обозначается IU (от International unit), во многих романских языках UI (например, в испанском это от unidad internacional, во французском — от unité internationale, в итальянском — от unità internazionale, в румынском — от unitate internațională), IE в некоторых германских языках (например, в немецком — от internationale Einheit, датцом — от internationale eenheid). Встречаются и другие варианты, например венгерское NE (nemzetközi egység). Чтоб не путать букву «I» с цифрой «1», многие иностранные медицинские организации избегают использования буквы «I», и используют в своих документах для обозначения единицы измерения одну букву U или E (например, «три международных единицы на литр» могут быть записаны как «3 U/L»), в то время как другие предпочитают писать название целиком. Кроме того, практикуются производные единицы измерения, которые тоже записываются по-разному — концентрация ME/мл иногда заменяется на кМЕ/л или кЕ/л (кило-единиц на литр, что ровно то же самое, что единиц на миллилитр), а иногда и с дополнтельными приписками, что ещё сильнее запутывает картину. Например, в результатах специфических алергопроб ImmunoCAP пишут KUA/L, где подразумеватеся запись kUA/l, и индекс A значит что измерение делается аллерген-специфическое.
Параграф 15 ферменты определение, природа, функции
Параграф 15: ФЕРМЕНТЫ (определение, природа, функции, классификация).
См. сначала п.57-59.
Содержание параграфа:
15. 1. ОПРЕДЕЛЕНИЕ ферментов.
15. 2. ФУНКЦИЯ ферментов в организме и ЗНАЧЕНИЕ ферментов для организма.
15. 3. Недостаточная активность ферментов.
Последствия прекращения работы фермента.
Причины недостаточной активности фермента:
15. 4. Избыточная активность ферментов.
Последствия избыточной активности фермента.
Причины избыточной активности фермента:
15. 5. ЕДИНИЦЫ измерения активности ферментов.
15. 6. Химическая ПРИРОДА ферментов.
15. 7. ИСТОЧНИК ферментов в организме (откуда ферменты берутся в организме).
15. 8. Условия синтеза ферментов в клетках.
15. 9. Условия работы ферментов в клетках.
Кратко: в организме есть белки, способные ускорять (то есть катализировать) химические реакции. Эти белки называются ФЕРМЕНТАМИ.
Подробнее: в организме человека происходят превращения одних веществ в другие,
то есть химические реакции.
Многие реакции протекали бы с очень низкой скоростью,
при которой жизнь организма была бы невозможна,
если бы эти химические реакции не ускорялись специальными веществами,
которые называются катализаторами (ускорителями реакций).
Большинство катализаторов организма являются белками (другими словами, имеют белковую природу).
Такие белковые катализаторы (они же каталитические белки) называются ферментами.
15. 1. Определение ферментов. Что называют ферментами?
15. 2. Функция ферментов в организме
и значение ферментов для организма (нормальной активности ферментов).
Ферменты осуществляют КАТАЛИЗ химических реакций в организме.
То есть ферменты ускоряют химические реакции в организме.
В этом значение ферментов для организма.
Ферменты увеличивают скорость реакций в миллиард и более раз (в 105-1014 раз).
Ферменты ускоряют только те реакции, которые протекают и без помощи ферментов хотя бы с очень низкой скоростью.
Если реакция невозможна (не может протекать без катализатора в принципе даже очень медленно),
то и под влиянием фермента она не может ни ускориться, ни начаться.
То есть ферменты только ускоряют реакции, причём ускоряют только возможные реакции (возможные с точки зрения термодинамики).
Значение ферментов для организма в том, что
без работы ферментов в качестве катализаторов жизнь организма невозможна,
так как без участия ферментов большинство реакций организма
протекали бы с крайне низкой скоростью, что несовместимо с жизнью.
Термины:
Вещество, реакцию превращения которого в другое вещество (в продукт реакции) катализирует фермент,
называется СУБСТРАТОМ фермента.
Вещество, которое образуется в результате химической реакции (из субстрата), называется продуктом реакции.
В обратимых реакциях продукт одной реакции является субстратом обратной реакции и наоборот.
15. 3. Недостаточная активность ферментов.
Последствия прекращения работы фермента:
прекращение работы фермента (недостаточная активность фермента)
приводит к резкому снижению скорости реакции данного фермента
(то есть скорости реакции, которую мог бы катализировать этот фермент),
что приводит к накоплению субстрата реакции
и к дефициту продукта реакции.
Накопление ряда субстратов и дефицит ряда продуктов
нарушают жизнедеятельность организма,
могут ухудшать самочувствие, приводить к развитию заболеваний и к смерти.
Например, накопление такого субстрата, как аммиак (в случае прекращения работы ферментов синтеза мочевины),
или дефицит такого продукта, как АТФ (в случае прекращения работы ферментов, катализирующих реакции синтеза АТФ),
приводят к смерти.
Накопление такого субстрата, как фенилаланин (п.68) может привести к развитию олигофрении.
Но если нет субстрата фермента, то не будет проблем и из-за накопления субстрата реакции. При условии, что можно обойтись без продукта реакции.
Причины недостаточной активности молекул фермента:
Кроме того, может быть недостаточным количество молекул фермента (концентрация фермента в клетке).
Причины дефицита молекул фермента:
1. Снижение скорости синтеза (см. далее).
2. Нарушение транспорта молекул данного фермента в нужную часть клетки или из клетки (нарушение секреции).
3. Повышение скорости расщепления данного белка (протеолиза)
или всех белков клетки (например, при разрушении лизосом).
4. Денатурация белков при нагревании, ацидозе и алкалозе, появлении веществ, вызывающих денатурацию белков.
15. 4. Избыточная активность ферментов.
Последствия избыточной активности фермента:
избыточная активность фермента
приводит к повышению скорости реакции данного фермента
(то есть скорости реакции, которую катализирует этот фермент),
что приводит к дефициту субстрата реакции
и к образованию избытка продукта реакции.
Накопление ряда продуктов и дефицит ряда субстратов
нарушают жизнедеятельность организма,
могут ухудшать самочувствие, приводить к развитию заболеваний и к смерти.
Например, накопление такого продукта, как мочевая кислота
(в случае избыточной активности ферментов синтеза мочевой кислоты),
приводят к развитию ПОДАГРЫ, которая может привести к почечной недостаточности.
Но если нет субстрата фермента, то не будет и проблем из-за избытка продукта.
При условии, что можно обойтись без субстрата и продукта.
Причины избыточной активности молекул фермента:
1. МУТАЦИЯ ГЕНА, кодирующего данный фермент, из-за которой данный фермент становится чрезмерно активным;
мутация может быть врождённой из-за влияния мутагенов на организмы родителей
или приобретённой в течение жизни индивида под влиянием мутагенов.
Для коррекции нужна генотерапия, которая в настоящее время пока не развита.
2. Избыток в пище или воде микроэлемента или витамина,
необходимого для работы этого фермента
(эта причина устраняется снижением поступления этих веществ с водой и пищей).
Например, избыток витамина С может привести к неправильному заживлению ран (слишком быстрому рубцеванию ран), так как приводит к чрезмерной активности ферментов синтеза коллагена.
Кроме того, может образоваться избыток молекул фермента
при повышении скорости синтеза данного фермента или
при снижении скорости расщепления данного фермента.
15. 5. Единицы измерения активности ферментов.
Активность ферментов измеряется в том,
какое количество субстрата превратилось за единицу времени (в продукт)
или какое количество продукта образовалось за единицу времени (из субстрата).
(То есть насколько изменилась концентрация субстрата или продукта за единицу времени).
15. 6. Химическая природа ферментов.
15. 7. Источник ферментов в организме
(откуда ферменты берутся в организме).
Как и все белки организма, ферменты образуются в организме
в результате процесса, который называется СИНТЕЗОМ БЕЛКА.
Синтез белка (и ферментов в том числе) протекает только в клетках.
После синтеза ряд белков может секретироваться (выделяться) из клеток во внеклеточную среду
(например, антибактериальный лизоцим, ферменты плазмы крови и т.д.)
15. 8. Условия синтеза ферментов в клетках.
Для синтеза ферментов (как и других белков) требуются:
1) наличие «сырья» в клетке: БЕЛКОВЫХ АМИНОКИСЛОТ всех 20-ти типов,
2) наличие в клетке ГЕНА, кодирующего данный фермент (первичную структуру фермента, порядок соединения аминокислотных остатков в данной молекуле белка),
3) (иногда) наличие в клетке ВИТАМИНОВ И МИКРОЭЛЕМЕНТОВ (ионов металлов и селена),
4) ряд регуляторов синтеза белков (активаторы транскрипции и т.д.),
5) отсутствие ингибиторов синтеза белков (например, дифтерийного токсина),
6) нормальные условия в клетке: температура, рН и т.д.
Чтобы были все 20 типов аминокислот (для синтеза в клетке ферментов и других белков и веществ),
в пище должны присутствовать в нужных количествах незаменимые аминокислоты
в составе белков таких продуктов, как:
молочные, мясо, рыба, яйца, соя и другие бобовые.
Витамины и минералы тоже поступают в организм в основном в составе пищи (кроме этого, некоторое количество витаминов может синтезироваться и поставляться организму человека микрофлорой кишечника,
витамин Д может синтезироваться в коже под действием света, но не входит в состав белков,
дефицит витамина РР может отчасти компенсироваться синтезом коферментов НАД+ и НАДФН из триптофана при его достатке в пище).
Гены должны быть такими, чтобы кодировать
ферменты с нормальной активностью (не слишком высокой и не низкой),
которые могут регулироваться.
Изменение гена (мутация) может привести
к появлению фермента с низкой или чрезмерной активностью,
что может привести к развитию патологии.
Причиной мутации может стать действие мутагенов:
радиации, химических веществ, вирусов.
Поэтому желательно не засорять биосферу мутагенами.
15. 9. Условия работы ферментов в клетках.
1.2.3. Единицы активности ферментов. Методы определения активности ферментов.
Каждый ферментный препарат должен быть охарактеризован по его ферментативной активности. Что такое активность фермента в самом простом понимании?
Это единица количества субстрата, превращенное ферментом, в единицу времени, отнесенное к количеству самого фермента.
Международным биохимическим союзом выработана специальная понятия – стандартная единица фермента (Е) единица на русском или (unit) – на английском.
Стандартная единица фермента – это такое количество фермента, которое катализирует превращение одного микромоля данного субстрата за одну минуту при заданных условиях. Для определения числа стандартных единиц фермента желательно пользоваться t =250, рН оптимум, и Ссубстрат – оптимум.
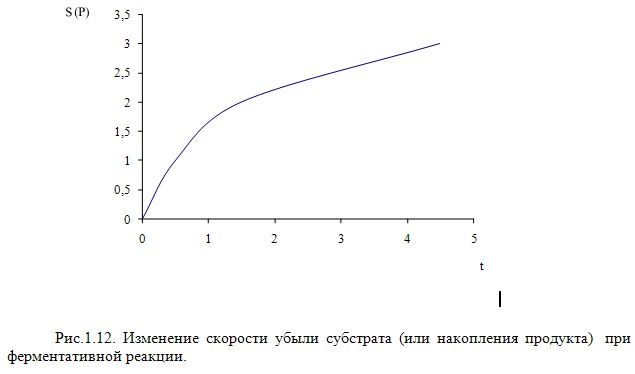
Для определения числа стандартных единиц нужно знать скорость ферментативной реакции. Из курса биохимии вы вероятно знаете что ход ферментативной реакции можно представить в виде графика имеющего вид (Рис.1.12):
Кривая сначала круто поднимается вверх, затем ее подъем замедляется и наконец может замедляется и наконец становится параллельной оси абсцисс. Замедление реакции может вызываться следующими причинами:
1. Так как в принципе каждая ферментативная реакция обратима, то в силу закона действующих масс скорость реакции равное произведению концентрации реагирующих веществ (и образующиеся продукты реакции будут влиять на скорость прямой реакции)
2. В процессе реакции концентрация исходного материала может оказаться ниже насыщающей концентрации и естественно скорость также будет замедляться.
3. Сам фермент во время реакции частично разрушаются и естественно уменьшается скорость реакции
4. Торможение продуктами реакции, даже если реакция необратима.
В связи с выше изложенным, для точного определения скорости ферментативной реакции, измерение нужно проводить в начале реакции, когда количество превращенного субстрата не выше 20% от исходного. В этом случае практически можно избежать действие четырех вышеназванных артефакторов.
Важнейшим условиями правильного определения истиной начальной скорости реакции являются:
— применение таких физических методов, которые дают возможность наблюдать за ходом реакции непрерывно (СФ, электропроводимость и т.д.);
— применение по возможности насыщающих концентрации субстрата (SO);
Зная скорость ферментативной реакции (т.е. активность), можно рассчитать и удельную активность биокатализатора. Удельная активность – это число единиц, отнесенное к одному миллиграмму белка в ферментом препарате.
В энзимологии пользуются также понятием молекулярная активность. Под молекулярной активностью понимают число молекул данного субстрата или эквивалентно затронутых групп, превращаемых за одну минуту одной молекулой фермента при оптимальной концентрации субстрата. Как следует из определения, для вычисления молекулярной активности фермента, нужно знать его молекулярную массу.
Присутствие фермента в исследуемой среде (пробе) можно установить по скорости накопления продуктов данной ферментативной реакции или по скорости исчезновения субстрата. Для этих целей применяются самые разнообразные методы – химические, поляриметрические, хроматографические, спектральные.