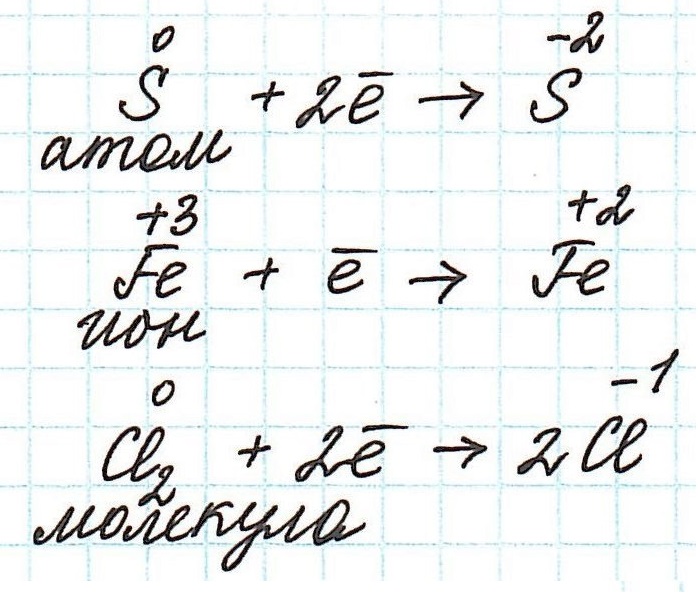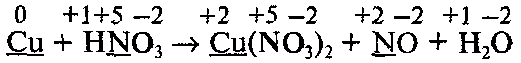что такое мбр без овр
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Переход электронов принято показывать с помощью полуреакций:
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
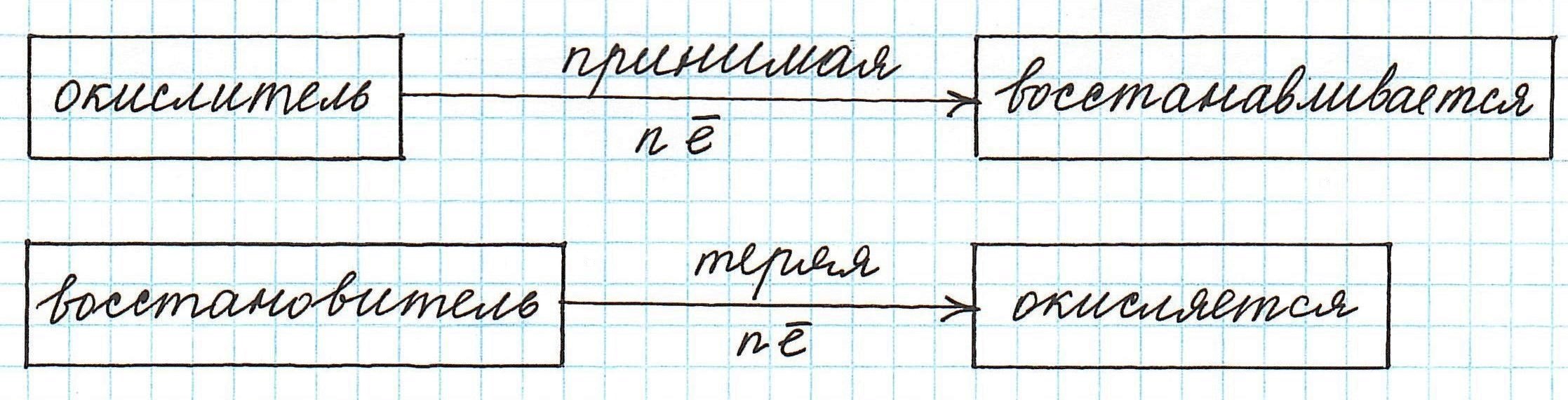
Частица, принимающая электроны, является окислителем.
Восстановление всегда сопровождается уменьшением степени окисления!
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:
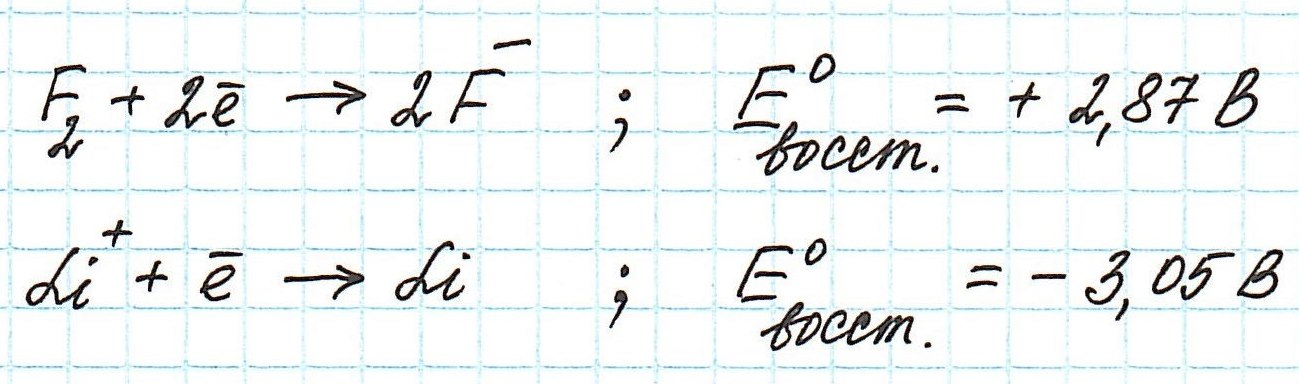
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
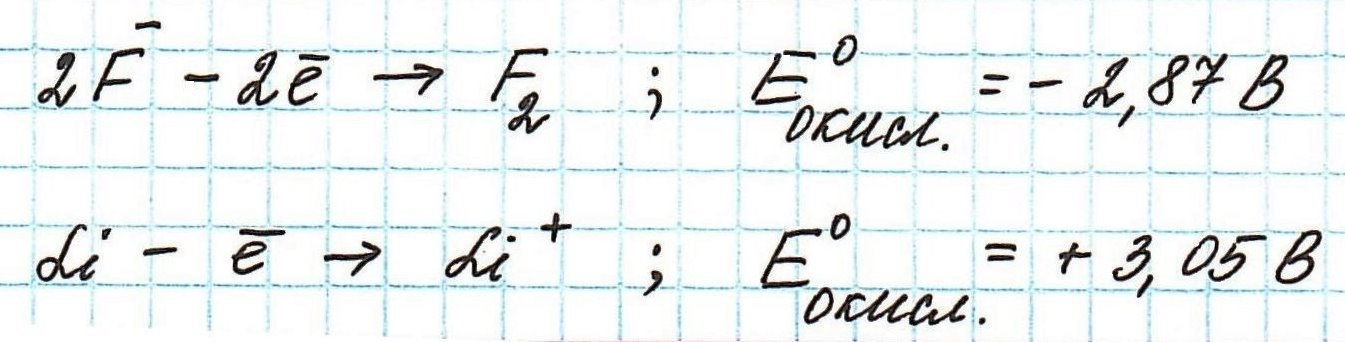
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
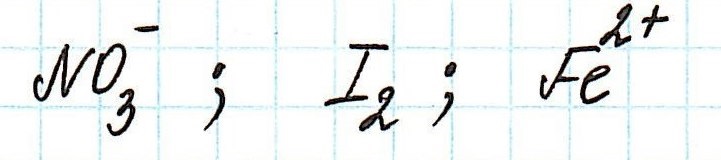
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
Сравним значения восстановительных потенциалов:
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:
Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.
Конверсия МБР в ракеты-носители. Проблемы и перспективы
С шестидесятых годов в нашей стране эксплуатировались ракеты-носители легкого класса, построенные на базе боевых баллистических ракет разных типов. Регулярные пуски таких ракет проводились до недавнего времени, после чего их пришлось приостановить на неопределенный срок в связи с наличием характерных проблем. Однако были приняты необходимые меры, и в ближайшем будущем переделанные МБР вновь смогут отправлять полезную нагрузку на орбиту.
Недавняя история
Первые проекты РН на базе боевых баллистических ракет были реализованы еще в шестидесятых годах. В течение нескольких следующих десятилетий такие комплексы использовались только в интересах военного ведомства. В начале девяностых появилось предложение о коммерческом использовании подобных ракет. За счет этого можно было получить прибыль, а также избавиться от имеющихся МБР, подлежащих уничтожению в соответствии с новыми международными соглашениями.
В ноябре 1990 г. состоялся первый испытательный запуск новой РН «Рокот», разработанной в Центре им. Хруничева при участии украинской компании «Хартрон». Новую ракету выполнили на базе серийного изделия УР-100Н УТТХ путем замены системы управления и доработки ступени полезной нагрузки.
В 1994 г. ракета этого типа впервые вывела на орбиту реальную нагрузку. Годом позже Центр им. Хруничева и европейская компания EADS Astrium создали совместное предприятие Eurockot Launch Services, которому предстояло принимать коммерческие заказы. Первый коммерческий запуск «Рокота» состоялся в мае 2000 г.; последние старты провели в 2019 г. В общей сложности провели 34 полета, включая два испытания и одну аварию. На орбиту вывели почти 80 космических аппаратов, в основном российской разработки.
К концу девяностых годов совместными усилиями российской и украинской промышленности была создана РН «Днепр», базой для которой послужила МБР Р-36М. Проект вновь предусматривал максимально возможное использование готовых компонентов с заменой отдельных систем и адаптацией головной ступени к новой нагрузке.
Эксплуатация новых РН осуществлялась компанией «Космотрас». Первый коммерческий запуск «Днепра» с иностранным спутником состоялся в апреле 1999 г. Регулярные пуски продолжались до марта 2015 г., и к этому времени осуществили 22 запуска. Все, за исключением одного, были успешными. Полезной нагрузкой ракет стало более 140 аппаратов из двух десятков стран.
В 1993 г. состоялся первый запуск легкой РН «Старт». Она была разработана Московским институтом теплотехники на базе МБР из состава комплекса «Тополь». В связи с ограниченными техническими характеристиками такая ракета-носитель не привлекла особого внимания заказчика. С 1993 по 2006 гг. выполнили всего семь запусков, причем один завершился аварийным уничтожением ракеты. Вскоре после проведения последнего запуска проект заморозили ввиду отсутствия реальных перспектив.
В 2003 г. состоялся испытательный пуск ракеты «Стрела». Этот вариант конверсии изделия УР-100Н УТТХ был создан в НПО Машиностроения в сотрудничестве с «Хартроном». Главные отличия от «Рокота» заключались в уменьшении степени переработки исходной конструкции. В частности, в качестве разгонного блока использовали штатную ступень разведения. В 2013-14 гг. «Стрела» совершила два полета с реальной нагрузкой, после чего дальнейшая судьба проекта оказалась под вопросом.
Проблемы сотрудничества
Таким образом, из нескольких предложенных РН на базе МБР лишь две поступили в полноценную эксплуатацию и пользовались успехом среди заказчиков. Однако полеты «Днепра» и «Рокота» завершились несколько лет назад, и с тех пор у нас нет легких ракет-носителей на готовой базе, отличающихся дешевизной и простотой подготовки.
Причины этого просты и связаны с ухудшением международной обстановки. В разработке целого ряда проектов конверсии участвовала украинская промышленность. Так, в проекте «Днепр» были задействованы КБ «Южное» и компания «Хартрон». Последняя также поставляла аппаратуру для изделий «Рокот» и «Стрела».
В 2014-15 гг. новые украинские власти приказали своим предприятиям разорвать сотрудничество с Россией в военно-технической сфере и в области двойных технологий. Это сделало невозможной дальнейшую эксплуатацию «Днепра» и «Стрелы». Проект «Рокот» тоже пострадал, но в меньшей мере, из-за чего пуски продолжались до 2019 г. – до израсходования накопленного запаса агрегатов.
Вторая жизнь «Тополя»
В связи с проблемами РН «Рокот» и «Днепр» российский МИТ предложил возродить свой проект «Старт». Концепт доработанного подвижного грунтового комплекса для запуска нагрузки на орбиту представили на форуме «Армия-2016». В дальнейшем звучали различные заявления об особенностях и перспективах такого проекта.
Утверждалось, что обновленный вариант «Старта» имеет ряд важных преимуществ. На тот момент РВСН запускали процесс снятия с вооружения МБР «Тополь» с заменой более новыми образцами. Это позволяло получать базу для РН «Старт» в достаточных количествах. Кроме того, проект не зависел от недоступных импортных комплектующих. Запуск новых ракет можно было бы производить с космодромов Плесецк и Восточный.
В начале 2019 г. сообщалось, что «Роскосмос» изучает потенциал РН «Старт» и возможность ее использования на Восточном. Осенью того же года Российский фонд прямых инвестиций подписал соглашение с компанией TAQNIA из Саудовской Аравии о совместном проведении работ по новой версии «Старта». Готовую ракету новой модификации планировалось использовать в интересах двух стран. В дальнейшем новости о ходе «Старта» не поступали. Возможно, пока ведется проектирование, и готовый ракетно-космический комплекс представят позже.
Второй «Рокот»
В августе 2018 г. Центр им. Хруничева объявил о начале работ по новой модификации РН «Рокот». От базового изделия она должна отличаться, главным образом, современной системой управления, построенной без украинского участия. Основой ракеты, как и ранее, останется МБР УР-100Н УТТХ – в арсеналах РВСН все еще остается существенное количество таких изделий.
В СМИ появлялись некоторые подробности разрабатываемого проекта. Новую систему управления оценили в 690 млн рублей, а новый разгонный блок в 1,45 млн руб. Общая стоимость разработки достигала 3,4 млрд руб. При этом появлялась возможность провести до 40 запусков к 2028 г. Дальнейшая эксплуатация РН «Рокот-2» остается под вопросом по причине ожидаемого сокращения запаса базовых МБР.
В июне 2020 г. сообщалось о появлении заказа на разработку «Рокота-2» от российского министерства обороны. В марте 2021-го компания Eurockot Launch Services, фактически бездействовавшая несколько последних лет, объявила о скором возобновлении полетов. По ее информации, первый старт РН «Рокот-2» должен состояться во второй половине следующего года, и это будет коммерческий запуск.
Почти сразу Минобороны опровергло эту информацию. Оно сообщило, что модернизация «Рокота» проводится только в интересах российской армии. Новым ракетам предстоит запускать спутники военного назначения, и их коммерческое использование не рассматривается.
Прошлое и будущее
В последние десятилетия ракеты-носители на базе боевых образцов хорошо зарекомендовали себя в качестве надежного и удобного средства вывода нагрузки на орбиту. Начиная с девяностых годов, образцы такого рода позволяли избавляться от более не нужных боевых ракет, причем принося определенный доход.
Легкие ракеты по типу «Рокота» или «Старта» интересны определенному кругу заказчиков и имеют хороший коммерческий потенциал. Но с недавнего времени их производство и эксплуатация оказались невозможными, и потенциальные заказы могут уходить другим подрядчикам. Подобное развитие событий получило должную оценку, и в приемлемые сроки были приняты необходимые меры в виде новых проектов.
Уже в следующем году ожидается первый запуск новой модификации изделия «Рокот». Перспективы улучшенного проекта «Старт» пока остаются неясными, но и поводы для пессимизма отсутствуют. Другие разработки, такие как «Стрела» или «Днепр», похоже, окончательно ушли в историю.
Окислительно-восстановительные реакции (ОВР)
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn +7 + 5ē = Mn +2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:
Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):
В последнюю очередь уравниваем числа атомов водорода и кислорода:
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:
Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:
В заключение уравняем числа атомов водорода и кислорода: