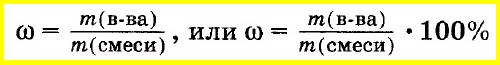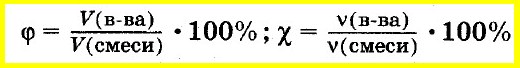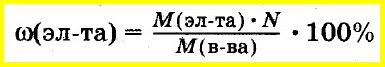что такое массовая доля компонента в смеси
Что такое массовая доля компонента в смеси
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. 25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2. Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3. Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4. В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5. Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Ответ. Dвозд(смеси) = 0,896.
Задача № 7. Найдите массовую долю кислорода в фосфате натрия.
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Ответ. ω (примесей) = 9,12%.
Задача № 10. Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
Лекция 7. Состав смесей жидкостей, паров и газов
1. Массовая доля компонента смеси
2. Молярная доля компонента смеси
3. Объемная доля компонента смеси
Состав смесей жидкостей, паров и газов задают массовыми или мольными долями. Состав газовых смесей дополнительно задают объемными долями компонентов смеси.
Массовой долей компонента смеси называют величину, равную отношению массы данного компонента к массе всей смеси.
Если смесь состоит из нескольких компонентов, например п, то
где w1, w2 … wn – массовые доли компонентов смеси, m1, m2 … mn – индивидуальные массы компонентов смеси, m – масса всей смеси.
Сумма массовых долей компонентов смеси равна единице, т.е.
Например, смесь состоит из азота массой 10 кг, кислорода массой 4 кг и водяного пара массой 6 кг. Для такой смеси m = m1 + m2 + m3= 10 + 4 + 6 = 20 кг
Массовые доли компонентов смеси равны:
кислорода w2 = m2/m = 4 / 20 = 0,2;
Сумма массовых долей компонентов смеси равна:
Молярной (мольной) долей компонента смеси называют величину, равную отношению числа молей компонента смеси к числу молей всей смеси.
Молярная доля компонентасмеси, в состав которой входят n компонентов, определяется по формуле:



где X1, X2 … Xn – молярные доли компонентов смеси, n1, n2 … nn – число молей компонентов смеси, n – число молей всей смеси.
Сумма молярных долей компонентов, составляющих смесь, равна единице:

При решении задач на смеси нередко требуется определить молярный состав смеси, если известны массовые доли компонентов, и, наоборот, определить массовые доли компонентов при известных значениях молярных долей. Найдем эти соотношения для i-го компонента путем деления уравнение (2) на уравнение (3):

Исходя из определения молярной массы вещества, получим:


Уравнения (5) позволяют по известным молярным долям компонентов смеси находить их массовые доли и наоборот.
Найдем выражения для определения молярной массы смеси в случае задания ее компонентов молярными и массовыми долями.
Очевидно, что сумма всех масс компонентов, составляющих смесь, равна массе смеси, т.е.
Подставим в это уравнение выражения для масс из уравнения М=m/n. Получим:
Поделим левую и правую часть последнего уравнения на число молей всей смеси (п)и с учетом соотношения (3) найдем:
Следовательно,молярная масса смеси равна сумме произведений молярных масс компонентов на их мольные доли.
При задании смеси массовыми долями в уравнение:
подставим значение количества вещества из формулы М=m/n. Получим:

откуда молярная масса смеси равна:

Разделив числитель и знаменатель дроби этого уравнения на массу смеси m, найдем:

С учетом того, что m/M=w, окончательно получим:

Следовательно,молярная масса смеси равна единице, деленной на сумму отношений массовых долей компонентов к их молярным массам.
Объемная доля компонента смеси – это отношение объема данного вещества к общему объему смеси.
Если смесь состоит из нескольких компонентов, например п, то
где j1, j2, jn – объемные доли компонентов смеси, V1, V2, Vn – индивидуальные объемы компонентов смеси, V – объем всей смеси.
Сумма объемных долей компонентов смеси равна единице, т.е.
Вопросы для самоконтроля:
1. Что такое массовая доля компонента в смеси?
2. Что такое объемная доля компонента в газовой смеси?
3. Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
4. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки?
5. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
6. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
Концентрация массовая
Концентрация смеси выражает содержание в ней составляющих компонентов. Показатель дает возможность определить содержание конкретного вещества в растворе. Чаще всего используются такие виды концентрации растворов: массовая, объемная, массовые доли, молярная концентрация.
Что такое раствор?
Большинство веществ, которые нас окружают, не являются чистыми. Как правило, это смеси, которые содержат в своем составе несколько компонентов, находящихся в одном или разных состояниях (жидкость, газ, твердое вещество). Смеси, которые имеют однородный состав, называются гомогенными, если состав неоднородный, – гетерогенными. Гомогенные смеси – это растворы, когда одно вещество (растворитель) полностью растворяет другое. Растворитель является компонентом раствора, который в получившейся смеси сохраняет свое состояние, как правило, его количество наибольшее.
Растворы могут быть газовыми, жидкими, твердыми.
Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация раствора выражается через доли вещества, которые входят в его состав.
Массовая концентрация
Показатель характеризует растворенное вещество. Массовая концентрация выражается в граммах, которые содержатся в 100 грамм раствора.
Каждая смесь может содержать разное количество растворителя и растворенного вещества. Если количество второго в отношении растворителя достаточно большое, раствор будет концентрированный, если меньше – слабый.
Концентрация раствора – важная характеристика при его описании. Важно установить, процентное содержание растворенного вещества в полученном растворе. Так, если масса раствора 110 г, масса вещества 10 г, то для расчета его концентрации нужно 10/110х100%. В результате получится, что концентрация раствора составляет около 9,09 процентных единиц.
Используется концентрация растворов, чтобы описать массовую долю вещества, которое в нем растворяется (w), как отношение его массы е общей массе всего раствора. Выражается массовая доля в процентах или долях, как единица безразмерная.
Если раствор имеет массу 200 г, в нем содержится 50 г растворенного вещества, то массовая доля последнего будет составлять 25% или 0,25 доли (50/200=0,25). Также можно рассчитать массовую долю растворителя. Для этого требуется выполнить такие действия: 200-50=150 г, а затем 150/200=0,75. Таким образом, массовая доля растворителя составит 75% или 0,75 долей.
Отсюда следует, что для расчета массовой доли веществ в составе раствора используется следующая формула: w(вещества) = m(вещества)/m(раствора). Зная массовую долю вещества, можно найти его массу по формуле: m(вещества) =w(вещества) х m(раствора).
Сумма массовых концентраций раствора (растворителя включительно) образует его плотность. Если химическое вещество чистое, массовая концентрация такая же, как и его плотность (масса/объем). Отсюда следует, что массовая концентрация компонента в смеси – это его плотность.
Расчеты массовой доли химического соединения в смеси (часть С)
Теория к заданию 34 из ЕГЭ по химии
Расчет массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4. Уравнение примет вид:
Расчет массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
$m(HCl)=36.5$ г/моль$·2$ моль$=73$г.
Расчет массовой или объемной доли выхода продукта реакции от теоретически возможного
Многие химические реакции являются обратимыми, они происходят не до конца, т.е. не происходит полного превращения исходных веществ в конечный продукт. Даже если реакция необратимая, то все равно при ее осуществлении происходит потеря веществ. В результате практически полученное количество продукта реакции составляет только часть от теоретически возможной массы.
Выход продукта реакции от теоретически возможного ($η$) — это отношение массы (объема, количества) реально полученного вещества к его теоретически возможной массе (объему, количеству), которое рассчитывается по уравнению химической реакции:
1) Находим из уравнения реакции теоретическую массу вольфрама:
2) Вычисляем массовую долю выхода вольфрама от теоретически возможного.
2) Определяем массу бензола по уравнению реакции:
2. Определяем количество вещества оксида серы (VI):
1. Записываем уравнение реакции:
Расчет массовой доли (массы) химического соединения в смеси
Самыми распространенными среди расчетных задач в химии являются задачи на смеси веществ. Каждая смесь состоит из двух или более компонентов, состав смесей может изменяться в широких пределах. Решение задач на смеси обычно сводится или к определению состава смеси по данным приведенным в условии задачи, или к расчету количества реагентов или продуктов реакции по участию в смеси известного состава.
Состав смеси может выражаться разными способами:
4) в случае смеси газов можно указать объемы газов, составляющих смесь, или объемные доли этих газов. Объемная доля газа Х в смеси равна:
Определение состава смеси, если все ее компоненты взаимодействуют с данным реагентом
1. Записываем уравнение реакции:
$Mg + 2HCl=MgCl + H_2↑$ (1)
$Fe + 2HCl=FeCl_2 + H_2↑$(2)
3. Из уравнений (1) и (2) определим, что количество водорода, выделившегося в реакциях, равно количеству металлов, вступивших в реакцию:
Определим общее количество водорода:
4. Учитывая равенства (3) и (4), составим уравнение:
5. Определим состав смеси:
2. Определим массы металлов:
1. Запишем реакцию разложения:
2. Определим общее количество кислорода:
$ν(KMnO_4) + ν(NaNO_2)=2·ν(O_2)=2·0.03$ моль$=0.06$ моль.
4. Определим массы веществ:
5. Определим массу смеси.
$158х + 85(0.06-х)=6.6; 73х=1.5; х=0.02$ моль.
6. Определим молярное соотношение исходных компонентов смеси:
Определение состава смеси, если ее компоненты выборочно взаимодействуют с указанными реагентами
1. Запишем уравнение реакции.
Со щелочью взаимодействует только алюминий:
$2Al + 2NaOH + 2H_2O=2NaAlO_2 + 3H_2↑$
Молярное соотношение алюминия и водорода равно 2 : 3.
2.Определим количество водорода:
4. Определим массовую долю алюминия в смеси:
5. Определим массовую долю меди в смеси:
$m$[смеси (аром. угл. + фенол)]
1. С бромной водой в смеси реагирует только фенол:
$C_2H_5OH + 3Br_2→C_6H_2Br_3OH↓ + 3HBr$.
3. Из уравнения реакции:
находим массу фенола:
$m(C_6H_5OH)=ν(C_6H_5OH)·M(C_6H_5OH)=0.1$ моль$·94$ г/моль$=9.4$ г.
$m(С_nН_<2n-6>)=m$(смеси)$-m(C_6H_5OH)=14 г-9.4 г=4.6$ г.
5. Вычислим молярную массу углеводорода:
Приравняем правые части равенств (3) и (4):
7. Определим формулу углеводорода и массовые доли компонентов в смеси.
Формула углеводорода С7Н6.
Определение состава смеси с неизвестной массой
$KOH + HCl=KCl + H_2O$ (1)
$KHCO_3 + HCl=KCl + H_2O + CO_2↑$ (2)
$m(KHCO_3)=ν(KHCO_3)·M(KHCO_3)=0.2$ моль$·100$ г/моль$=20$ г.
$m(KOH)=ν(KOH)·M(KOH)=0.6$ моль$·56$ г/моль$=33.6$ г.
Решение задач на смеси, если их компоненты имеют одинаковые молярные массы
1. Определим суммарное количество моль компонентов смеси:
2. Запишем уравнение реакции:
$CaCO_3 + 2HCl=CaCl_2 + H_2O + CO_2↑$ (1)
$KHCO_3 + HCl=KCl + H_2O + CO_2↑$ (2).
$ν(CO_2)=ν(CaCO_3) + ν(KHCO_3)=0.2$ моль.
5. Определим количество вещества карбоната бария:
$ν(BaCO_3)=ν(CO_2)=0.2$ моль (из уравнения (3)).
$m(BaCO_3)=m(BaCO_3)·M(BaCO_3)=0.2$ моль$·197$ г/моль$=39.4$ г.
Презентация на тему «Массовая доля компонента смеси»
Описание презентации по отдельным слайдам:
Массовая доля компонента смеси Подготовила: Третьякова Н.В. учитель химии МБОУ «Кромская СОШ»
Эпиграф к уроку Не позволяй душе лениться, Чтоб в ступе воду не толочь, Душа обязана трудиться И день и ночь, И день и ночь! (М.Заболоцкий).
«Химический элемент, химическая формула, относительная атомная и относительная молекулярная масса, доля компонента». Какой термин показался вам незнакомым?
Тема урока: Массовая доля компонента смеси
Массовая доля обозначается ω – «омега», этой буквой обозначаются разные величины: массовая доля элемента в соединении, массовая доля вещества в растворе, массовая доля вещества в смеси.
Для жидких и твёрдых смесей массовая доля компонента (ω) : Для растворов массовая доля вещества (ω):
Запишем определение: Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе всего раствора.
Из формулы мы можем выразить массу вещества (m в-ва) и массу раствора (m р-ра): m в-ва = ω в-ва * m р-ра m р-ра = m в-ва / ω в-ва
Задача В 300 г морской воды содержится 9г солей. Вычислить массовую долю в этом образце морской воды. Анализируем условие. Что нам известно? Что ищем? Формула? Оформляем задачу в тетради.
Команда 1 Для дезинфекции ран используется 5%-ный раствор марганцовки. Какую массу марганцовки и воды надо взять для приготовления 200г раствора? Команда 2 Если вы любите сладкий чай, то на 1 стакан (250 г воды) добавляете две чайные ложки сахара (по 5 г каждая). Какая массовая доля сахара в чае? Команда 3 В домашней аптечке всегда есть 3%-ный раствор «зеленки». Сколько красителя бриллиантового зеленого надо растворить в спирте, чтобы получить 10,25г «зеленки»?
Задание на дом параграф 24 стр.124-126, (параграф 25 стр. 145-146), №1-2 Придумайте по одной задаче на нахождение массовой доли вещества.
Рефлексия Сегодня на уроке я научилась(ся)… Сегодня на уроке я узнал(а)… Сегодня на уроке я закрепил(а) свои знания… Что ещё я хотел(а) бы узнать…
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Предлагаемая Вашему вниманию презентация «Массовая доля компонента смеси 8 класс», используется для изучения новой темы «Массовая и объёмная доли компонентов смеси (раствора)» в 8 классе. Рассматриваются основные формулы, применяемые для расчетов данного вида, и образцы решения задач. . Массовая и объёмная доли компонентов смеси (раствора). Химия – 8.
Презентация содержит динамическую паузу, рефлексию.
Номер материала: ДБ-338190
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения работает над единым подходом к профилактике девиантного поведения детей
Время чтения: 1 минута
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Попова предложила изменить школьную программу по биологии
Время чтения: 1 минута
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
В Пензенской области запустят проект по снижению административной нагрузки на учителей
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.