что такое манганат в автозвуке
Что такое манганат в автозвуке
СОДЕРЖАНИЕ
Состав
Подготовка
Манганаты натрия и калия обычно получают в лаборатории путем перемешивания эквивалентного перманганата в концентрированном растворе (5–10 М) гидроксида в течение 24 часов или при нагревании.
Диспропорционирование
Использует
Родственные соединения
Манганиты
Содержание
Перманганаты
В присутствии восстановителей могут разлагаться со взрывом.
Манганаты
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Манганиты
Соединения типа марганца V формул Me 2+ MnO3 и Me 2+ 6MnO8, (например, CaMnO3 и Mg6MnO8) являются не манганатами V, а двойными оксидами.
Применение
а) а = 0,567 нм, b = 0,827 нм, с = 0,713 нм, b = 92,6°. б) а = 0,7595 нм. в) Т. пл.
МАНГАНАТЫ, соли марганцовистой кислоты Н2МnО4.
Смотреть что такое МАНГАНАТЫ в других словарях:
МАНГАНАТЫ
соли марганцовистой кислоты (См. Марганцовистая кислота) H2MnO4.
МАНГАНАТЫ
МАНГАНАТЫ
1) Орфографическая запись слова: манганаты2) Ударение в слове: манган`аты3) Деление слова на слоги (перенос слова): манганаты4) Фонетическая транскрипц. смотреть
МАНГАНАТЫ
МАНГАНАТЫ
МАНГАНАТЫ
Ударение в слове: манган`атыУдарение падает на букву: аБезударные гласные в слове: манган`аты
МАНГАНАТЫ
м. мн. ч. manganati m pl
МАНГАНАТЫ
МАНГАНАТЫ
МАНГАНАТЫ
МАНГАНАТЫ
МАНГАНАТЫ
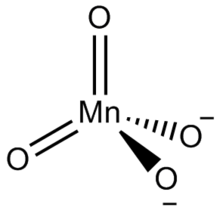
Манганаты — соли нестойких, несуществующих в свободном состоянии кислородных кислот марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO4 3− (гипоманганаты), MnO4 2− (манганаты) и MnO4 − (перманганаты) соответственно.
Содержание
Перманганаты
Перманганаты, манганаты(VII) — соли нестойкой марганцовой кислоты HMnO4, известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты. Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты. При умеренном нагревании разлагаются до манганатов(VI), например:
В присутствии восстановителей могут разлагаться со взрывом.
Манганаты
Манганаты VI — соли нестойкой марганцоватой кислоты H2MnO4, в кристаллическом состоянии известны только для щелочных металлов и бария. Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO2 и манганатов V.
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Гипоманганаты, манганаты V — соли нестойкой марганцоватистой кислоты H3MnO4, в кристаллическом состоянии известны только гипоманганаты лития, натрия, калия и бария. Кристаллы зелёного цвета. В водных растворах диспропорционируют до манганатов VI и диоксида марганца:
Манганиты
Соединения типа марганца IV формул Me 2+ MnO3 и Me 2+ 6MnO8, (например, CaMnO3 и Mg6MnO8) являются не манганатами IV, а двойными оксидами.
Применение
Наибольшее значение имеет перманганат калия, используемый как дезинфицирующее средство, при водоподготовке, в аналитической химии (редокс-титрование), органическом синтезе (окислитель). Манганаты бария используются в качестве пигментов (BaMnO4 — касселева зелень, используемая в фресковой живописи, Ba(MnO4)2 — в качестве голубого пигмента).
Манганаты
Мангана́ты — соли нестойких, несуществующих в свободном состоянии кислородных кислот марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO4 3− (гипоманганаты), MnO4 2− (манганаты) и MnO4 − (перманганаты) соответственно.
Содержание
Перманганаты
Перманганаты, манганаты VII — соли нестойкой марганцовой кислоты HMnO4, известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты. Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты, при умеренном нагревании разлагаются до манганатов VI, например:
2KMnO4 
В присутствии восстановителей могут разлагаться со взрывом.
Манганаты
Манганаты VI — соли нестойкой марганцоватой кислоты H2MnO4, в кристаллическом состоянии известны только для щелочных металлов и бария. Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO2 и манганатов V.
3H2MnO4 
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Гипоманганаты, манганаты V — соли нестойкой марганцоватистой кислоты H3MnO4, в кристаллическом состоянии известны только гипоманганаты лития, натрия, калия и бария. Кристаллы зелёного цвета. В водных растворах диспропорционируют до манганатов VI и диоксида марганца:
2H3MnO4 
Манганиты
Соединения типа марганца IV формул Me 2+ MnO3 и Me 2+ 6MnO8, (например, CaMnO3 и Mg6MnO8) являются не манганатами IV, а двойными оксидами.
Применение
Наибольшее значение имеет перманганат калия, используемый как дезинфицирующее средство, при водоподготовке, в аналитической химии (редокс-титрование), органическом синтезе (окислитель). Манганаты бария используются в качестве пигментов (BaMnO4 — касселева зелень, используемая в фресковой живописи, Ba3(MnO4))2 — в качестве голубого пигмента).
ОБЗОР МАНГАНАТА, ТИТАНАТА, Х-БАНОК, АГМ, КИСЛОТЫ. ЛУЧШЕЕ ПИТАНИЕ ДЛЯ АВТОЗВУКА. ЧЕСТНЫЙ ОБЗОР.
Показувати елементи керування програвачем
Аккумуляторы любезно предоставил магазин АКББЕСТ akbbest_nvrsk
Наш Инстаграм bassteamnvrsk
КОМЕНТАРІ • 10
Здравствуйте, манганат можно поставить в замен штатного акб? Если нет то как сделать?
Хороший информативный тест. Посмотрел с удовольствием.
Ну так тесты не делают. CSB разряженный. Новая кислота и EFB требуют циклов разряда и заряда, прежде чем тестить. Титанат недозаряжен и непонятно как собран, если там шайбы стоят, то просад будет больше, и не ясно что там с клеммами, там гайки длинные стоят?)
Манганат тоже недозаряжен, но его напряжение и не подходит для автозвука, 16,8В полный заряд, но в данном случае 15,3В адекватный заряд.
В общем, тест не дал объективного сравнения, исправляйте недочёты или пришлите мне на тест эти аккумы, сделаю всё максимально объективно
@POWER BATTERIES скажи по цене титанат 10к секция а манганат 10к 2 секции что взять? Твоя объективная точка зрения
Нет, я не делал тест манганата, так как не вижу в нём замены титанату. Манганат совсем плохо себя чувствует в мороз, относительно маленький срок службы, люто горит.
Про напряжение это не я придумал, это особенность этой химии, пакеты по 4.2В полностью заряженные, 4 пакета в последовательно это 16,8В. Поэтому он не совсем подходит для автозвука, хотя с 15,2В можно использовать, не используя всю ёмкость
Манганаты
Мангана́ты — соли нестойких, несуществующих в свободном состоянии кислородных кислот марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO4 3− (гипоманганаты), MnO4 2− (манганаты) и MnO4 − (перманганаты) соответственно.
Содержание
Перманганаты
Перманганаты, манганаты VII — соли нестойкой марганцовой кислоты HMnO4, известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты. Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты, при умеренном нагревании разлагаются до манганатов VI, например:
2KMnO4 
В присутствии восстановителей могут разлагаться со взрывом.
Манганаты
Манганаты VI — соли нестойкой марганцоватой кислоты H2MnO4, в кристаллическом состоянии известны только для щелочных металлов и бария. Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO2 и манганатов V.
3H2MnO4 
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Гипоманганаты, манганаты V — соли нестойкой марганцоватистой кислоты H3MnO4, в кристаллическом состоянии известны только гипоманганаты лития, натрия, калия и бария. Кристаллы зелёного цвета. В водных растворах диспропорционируют до манганатов VI и диоксида марганца:
2H3MnO4 
Манганиты
Соединения типа марганца IV формул Me 2+ MnO3 и Me 2+ 6MnO8, (например, CaMnO3 и Mg6MnO8) являются не манганатами IV, а двойными оксидами.
Применение
Наибольшее значение имеет перманганат калия, используемый как дезинфицирующее средство, при водоподготовке, в аналитической химии (редокс-титрование), органическом синтезе (окислитель). Манганаты бария используются в качестве пигментов (BaMnO4 — касселева зелень, используемая в фресковой живописи, Ba3(MnO4))2 — в качестве голубого пигмента).
Манганаты
Мангана́ты — соли нестойких, несуществующих в свободном состоянии кислородных кислот марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO4 3− (гипоманганаты), MnO4 2− (манганаты) и MnO4 − (перманганаты) соответственно.
Содержание
Перманганаты
Перманганаты, манганаты VII — соли нестойкой марганцовой кислоты HMnO4, известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты. Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты, при умеренном нагревании разлагаются до манганатов VI, например:
2KMnO4 
В присутствии восстановителей могут разлагаться со взрывом.
Манганаты
Манганаты VI — соли нестойкой марганцоватой кислоты H2MnO4, в кристаллическом состоянии известны только для щелочных металлов и бария. Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO2 и манганатов V.
3H2MnO4 
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Гипоманганаты, манганаты V — соли нестойкой марганцоватистой кислоты H3MnO4, в кристаллическом состоянии известны только гипоманганаты лития, натрия, калия и бария. Кристаллы зелёного цвета. В водных растворах диспропорционируют до манганатов VI и диоксида марганца:
2H3MnO4 
Манганиты
Соединения типа марганца IV формул Me 2+ MnO3 и Me 2+ 6MnO8, (например, CaMnO3 и Mg6MnO8) являются не манганатами IV, а двойными оксидами.
Применение
Наибольшее значение имеет перманганат калия, используемый как дезинфицирующее средство, при водоподготовке, в аналитической химии (редокс-титрование), органическом синтезе (окислитель). Манганаты бария используются в качестве пигментов (BaMnO4 — касселева зелень, используемая в фресковой живописи, Ba3(MnO4))2 — в качестве голубого пигмента).