что такое лимфоваскулярная и периневральная инвазия
Что такое лимфоваскулярная и периневральная инвазия
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Что такое лимфоваскулярная и периневральная инвазия
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Что такое лимфоваскулярная и периневральная инвазия
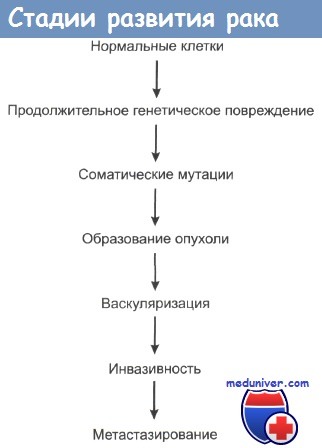
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
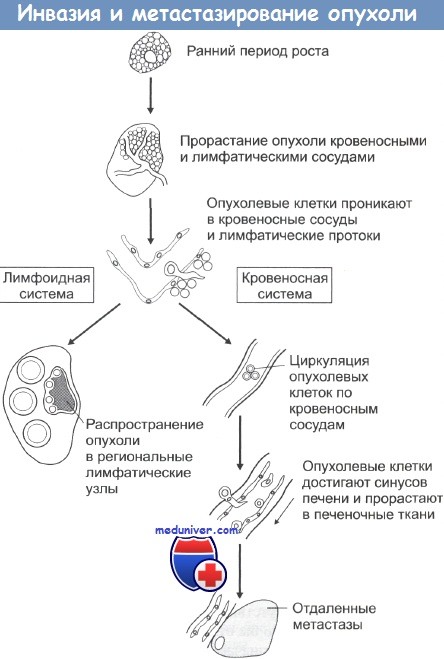
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое лимфоваскулярная и периневральная инвазия
В последние годы взгляд на объем хирургического вмешательства при первичных операбельных опухолях изменился. Радикальная мастэктомия была стандартной процедурой, с тех пор как Холстед опубликовал первую серию своих работ в 1894 г. Его концепция удаления единым блоком первичной опухоли вместе с подмышечными лимфоузлами была признана во всем мире. Этот метод лечения преобладал в течение приблизительно 50 лет, несмотря па недостаточно высокие показатели эффективности.
В дальнейшем неудовлетворенность стандартной радикальной мастэктомией усиливалась, и в последние два десятилетия возросла тенденция к менее радикальным хирургическим вмешательствам.
В 1992 г. American Colleges of Surgeons, Radiologists and Pathologist вместе с ACS и Society of Surgical Oncology начали изучать методики органосохраняющего лечения рака молочной железы (РМЖ). Многие ретроспективные, а также проспективные рандомизированные исследования подтвердили одинаковую эффективность результатов лечения больных с ранним РМЖ с помощью мастэктомии или органосохраняющей операции.
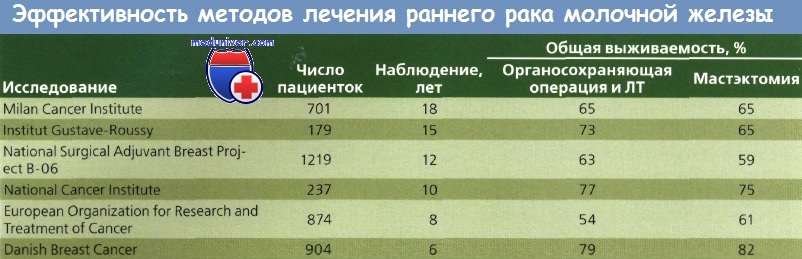
Результаты обсуждений были опубликованы в 1998 г. В 6 современных проспективных рандомизированных исследованиях мастэктомия сравнивалась с органосохраняющим хирургическим вмешательством в комбинации с лучевой терапией (ЛТ) при раке молочной железы (РМЖ) I и II стадий. ЛТ молочной железы (45—50 Гр) применялась во всех 6 исследованиях с бустом на ложе первичной опухоли в 5 из них.
Обязательным условием для органосохраняющей операции и лучевой терапии (ЛТ) было отсутствие опухолевых клеток в краях резекции. На протяжении более 18 лет ни в одном из исследований не обнаружены значимые различия между общей и безрецидивной выживаемостью при двух типах лечения. В исследованиях Milan I и NSABP В-06 у больных с наличием метастазов в лимфоузлах после мастэктомии и XT выживаемость не улучшалась.
В 5 из 6 исследований не было значительных различий в частоте рецидивов в оперированной молочной железе или грудной стенке после мастэктомии. В исследовании NCI отмечен значительно более высокий уровень местного рецидивирования при органосохраняющей лечении, но для включения в исследование требовалась резекция видимой опухоли.
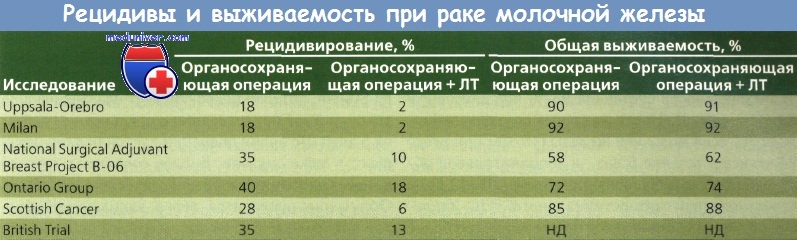
При метаанализе 7 из 9 проспективных рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и ЛТ с мастэктомией, различий в выживаемости выявлено не было. Местное рецидивирование отмечено у 6,2 % больных после мастэктомии и у 5,9 % — после органосохраняющей операции. Различия в частоте рецидивов в противоположной молочной железе или вторичных злокачественных опухолей в оперированной железе не обнаружены.
Частота рецидивов в оперированной молочной железе после лечения колебалось от 3 до 19 %. В большинстве случаев при неэффективности органосохраняющего лечения может применяться мастэктомия, при этом 5-летняя выживаемость составляет 70 %. Мастэктомия не предотвращает местных рецидивов, частота которых может составлять 4 — 14 %.
Было проведено 6 рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и такое же вмешательство в сочетании с ЛТ. Выбор терапии, объем хирургического вмешательства и ЛТ, использование адъювантной системной терапии в разных исследованиях варьировали. Несмотря на различия, общий коэффициент уменьшения частоты рецидивирования в молочной железе составил 84 % (диапазон 73—97 %) после лучевой терапии (ЛТ). Не удалось провести анализ подгруппы больных без эффекта от ЛТ.
Для оптимальной органосохраняющей операции на молочной железе необходим тщательный отбор больных, осуществляемый бригадой специалистов разного профиля. Выбор метода лечения должен основываться на данных анамнеза, физикального исследования, маммографии, гистологической оценке биоптата молочной железы и пожеланиях пациентки. Возраст (ни молодой, ни пожилой) не может быть противопоказанием к сохранению молочной железы. Втяжение кожи, соска или молочной железы может и не быть признаком локального прогрессирующего РМЖ и необязательно служит противопоказанием к сохранению молочной железы.
Для уточнения возможности проведения органосохраняющей операции необходимо предоперационное маммографическое исследование. Должно использоваться высококачественное, сертифицированное, специализированное маммографическое оборудование, определяющее объем поражения и возможное наличие нескольких очагов. Необходимо провести двустороннюю маммографию. При непальпируемых образованиях и микрокальцификатах органосохраняющие операции выполняются все чаще. Размер патологических очагов (по крайней мере, двух) должен быть указан.
Кожу молочной железы над опухолью нужно обследовать на предмет утолщения, по которому можно предположить поражение ее раком. Если есть микрокальци-фикаты, необходимо определить их протяженность в пределах или вне образования, описать их расположение и распределение, особенно если они — единственный признак опухоли.
Необходимо оценить различные патологические находки, которые могут быть факторами риска рецидива рака молочной железы (РМЖ). Инвазия в кровеносные или лимфатические сосуды, некроз опухоли и воспалительный инфильтрат повышают риск рецидивирования (10—15 % в течение 5 лет). У больных с метастазами в лимфоузлах нет повышенного риска рецидивирования РМЖ после органосохраняющей операции и ЛТ; однако у больных после мастэктомии число метастазов в лимфоузлах коррелирует с частотой рецидивирования опухоли в грудной стенке.
Более низкая частота рецидивирования при органосохраняющей операции и облучении может быть следствием комбинированного эффекта XT и тамоксифена. Крупный внутрипротоковый очаг может быть связан с высоким риском рецидивирования. Риск может быть увеличен при наличии значительной остаточной опухоли после удаления видимых очагов. Риск рецидивирования у этих больных уменьшается при отсутствии опухолевых клеток в краях резекции. По-видимому, крупный внутрипротоковый очаг служит показателем того, что заболевание более тяжелое, чем предполагалось до операции.
При наличии опухолевых клеток в краях резекции следует расширить объем операции. В случае повторного обнаружения опухолевых клеток наиболее целесообразно провести мастэктомию. Gage и соавт. показали различную частоту рецидивирования опухоли в течение 5 лет после резекции: 3 % при отсутствии опухолевых клеток в краях резекции, 9 % при наличии отдельных опухолевых клеток и 28 % при наличии опухолевых клеток по всей линии резекции.
Последние данные подтверждают, что системная терапия может уменьшить 5-летний уровень рецидивирования рака молочной железы (РМЖ) у пациенток с наличием опухолевых клеток в краях резекции. Состояние краев резекции — вероятно, самый важный аспект гистологической оценки операционного материала, если изначально планировалась орга-носохраняющая операция.
LCIS — это случайная находка (в противоположность DCIS); он считается маркером повышенного риска рака молочной железы (РМЖ) в будущем, но не служит показанием для расширения объема операции при наличии опухолевых клеток в краях резекции. Повышенный риск относится к обеим молочным железам и остается па протяжении жизни.
Очевидно, что есть как абсолютные, так и относительные противопоказания к органосохраняющим операциям и лучевой терапии (ЛТ). Беременность считается абсолютным противопоказанием к ЛТ. Альтернативой может быть послеродовая ЛТ, что зависит от срока беременности во время установления диагноза. Женщины с двумя или более первичными опухолями в разных квадрантах либо с диффузными характерными микрокальцификатами не рассматриваются как возможные кандидатки для органосохраняющего хирургического вмешательства. Наличие опухолевых клеток в краях резекции после расширения объема операции, а также предшествующая ЛТ молочной железы служат абсолютным противопоказанием к органосохраняющей операции.
Относительными противопоказаниями могут быть коллагенозы в анамнезе (склеродермия или системная красная волчанка), т. к. эти больные плохо переносят ЛТ. Ревматоидный артрит не считается противопоказанием. Размер опухоли не есть абсолютное противопоказание, хотя крупная опухоль в небольшой молочной железе, адекватная резекция которой может привести к косметическому дефекту, может быть относительным противопоказанием. Семейный РМЖ не влияет на выживаемость.
Тенденции проведения менее радикальных операций появились после введения метода удаления молочной железы и подмышечных лимфоузлов без грудных мышц. Было показано, что простая мастэктомия с последующей ЛТ приводит к таким же результатам выживаемости, как и радикальная мастэктомия. В настоящее время проходит много рандомизированных исследований, но ограничения этического и юридического характера затрудняют получение значительного количества данных. В большинстве исследований графики выживаемости сравнивались с исследованиями, основанными на радикальной мастэктомии по Холстеду.
Важно, что все менее травматичные процедуры приводят к подобным конечным результатам, но ни один не превзошел результаты, полученные при радикальной мастэктомии. Соответственно, многие сторонники радикальной мастэктомия по Холстеду будут продолжать применять этот метод до появления альтернативы, при которой 10-летняя выживаемость будет лучше.
В некоторых исследованиях продемонстрированы благоприятные результаты органосохраняющего лечения рака молочной железы (РМЖ), но не всем больным показан этот метод, заключающийся в минимальном хирургическом вмешательстве и послеоперационной ЛТ. Hellman описал 255 больных РМЖ I и II стадий, получающих такое лечение. У 97 % женщин с I стадией заболевания и 87 % — со II стадией проведена резекция опухоли. Частота выживаемости составила 93 % при I стадии и 84 % — при II.
После удаления опухоли проводили лучевую терапию (ЛТ) всей молочной железы (45—50 Гр), всего 23 сеанса в течение 5 нед., и дополнительное облучение области первичной опухоли (20—22 Гр) с использованием интерстициального 192Ir. Удаление опухоли рекомендуется при ее диаметре более 2 см. Послеоперационная ЛТ предположительно должна приводить к 80—85%-й частоте локального контроля со сравнимой выживаемостью.
Montague описал 1073 пациентки с благоприятным результатом лечения рака молочной железы (РМЖ), получавших лечение в M.D. Anderson Hospital между 1955 и 1980 г. У 355 больных этой группы проведено органосохраняющее хирургическое вмешательство и ЛТ, а у 728 — только радикальная или модифицированная радикальная операция. Частота местного регионарного рецидивирования при органосохраняющей операции составила 4,9 %, после радикальной или модифицированной радикальной мастэктомии — 5,6 %. В целом значимых различий в уровне безрецидивной выживаемости в течение 10 лет в двух группах не обнаружено.
Хотя это исследование не было рандомизированным, его результаты согласуются с данными других исследований.
Lichter и соавт. из NCI сообщили о рандомизированном исследовании, проведенном в 1992 г., в котором мастэктомия сравнивалась с органосохраняющей операцией при РМЖ I и II стадий. 237 женщин были разделены на две группы: в одной проведена мастэктомия, в другой — эксцизионная биопсия опухоли и ЛТ. Всем женщинам в обеих группах выполнена полная подмышечная лимфодиссекция; больные с метастазами в лимфоузлах в обеих группах дополнительно получали циклофосфамид и доксорубицин каждые 28 дней в течение 1 года и тамоксифен 40 мг/сут в течение 5 лет.
Общая и безрецидивная выживаемость при двух видах лечения значительно не отличались. Авторы также суммировали результаты 6 крупных проспективных рандомизированных исследований с участием более 3800 пациенток, в которых сравнивали мастэктомию и лампэктомию в комбинации с ЛТ при лечении РМЖ I и II стадий. В результате этих исследований были сделаны такие же выводы в отношении безрецидивной выживаемости. Таким образом, врачи могут теперь смело рекомендовать лампэктомию в сочетании с ЛТ больным РМЖ I и II стадий, т. к. этот метод лечения оказался эквивалентным мастэктомии по выживаемости и оптимальному локальному и регионарному контролю.
В мае 2002 г. Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) одобрило MammoSite Radiation Therapy System, которая подразумевает назначение внутриполостной брахитерапии в предписанных дозах на 5 дней. Во время операции пустой баллон помещают в ложе опухоли. Баллон соединен с трубкой и может наполняться физиологическим раствором. Облучение проводится через наполненный баллон в течение 1—5 дней, затем баллон опорожняют и извлекают. Время ЛТ сократилось с традиционных 6 нед. до 5 дней. Эта технология находится в стадии разработки, и критерии включения больных для этого метода ЛТ пока изучаются.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021