что такое кортико медуллярная дифференциация почки
Узи почек: норма и расшифровка результатов
Ультразвуковое исследование почек в большинстве случаев является полноценным и достаточно информативным методом диагностики с целью определения заболевания и назначения адекватного лечения, а так же исключения патологии при скрининговых обследованиях.
Что показывает УЗИ почек?
При ультразвуковом исследовании почек УЗИ-аппарат позволяет определить следующие основные параметры:
Количество
В норме почки являются парным органом, но встречаются аномалии.
Возможно врожденное отсутствие почки – односторонняя аплазия (агенезия), либо утрата парности в результате хирургического удаления. Встречается врожденное удвоение почки, чаще одностороннее.
Аплазия левой почки
Удвоенная почка без признаков обструкции
Расположение
В норме почки расположены на разных уровнях относительно друг друга: правая (D) почка находится на уровне позвонков 12 грудного и 2 поясничного, левая (L) почка – на уровне позвонков 11 грудного и 1 поясничного.
На УЗИ можно выявить опущение почки (нефроптоз) или нетипичную локализацию органа (дистопия), вплоть до расположения в малом тазу.
В норме почка имеет бобовидную форму и ровный наружный контур с четкой визуализацией фиброзной капсулы в виде гиперэхогенной линии.
Размеры
Физиологической норме у взрослого человека соответствуют размеры почек:
Толщина слоя паренхимы – еще один очень важный параметр, в норме составляет 18-25 мм. Этот показатель зависит от возраста пациента: у пожилых людей он может уменьшаться до 11 мм в результате склеротических изменений. Паренхима является функциональной частью почки, в ней расположены структурно-функциональные единицы – нефроны. Увеличение показателя может быть признаком отека или воспаления почки, уменьшение свидетельствует о дистрофии органа.
У детей размеры почек зависят от возраста и роста ребенка. При росте до 80 см измеряются только два параметра – длина и ширина органа. У детей ростом 100 см и выше измеряется и толщина паренхимы.
В норме должна четко выявляться граница почечных пирамидок в паренхиматозном слое: эхогенность пирамидок ниже, чем паренхимы. При гидронефрозе дифференциация между ними отсутствует.
Увеличение размеров почки характерно для острого пиело- или гломерулонефрита, а так же если почка утратила парность и испытывает повышенную функциональную нагрузку.
Эхогенность паренхимы
Этот показатель определяет состояние почечной паренхимы, ее структуру. В норме она однородна.
Эхогенность – это степень интенсивности отражения звуковой волны от тканей: чем плотнее ткань, тем интенсивнее отражение и светлее изображение на мониторе. Ткани с низкой плотностью имеют слабую эхогенность и визуализируются темными участками. Жидкости и воздух анэхогенны.
К примеру, полостную кисту, содержащую жидкость, специалист описывает как анэхогенное образование. Гиперэхогенность характерна для склеротических процессов в почке (гломерулонефрит, диабетическая нефропатия, опухоли, амилоидоз).
Состояние полостной системы почек
Полостная система почек или чашечно-лоханочная система (ЧСЛ) выполняет функцию сбора мочи. На УЗИ могут диагностироваться следующие изменения:
Ультразвуковое изображение расширения полостных систем обеих почек у плода
В норме ЧЛС анэхогенна и не визуализируется. Камни размером 4-5 мм и более в УЗИ-заключении описываются как эхотень, гиперэхогенное включение, эхогенное образование. Наличие песка обозначается как микрокалькулез почек.
Состояние почечного кровотока
Для визуализации почечных кровеносных сосудов используют дуплексное сканирование (или допплерографию), при котором УЗИ-сканер выдает информацию в виде цветного изображения или спектрального графика. Методика является неинвазивной и безболезненной.
Исследование позволяет определить состояние сосудистой стенки, наличие внутрисосудистых обструкций и стенозов, определить скорость кровотока. В норме скорость может колебаться от 50 до 150 см/сек.
На цветовой схеме нормальными считаются темные тона. Яркий цвет фиксирует ускоренный кровоток и свидетельствует о наличии стеноза, основным признаком которого считается усиление кровотока в почечной артерии больше 200 см/сек.
Определяется индекс сопротивления кровотока или индекс резистентности, который напрямую зависит от возраста пациента: чем старше, тем выше скорость кровотока и выше индекс. В норме индекс сопротивления для почечной артерии – 0,7, для междолевых артерий – 0,34-0,74.
Кто проводит расшифровку результатов?
Расшифровку ультразвукового исследования почек должен проводить врач-уролог. К словесному заключению обычно прилагается фото УЗИ или сонограмма, где стрелками отмечается место выявленных патологических изменений.
При обнаружении опухолей или сосудистых изменений неплохо, если будет прилагаться видео УЗИ.
Какие заболевания выявляет УЗИ почек?
Ультразвуковая диагностика наиболее информативна относительно следующих почечных заболеваний и синдромов:
Если в заключении УЗИ почек значится «выраженный пневматоз кишечника», это означает неинформативность обследования по причине метеоризма и в этом случае УЗИ придется повторить после подготовки (употребление ветрогонных препаратов).
Видео:
УЗ анатомия почек
Порядок выполнения: ультразвуковое исследование почек
Подготовка к УЗИ почек
Услуги
МСКТ в диагностике опухолевых заболеваний почек
Преимущества МСКТ почек:
Методика исследования
КТ- анатомия почек (кортико-медуллярная или артериальная фаза)
Максимальное контрастирование коркового вещества почек и почечных столбов, почечных артерий, возможно почечных вен, для диагностики гиперваскулярных опухолей почек)
КТ- анатомия почек (артериальная фаза, КТ-ангиография)
КТ-ангиография позволяет оценить анатомию сосудов почек, что важно при подготовке к нефронощадящей резекции почек.
КТ- анатомия почек (нефрографическая или паренхиматозная фаза)
Максимальный контраст паренхимы почек (корковое и мозговое вещество имеют одинаковый уровень контрастирования), важна для выявления опухолей, их границ)
В экскреторной фазе сканирование может быть выполнено со значительно уменьшенной дозой вследствие высокого контраста между контрастированной ЧЛС и окружающей паренхимой почек
МСКТ является ценным диагностическим методом в распознавании и оценке распространенности опухолей почек, что помогает в определении их резектабельности.
МСКТ с в/в болюсным контрастированием позволяет выявлять опухоли в нефрографическую фазу, проводить дифференциальную диагностику гиперваскулярных форм ПКР в кортико-медуллярную фазу, отсроченная фаза полезна для дифференциальной диагностики опухолей почек от кист высокой плотности.
МСКТ с в/в болюсным контрастированием позволяет достоверно выявлять распространение опухоли в почечные вены и в НПВ, состояние лимфатических узлов (чувствительность 95%), оценивать степень инвазии прилежащих структур.
Диагностическая визуализация твердых опухолей почек
Авторы: Tim J. van Oostenbrugge, Jurgen J. Fütterer, Peter F.A. Muldersa
Вступление
Увеличение использования изображений брюшной полости привело к увеличению числа мелких почечных инциденталом в последние десятилетия. Поскольку до 20% твердых небольших почечных новообразований
Из злокачественных опухолей почек 90% составляют почечно-клеточные карциномы (ПКК). Остальные 10% опухолей почки состоят из метанефрических, нефробластических и мезенхимальных опухолей. Группа мезенхимальных опухолей включает в себя широкий спектр сарком. Также встречаются более редкие опухоли, такие как нейроэндокринные, гемопоэтические, лимфоидные, половых клеток и другие.
В этой статье обсуждаются возможности обнаружения и дифференциации опухолей с помощью ультразвука (УЗИ), компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ).
УЗИ
Когда УЗИ стало доступным для обнаружения почечных новообразований, другие методы визуализации, такие как внутривенная пиелография, постепенно устарели. В настоящее время УЗИ считается возможным вариантом первичной визуализации для скрининга опухолей почек.
Протокол сканирования
Для обычного трансабдоминального серошкольного B-режима УЗИ используется датчик с частотой 3–6 МГц. Пациент находится на спине или в положении на боку, а почки сканируются в продольной и поперечной плоскостях. Когда изображение затеняется кишечным воздухом, можно рассмотреть возможность изменения положения пациента. Задержка дыхания после вдоха может улучшить визуализацию почек.
Обнаружение опухоли
Почечные новообразования распознаются на УЗИ по искажению нормальной структуры тканей. Помимо технических аспектов и состояния организма пациента, эффективность УЗИ при обнаружении опухолей почек зависит от эхогенности, размера и локализации опухоли.
Солидные опухоли почки могут быть категоризированы как полностью солидные, мультифокальные или частично кистозные опухоли. Последние в основном связаны с некрозом. Появление солидных почечных опухолей при УЗИ может варьировать между изоэхогенным, гипоэхогенным и гиперэхогенным по сравнению с нормальной паренхимой почки.
До 77% ПКК ≤30 мм описываются как гиперэхогенные, а остальные являются изоэхогенными или гипоэхогенными по сравнению с нормальной почечной паренхимой и являются более сложными для выявления. До 18% опухолей ≤20 мм и 21% опухолей между 20 и 25 мм не выявляются с помощью УЗИ. В заключение, наиболее сложными опухолями для выявления с использованием УЗИ являются небольшие изоэхогенные опухоли почек, особенно с эндофитным паттерном роста.
Дифференциация подтипов
В нескольких исследованиях изучалась дифференциация подтипов опухолей почек с использованием УЗИ. Несмотря на то, что большинство ПКК
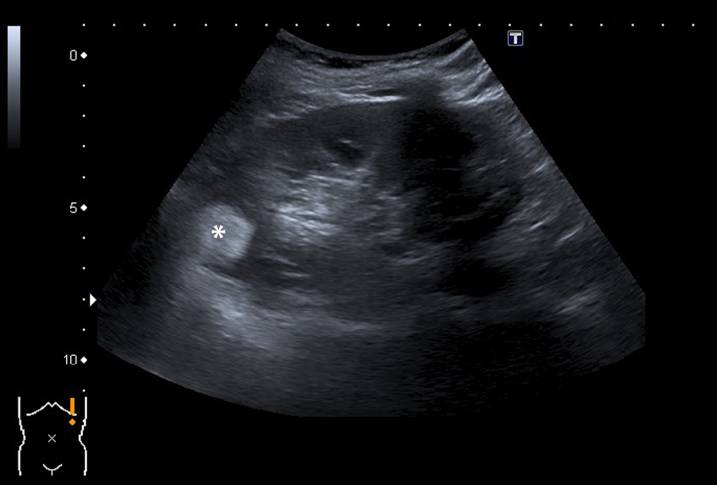
Рисунок 1 : 63-летняя женщина была направлена для наблюдения за ангиомиолипомой, ранее диагностированной на компьютерной томографии. Ультразвук во время наблюдения действительно выявил сильную гиперэхогенную опухоль размером 25 мм (отмеченную звездочкой) в верхнем полюсе левой почки в соответствии с ангиомиолипомой.

Рисунок 2 : 78-летний мужчина прошел УЗИ почек из-за прогрессирующего нарушения функции почек. При ультразвуковом исследовании в среднем / нижнем полюсе левой почки была обнаружена опухоль размером 65 мм (отмечена звездочкой). Опухоль была неоднородной на УЗИ со смешанными изоэхогенными и гиперэхогенными участками.
Другие техники
Сегодня используются дополнительные методы визуализации, чтобы улучшить обнаружение опухолей почки. Цветная допплерография – это метод, в котором эффект допплера используется для визуализации движения жидкостей. Это движение может быть объединено с обычным B-режимом для визуализации кровотока относительно окружающих анатомических структур. Этот метод показал дополнительную ценность в случае изоэхогенных эндофитных опухолей, которые трудно обнаружить при использовании только серошкальных УЗИ. Допплерография может показать сосуды с высокой скоростью кровотока из-за неоваскуляризации.
Было описано, что при опухолях ≤30 мм дополнительное использование допплерографии помогает дифференцировать подтипы на основе паттерна сосудистого распределения, особенно в случае ангиомиолипомы.
CEUS – еще один метод для определения новообразований почек. Этот метод предоставляет информацию о микроциркуляции, в отличие от допплерографии, которая касается макроциркуляции.
Контрастные агенты, используемые для CEUS, не являются нефротоксичными. CEUS более чувствителен при обнаружении гиповаскулярных солидных поражений, не различимых при допплерографии и КТ.
КТ
КТ считается золотым стандартом для характеристики опухолей почек. Из-за своего превосходства над УЗИ и меньшей степенью доступности МРТ КТ часто является первым выбором визуализации для оценки опухоли почки.
Большим преимуществом по сравнению с МРТ является быстрое время сбора данных. Основными ограничениями КТ являются использование ионизирующего излучения и нефротоксичных йодоконтрастных агентов.
Протокол сканирования
Для оптимального выявления и характеристики опухолей почечной коры следует провести КТ с контрастным усилением, состоящую из нерасширенной кортикомедуллярной фазы (25–40 секунд после инъекции) и нефрогенной фазы (100–200 секунд после инъекции).
Минимальная толщина среза для адекватного сканирования составляет 3 мм в сочетании с многоплоскостными реконструкциями.
Обнаружение опухоли
Результаты исследования, касающиеся точности КТ для выявления опухолей почки, основаны на системе оценок, варьирующейся от «определенно не рак» до «определенно солидный рак».
Дифференциация подтипов
Посредством 3-фазной КТ можно выявить большинство опухолей почки, и можно охарактеризовать несколько гистологических подтипов на основе исследований, сравнивающих диагноз КТ с окончательным отчетом по гистопатологии после операции / биопсии.
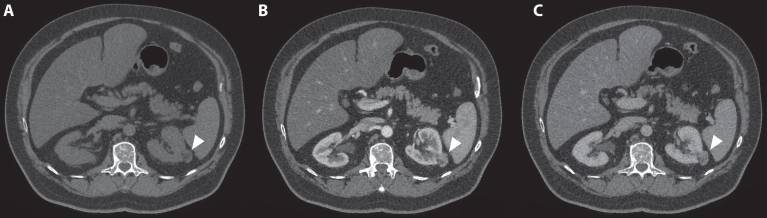
Рисунок 3 : ( A ) В кортикомедуллярной фазе наблюдается усиление опухоли ( B ) с умеренным эффектом вымывания в нефрогенной фазе ( C ).
Кисты. Гомогенное поражение с гладкой стенкой, без перегородок, без кальцификации и затуханием от –10 до +20 HU на не усиленной КТ соответствует простой кисте. Ослабление> 70 HU указывает на геморрагическую кисту. После введения контраста увеличение> 20 HU отмечает опухоль как неопределенную и подозрительную для ПКК.
ПКК. Светлоклеточная ПКК демонстрирует сильное усиление в кортико-медуллярной фазе (в среднем 114 ± 44 HU) из-за гиперваскуляризации и оказывает эффект вымывания во время нефрогенной фазы (в среднем 66 ± 24 HU) (рис. 4).
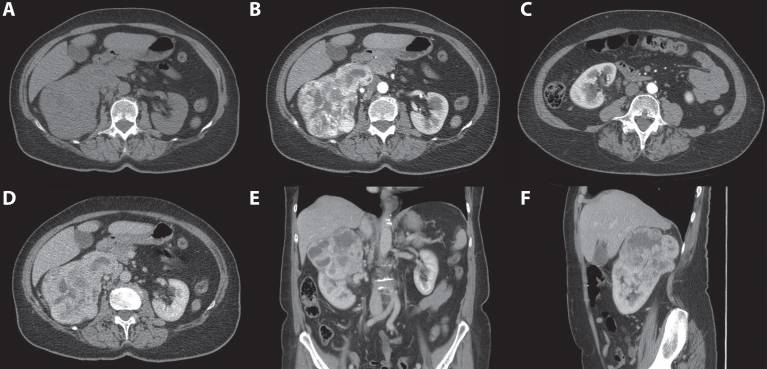
Рисунок 4 : 70-летняя женщина. При скрининговом УЗИ выявлена гиперваскулярная и гиперэхогенная почечная масса правой почки. 3-фазная компьютерная томография показала опухоль, выходящую из верхнего полюса правой почки. ( A ) Сильное усиление твердых частей наблюдается в кортикомедуллярной фазе. ( B ) Нижний полюс правой почки не был затронут. ( C ) В нефрогенной фазе наблюдается явный эффект вымывания.
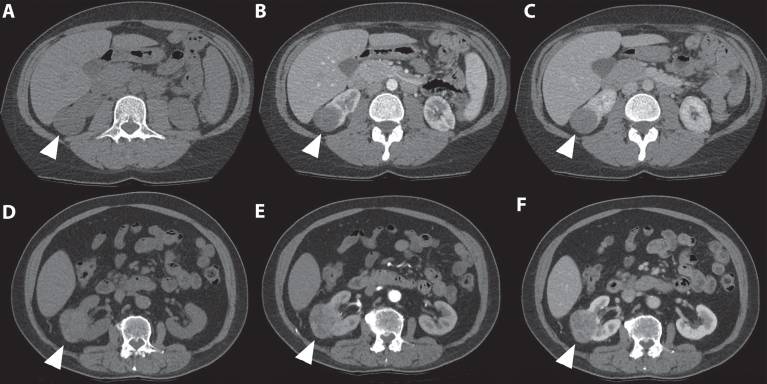
Рисунок 5 : На этом снимке показано различие во внешнем виде и усилении структуры светлоклеточного и папиллярного почечно-клеточного рака. Первый случай ( A-C ) касается 41-летней женщины, направленной на анализ инциденталомы правой почки, обнаруженной при УЗИ. 3-фазная компьютерная томография показала, что опухоль нижнего полюса правой почки размером 36 мм имеет типичное постепенное усиление. Второй случай ( D-F ) касается 67-летнего мужчины, у которого при МРТ позвоночного канала была обнаружена инциденталома в правой почке. Опухоль оценивали с помощью компьютерной томографии, которая показала межполярную опухоль правой почки размером 67 мм.
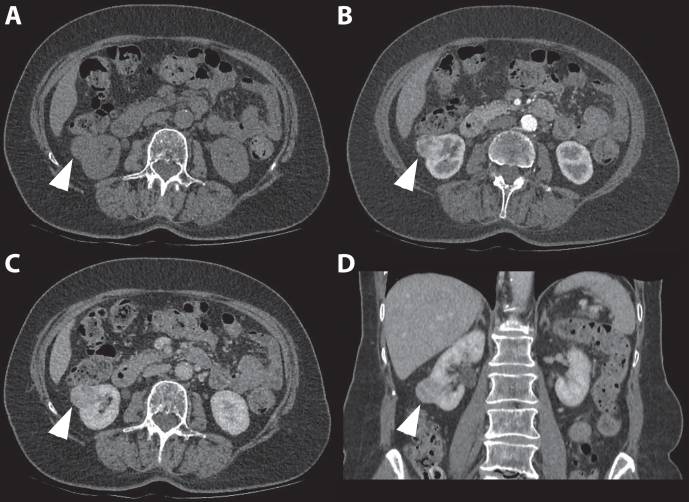
Рисунок 6 : 80-летняя женщина была направлена со случаем инциденталомы правой почки, обнаруженной при УЗИ. Трехфазная компьютерная томография показала изоаттенуирующую экзофитную опухоль почки правого нижнего полюса в неконтрастной фазе. ( A ) Неоднородный характер усиления наблюдается в кортикомедуллярной фазе ( B ) с последующим вымыванием во время нефрогенной фазы ( C и D ).
МРТ
МРТ часто используется в качестве инструмента для определения неоднозначных результатов при УЗИ и КТ. МРТ также часто используется у пациентов, которым противопоказана контрастная КТ из-за нарушения функции почек Ограничениями в использовании МРТ являются длительное время приобретения и несовместимость с металлическими имплантатами, такими как кардиостимуляторы.
Протокол сканирования
Протоколы многопараметрической МРТ для визуализации почек включают динамические последовательности с контрастом и диффузионно-взвешенные последовательности в качестве дополнения к анатомическим изображениям, взвешенным по T1 и T2. Протокол МРТ состоит из анатомической, взвешенной по T1 и по T2 последовательности.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
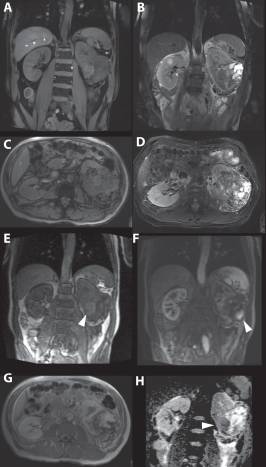
Рисунок 7 : 63-летняя женщина. Магнитно-резонансная томография показала в целом изоинтенсивную опухоль при T1-взвешенной визуализации ( A и C ) и гетерогенную, в основном, интенсивность гипертонического сигнала при T2-взвешенной визуализации ( B и D ), состоящую из смеси опухолевых и кистозных областей и областей с некрозом. Раннее усиление наблюдается в твердых частях опухоли, расположенных более в центре. ( E) В более поздней фазе твердые части периферической опухоли также сильно увеличились. ( F и G ).
Быстропрогрессирующая почечная недостаточность: всегда ли гломерулонефрит?
In medical practice one can often meet patients whose clinical presentation of the disease looks like fast-developing glomerulonephritis, though by its nature this disease is not glomerulonephritis. In this connection vascular renal pathology was considered- thrombotic microangiopathy and its diagnostics.
Начиная с 60–70-х гг. прошлого века случаи стремительно развивающейся почечной недостаточности у больных, исходно не имевших патологии почек, традиционно расценивались как гломерулонефрит с логически вытекающей из этого диагноза попыткой остановить прогрессирование заболевания применением интенсивной иммуносупрессивной терапии. Однако в повседневной практике врача нередко встречаются пациенты, течение болезни у которых напоминает форму быстропрогрессирующего гломерулонефрита (БПГН), хотя по своей сути эта болезнь гломерулонефритом не является. Их отличают некоторые особенности развития заболевания, чаще всего ранняя и трудноконтролируемая артериальная гипертензия (АГ), сочетающаяся с неврологическими нарушениями (головные боли, транзиторные ишемические атаки или острое нарушение мозгового кровообращения в молодом возрасте), рецидивирующими осложнениями беременности у женщин, тромбозами, в том числе необычной локализации. Наследственный анамнез этих больных нередко отягощен по сердечно-сосудистым катастрофам и тромбозам. Другими особенностями, свойственными этим пациентам, можно считать гиперкоагуляционные изменения при исследовании системы гемостаза, иногда с признаками активации внутрисосудистого свертывания крови.
Все это даже при казалось бы типичной клинической картине другого заболевания, например нефрита, позволяет заподозрить у таких больных сосудистую патологию почек, в первую очередь тромботическую микроангиопатию (ТМА), даже при отсутствии микроангиопатической гемолитической анемии и тромбоцитопении.
Тромботическая микроангиопатия (ТМА) представляет собой особый тип поражения мелких внутриорганных сосудов, преимущественно почечных. Характеризуется сочетанием острых тромбозов, отека эндотелиальных клеток с отслойкой от базальной мембраны, утолщения сосудистой стенки с хроническими сосудистыми изменениями, включающими фиброзную гиперплазию интимы, артерио- и артериолосклероз и организующиеся тромбы с реканализацией или без нее, что в конечном итоге приводит к фиброзной окклюзии пораженных сосудов и может вызвать ишемическую атрофию коры почек вследствие нарушений перфузии. Учитывая однотипность гистологических изменений почек при любых заболеваниях, в основе которых лежит ТМА, в большинстве случаев биопсия почки не позволяет дифференцировать формы ТМА друг от друга, несмотря на различия механизмов повреждения, приводящих к микроангиопатическим тромбозам. Однако независимо от того, развивается ли ТМА первично или вторично, центральным звеном патогенеза является повреждение сосудистого эндотелия в органах-мишенях, главным образом в почках. При этом клинические проявления в виде быстро нарастающей почечной недостаточности, тяжелой АГ, выраженной микрогематурии и даже массивной протеинурии не отличаются от таковых при быстропрогрессирующем гломерулонефрите (БПГН) [1].
До недавнего времени были известны практически лишь две формы ТМА — гемолитико-уремический синдром (ГУС) и тромботическая тромбоцитопеническая пурпура (ТТП), не всегда отличимые друг от друга у взрослых пациентов. В 2006 году Besbas и соавт. предложили новую классификацию, в которую вошли все известные на сегодняшний день состояния, ассоциированные с развитием ТМА [2]. В настоящее время выделяют ТМА, ассоциированную с инфекцией, с генетическими или приобретенными нарушениями регуляторных белков системы комплемента (атипичный ГУС) и с дефицитом протеиназы, расщепляющей фактор Виллебранда (ADAMTS-13) (ТТП). ТМА, индуцированная инфекцией, — это, в первую очередь, типичный постдиарейный ГУС, вызванный веротоксин-продуцирующей Еscherichia coli (VTEC) или Shigella dysenteriae I типа, хотя к этой группе можно отнести также ТМА, ассоциированную с инфекцией Citrobacter и Streptococcus pneumoniae. Наряду с упомянутыми формами выделены формы, связанные с ВИЧ-инфекцией, злокачественными опухолями, их химио- и радиотерапией, с лечением ингибиторами кальцийнейрина и трансплантацией органов, беременностью и родами (преэклампсия-эклампсия, HELLP-синдром), злокачественной артериальной гипертензией (АГ), с приемом оральных контрацептивов, развивающиеся при аутоиммунных заболеваниях (системной красной волчанке, склеродермии, антифосфолипидном синдроме). Эти формы, по-видимому, можно считать вторичными, однако пока их патогенез остается неуточненным.
В последние годы получены данные, свидетельствующие о возможности тромботического поражения сосудистого русла почек при наиболее частых генетических формах тромбофилии — лейденской мутации V фактора свертывания крови, мутациях генов протромбина, ингибитора активатора плазминогена I типа (PAI-I) и метилентетрагидрофолатредуктазы (MTHFR) [3, 4]. Так, Т. Raife и соавт. обнаружили, что у пациентов с клиническими и морфологическими признаками ТМА частота выявления мутации фактора V Leiden была достоверно выше по сравнению с контрольной группой. Кроме того, была выявлена тесная связь развития классических форм ТМА — ГУС и ТТП с носительством генотипа Т/Т гена MTHFR C 677 T и генотипа G/G гена, активируемого тромбином ингибитора фибринoлиза (TAFI G505A), в исследованиях Sucker и соавт. [5].
В наших недавних исследованиях было установлено, что ТМА у пациентов с генетическими тромбофилиями, аналогично нефропатии, ассоциированной с антифосфолипидным синдромом (АФС), может развиваться либо как единственная форма поражения почек, либо сочетаться с уже существующей нефропатией, чаще всего хроническим гломерулонефритом (ХГН) [6]. Однако возможности развития этой патологии мало известны практическим врачам. Проиллюстрировать вышесказанное можно следующими примерами из нашей клинической практики.
Больная Д., 34 лет, обратилась в клинику для уточнения диагноза с жалобами на повышение артериального давления (АД) до 160/90–100 мм рт. ст., плохо уступающее приему антигипертензивных средств (ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II (БРА), блокаторы кальциевых каналов, агонисты I1-имидазолиновых рецепторов — рилменидин), отеки, преимущественно голеней.
Из анамнеза: впервые изменения в анализах мочи выявлены в 2004 г., был диагностирован ХГН, в том же году наступившая беременность была прервана по медицинским показаниям на сроке 17–18 недель (документы не сохранились, известно лишь, что почки при УЗИ были нормальных размеров). Иммуносупрессивная терапия не проводилась. Впоследствии, в связи с персистирующим мочевым синдромом, была проведена биопсия почки, получено 14 клубочков, 4 из которых полностью склерозированы, в 5 клубочках в просвете капсулы массивные синехии между капсулой и капиллярными петлями, в большинстве клубочков значительное утолщение базальных мембран клубочков (БМК) и выраженный склероз мезангия, пролиферация мезангиальных клеток, очаговое утолщение и удвоение БМК. Строма вблизи склерозированных клубочков с очаговым фиброзом, лимфоцитарными и макрофагальными инфильтратами. Канальцевая система в очагах фиброза с очаговой деформацией, очаговым сужением и дилатацией — формирующаяся «щитовидная почка». Иммуногистохимическое исследование не проводилось. На светооптическом уровне изменения расценены как мезангиокапиллярный гломерулонефрит (МКГН). В связи с невысоким (0,5 г/л) уровнем протеинурии и стабильно нормальным уровнем АД активная терапия не проводилась.
В 2008 г. — вторая беременность, протекавшая без изменений в анализах мочи со стабильно нормальным уровнем АД, закончившаяся нормальными родами в срок, сын здоров. Сразу после родоразрешения пациентку стали беспокоить сильные головные боли, по поводу которых она обратилась к врачу лишь в 2010 г.: было зарегистрировано повышение АД до 170/120 мм рт. ст., преходящее повышение уровня креатинина крови без значимой протеинурии. Последовательное назначение иАПФ и БРА к нормализации и даже стабилизации АД не привело, БРА были отменены в марте 2011 из-за гиперкалиемии. Назначены амлодипин и релминидин, фуросемид, но стабилизации АД достичь не удалось.
При осмотре 23.06.12 г. обращали на себя внимание сетчатое ливедо на коже конечностей и боковых поверхностей живота, пастозность голеней. При аускультации тоны сердца приглушены, аритмичные, небольшая тахикардия, частота сердечных сокращений (ЧСС) 89 уд./мин, АД 150/100 мм рт. ст. В анализах: стойко высокий (136 г/л), для регистрируемого уровня клубочковой фильтрации, гемоглобин крови, нормальный уровень (4,09 млн/мкл) эритроцитов с нормохромией, гематокрит — 39,5%, лейкоциты — 7,1 тыс./мкл без изменений в формуле, тромбоциты — 204 тыс./мкл, повышение СОЭ до 37 мм/ч. Протеинурия 2,0 г/л, осадок мочи — без особенностей. По данным коагулограммы: D-димер повышен до 1,750 мг/мл (более 3N), волчаночный антикоагулянт не обнаружен. Титр антител к кардиолипину в пределах нормы.
При УЗИ почки уменьшены в размерах: правая — 7,7×3,4×4,0 см, толщина паренхимы 0,9 см, левая — 7,7×4,9×4,0 см, толщина паренхимы 0,9 см. Кортикомедуллярная дифференциация отсутствует. Дифференциация паренхима/почечный синус умеренно снижена. При ультразвуковой ангиографии — обеднение коркового кровотока в режиме цветового допплеровского картирования (ЦДК).
Особенности течения заболевания (быстрое значительное снижение фильтрационной функции почек, связь с беременностью и родами, скудные изменения в анализах мочи с относительно небольшой протеинурией), в сочетании с признаками активации внутрисосудистого свертывания крови (D-димер более 3N) и морфологической картиной почечного биоптата, на светооптическом уровне соответствующей мезангиокапиллярному гломерулонефриту (МКГН), позволили предполагать наличие у пациентки хронической ТМА как причины почечной недостаточности.
Ультразвуковая допплерография (УЗДГ) почечных сосудов, проведенная для уточнения состояния почечного кровотока, выявила снижение пиковых скоростей кровотока в магистральных почечных и интрапаренхиматозных артериях с обеих сторон, свидетельствующее о выраженной ишемии, что косвенно подтверждало высказанное предположение. Мультиспиральная компьютерная томография (МСКТ) почек для уточнения диагноза не проводилась из-за выраженного снижения клубочковой фильтрации до 24,6 мл/мин.
Причина ТМА оставалась неясной, отсутствие анемии и тромбоцитопении позволили исключить ГУС/ТТП. Было высказано предположение о наследственной тромбофилии, с которой могло быть связано микроангиопатическое поражение почек. Для проверки этого предположения выполнено генетическое исследование, выявившее носительство неблагоприятных генотипов, ассоциированных с повышенным риском тромбообразования (гетерозиготные мутации фактора V — лейденская мутация, коагуляционных факторов XII, XIII, гена бета-цепи фибриногена (FGB), MTHFR, PAI-I), что послужило основанием для диагностики мультигенной тромбофилии.
В связи с этим было принято решение о назначении низкомолекулярных гепаринов (НМГ) (фраксипарин 0,3–0,6 мл/сут) на длительный срок под контролем активированного частичного тромбопластинового времени (АЧТВ), D-димера, тромбоцитов крови, суточной протеинурии, биохимических показателей. Для коррекции АГ оставлены рилменидин 2 мг/сут, блокаторы кальциевых каналов под контролем ЧСС, фуросемид.
В первый же месяц лечения АД стабилизировалось на нормальных цифрах с редкими подъемами до 140/100 мм рт. ст., на фоне монотерапии рилменидином в уменьшенной до 1 мг дозе, исчезли отеки. На третьем месяце терапии больная перенесла гипертонический криз с преходящим ухудшением функции почек. К четвертому месяцу от начала лечения отмечались стойкая нормализация функции почек, стабилизация АД на уровне 120–130/80 мм рт. ст. при приеме низких доз антигипертензивных средств, исчезновение протеинурии без применения иммуносупрессии, иАПФ и БРА у больной с диагнозом «хронический гломерулонефрит в стадии хронической почечной недостаточности (ХПН)» (табл.).
Контрольная УЗДГ почечных сосудов выявила относительное повышение значений пиковых систолических скоростей кровотока в магистральных почечных и интрапаренхиматозных артериях с обеих сторон с нормализацией индексов периферического сопротивления кровотоку как на магистральном, так и на интрапаренхиматозном уровне, что свидетельствует об улучшении микроциркуляции обеих почек в ходе лечения.
Представленное наблюдение с отчетливым положительным эффектом антикоагулянтной терапии, причем не только на уровень азотистых шлаков крови и АД, но и на протеинурию и скорость клубочковой фильтрации вплоть до нормализации их значений, является косвенным свидетельством ишемического повреждения почек тромботического генеза у данной больной. Принимая во внимание несоответствие течения заболевания клинической картине МКГН, активацию внутрисосудистого свертывания крови в отсутствие нефротического синдрома, быстрый ответ на антикоагулянтную терапию, приведшую к полному восстановлению почечной функции, диагноз хронического гломерулонефрита, установленный пациентке на предварительном этапе, представляется неверным. Наиболее обоснован, с нашей точки зрения, диагноз хронической ТМА, несмотря на отсутствие признаков микроангиопатической гемолитической анемии (МАГА) и тромбоцитопении.
В последнее время появились сообщения о развитии ТМА у больных в отсутствии ГУС/ТТП и АФС, протекающей аналогично тому, что мы наблюдали у нашей пациентки. Более того, показано, что в отсутствие тромбоцитопении больные хронической ТМА имеют худший прогноз из-за трудностей диагностики, поскольку диагноз ТМА не включается в круг обсуждаемых заболеваний [7]. Данному диагнозу не противоречит картина мезангиокапиллярного гломерулонефрита, выявленная на светооптическом уровне, поскольку, как известно, целый ряд состояний (болезнь неамилоидного отложения легких цепей, диабетическая нефропатия) наряду с хронической ТМА могут имитировать МКГН. Для дифференциальной диагностики МКГН и перечисленных состояний необходимо проведение иммуногистохимического и электронно-микроскопического исследований, не выполненных в данном случае.
Мы полагаем, что причиной развития ТМА с признаками ренальной дисфункции у представленной больной являются рецидивирующие тромбозы микроциркуляторного русла почек, а имеющуюся у нее мультигенную тромбофилию, по-видимому, следует считать фактором, предрасполагающим к тромбообразованию и его рецидивированию под влиянием классических провоцирующих факторов (беременность и роды). Особенности течения нефропатии, в том числе отсутствие эритроцитурии, изолированный характер протеинурии при морфологической картине МКГН, АГ, резистентная к трем антигипертензивным препаратам, эпизоды рецидивирующего повышения уровня креатинина и, наконец, срок достижения ХПН (6 лет от дебюта болезни) при относительно небольшой протеинурии, заставляли усомниться в диагнозе ХГН и свидетельствовали, скорее, о сосудистой природе заболевания, проявляющейся симптомами ишемии почечной ткани. Несмотря на отсутствие тромбоза капилляров клубочков и мелких внегломерулярных сосудов, имеющиеся гистологические изменения позволяют предполагать наличие хронической ТМА, аналогичной АФС. Отсутствие серологических маркеров АФС побудило нас искать иную причину тромбофилии, которой оказались множественные полиморфизмы в генах свертывания крови. Как было показано в наших предыдущих исследованиях, носительство трех и более мутантных аллелей в генах гемостаза, особенно комбинация замен в генах FGB, PAI-I и MTHFR, что имело место у нашей пациентки, вызывает формирование гиперкоагуляционного состояния с активацией внутрисосудистого свертывания крови в мелких внутрипочечных сосудах [8] и способно, по-видимому, привести к развитию ТМА.
Представленное наблюдение призвано привлечь внимание практических врачей к нефропатиям, протекающим с относительно небольшой протеинурией, ранним повышением уровня креатинина, с довольно высоким темпом прогрессирования почечной недостаточности, напоминающим БПГН. Однако в случаях отсутствия классической клинической картины последнего, генетическое исследование, направленное на верификацию тромбофилии, наряду с биопсией почки может быть использовано как дополнительный диагностический инструмент в диагностике ТМА.
В отличие от первой пациентки, во втором представляемом случае течение болезни сопровождалось яркими системными проявлениями.
Больной 29 лет. Данные о семейном анамнезе отсутствуют. Курит. В возрасте 28 лет (2007 г.) стали беспокоить головные боли, зафиксировано повышение АД до 200/100 мм рт. ст., к врачам не обращался, при повышении АД самостоятельно принимал Энап. В августе 2009 г. после пребывания в жарком климате появился навязчивый сухой кашель, одышка в покое. При обследовании: АД 200/120 мм рт. ст., анемия (гемоглобин 104 г/л) и выраженная азотемия (содержание креатинина в сыворотке крови (Скр) 6,7 мг/дл). При эхокардиографии выявлены расширение полостей левого желудочка и левого предсердия, диффузный гипокинез и умеренная гипертрофия миокарда левого желудочка, фракция выброса 43%, утолщение створок митрального клапана, признаки легочной гипертензии, небольшое количество жидкости в полости перикарда. Диагностирована злокачественная АГ, обсуждался диагноз миокардита. Назначена антигипертензивная терапия (диуретики, бета-адреноблокаторы, иАПФ), в результате которой АД снизилось до 150/80 мм рт. ст. Обследование было продолжено в Городской клинической больнице имени С. П. Боткина (г. Москва), где выявлены: усугубление анемии (гемоглобин 91 г/л), тромбоцитопения (153 тыс./мкл), повышение уровня лактатдегидрогеназы (ЛДГ) до 724 ед/л, минимальный мочевой синдром (протеинурия 0,25 г/л) без изменения мочевого осадка, при сохранном диурезе (1500 мл/сут) отмечено дальнейшее нарастание уровня креатинина (Скр 7,5 мг/дл). При рентгенологическом исследовании отмечалось усиление легочного рисунка за счет сосудистого компонента. При ультразвуковом исследовании почки нормальных размеров (правая 103×46 мм, левая 95×47 мм, толщина паренхимы 19–20 мм рт. ст.), контуры ровные, эхогенность паренхимы повышена, конкрементов не выявлено. Для исключения вазоренального генеза артериальной гипертензии и почечной недостаточности была выполнена УЗДГ почечных сосудов, не выявившая признаков их окклюзии. При иммунологическом исследовании данных за системное заболевание не получено (СОЭ 13 мм/час, антинуклеарный фактор (АНФ) 0,3 ед/мл (норма до 1,0), С3 компонент комплемента 1,14 ед/мл (норма 0,9–1,8), С4–0,28 ед/мл (норма 0,1–0,4) антитела к одноцепочечной (ss) ДНК 9 ед/мл (норма до 20 ед/мл), антитела к двухцепочечной (ds) ДНК 13,7 ед/мл (норма до 20 ед/мл), антинейтрофильные цитоплазматические антитела (ANCA) — не обнаружены).
Иммунологические маркеры АФС (антитела к кардиолипину (АКЛ), волчаночный антикоагулянт (ВА)) — отрицательные. По данным коагулограммы фибриноген 4,0 г/л (норма 2–4 г/л), антитромбин III — 102% (норма 80–120%), АЧТВ — 30 сек (норма 27–39 сек), протромбиновый индекс (ПТИ) — 91% (норма 80–120%), повышение уровня растворимых комплексов фибрин-мономеров (РКФМ) до 4N (норма до 4 мг%).
Для уточнения характера поражения почек выполнена пункционная биопсия. В биоптате 22 клубочка, клубочки стянуты друг к другу, 2 из них полностью склерозированы, в 4 — ишемия капиллярных петель, еще в одном клубочке капиллярные петли коллабированы, стенка их утолщена, имеются двойные контуры. Диффузный склероз интерстиция, атрофия канальцев, занимающая более 70% площади паренхимы. Неспецифическая инфильтрация интерстиция воспалительными клетками в зоне склероза. В двух артериях малого калибра — миоинтимальная пролиферация и склероз интимы; в артериолах — мукоидное набухание интимы с сужением просвета сосудов. Заключение: тромботическая микроангиопатия.
При контрольной эхокардиографии, выполненной через месяц от дебюта заболевания, выявлено уплотнение створок митрального и трикуспидального клапанов, умеренная симметричная гипертрофия миокарда левого желудочка, незначительное снижение фракции выброса (50%). Нарушение локальной сократимости: гипоакинез задненижнего, нижнего, базального, нижнеперегородочного сегментов миокарда левого желудочка. Незначительно истончена и выбухает в полость правого предсердия межжелудочковая перегородка, без признаков патологического шунтирования. Митральная, трикуспидальная регургитация II степени. Значительная легочная гипертензия (давление в легочной артерии 53 мм рт. ст.). Консультирован кардиологом, диагностирован заднедиафрагмальный инфаркт миокарда неизвестной давности, постинфарктный кардиосклероз.
Принимая во внимание клиническую картину заболевания, данные морфологического исследования ткани почки, отрицательные серологические маркеры АФС, было выполнено генетическое исследование, выявившее мультигенную тромбофилию, представленную сочетанием гомозиготных мутаций в генах MTHFR, FGB и гетерозиготных — в генах PAI-I, тромбоцитарного рецептора фибриногена (ITGB3).
Терапия Конкором, Энапом, Тромбо-ассом позволила стабилизировать АД на уровне 150–160/90 мм рт. ст., однако отмечалось дальнейшее прогрессирование почечной недостаточности, к октябрю 2009 г. уровень креатинина крови достиг 9 мг/дл. Диагностирована терминальная ХПН, сформирована артериовенозная фистула для планового начала лечения программным гемодиализом. Однако, принимая во внимание наличие у больного мультигенной тромбофилии, в качестве «терапии отчаяния», после консультации в клинике нефрологии, внутренних и профессиональных заболеваний им. Е. М. Тареева Первого МГМУ им. И. М. Сеченова, была предпринята попытка лечения низкомолекулярными гепаринами (Клексан в максимальной дозе 80 мг/сут), на фоне которого через 2 недели было отмечено снижение уровня креатинина до 7,7 мг/дл, исчезновение одышки, нормализация уровня АД (130/90 мм рт. ст.). В связи с улучшением самочувствия больной воздержался от начала лечения гемодиализом, терапия НМГ была продолжена. Через 3 месяца от начала лечения НМГ отмечено снижение уровня креатинина до 5,1 мг/дл, еще через 2 месяца (март 2010 г.) его уровень составил 4,0 мг/дл. В результате антикоагулянтной терапии (Фраксипарин — 0,3 мл/сут), проводимой без перерыва в течение последующих 1,5 лет, удалось добиться стабилизации функции почек. При контрольном обследовании в клинике имени Е. М. Тареева в феврале 2011 г. креатинин крови сохранялся на уровне 4,0–4,5 мг/дл, D-димер — в пределах нормы, АД контролировалось на цифрах 130–140/90 мм рт. ст. приемом Лозапа 50 мг/сут и амлодипина 10 мг/сут. По данным эхокардиографии отмечена положительная динамика в виде уменьшения размеров левого и правого предсердий, нормализация фракции выброса до 56%, некоторое уменьшение выраженности легочной гипертензии (давление в легочной артерии 51 мм рт. ст.). При ультразвуковом исследовании — размеры почек несколько уменьшены, но сохраняются в пределах нормы (10×5,0 см), толщина паренхимы 16 мм, контуры четкие, неровные.
Таким образом, приведенное клиническое наблюдение иллюстрирует развитие у больного с изолированной наследственной тромбофилией мультиорганного поражения, манифестировавшего сердечной, легочной и почечной недостаточностью. Наличие полиорганной патологии в сочетании с тромбоцитопенией и микроангиопатической гемолитической анемией (МАГА), о чем свидетельствовало падение уровня гемоглобина с параллельным нарастанием уровня ЛДГ, подтвержденная морфологически ренальная тромботическая микроангиопатия позволяли обсуждать возможность развития у больного катастрофического антифосфолипидного синдрома, тромботической тромбоцитопенической пурпуры (ТТП) или атипичного гемолитико-уремического синдрома (аГУС). Однако отрицательные серологические маркеры АФС при повторных определениях позволили отвергнуть диагноз катастрофического антифосфолипидного синдрома. Умеренная тромбоцитопения, нормальный уровень ADAMTS-13 (85%), отсутствие поражения головного мозга противоречили диагнозу ТТП. Мы не имели возможности исследовать уровень факторов H и I комплемента, дефицит которых в настоящее время считается основной причиной развития аГУС, однако общая гемолитическая активность комплемента, а также уровни С3 и С4 компонентов комплемента оставались в норме. Принимая во внимание выраженную активацию внутрисосудистого свертывания крови, данные морфологического исследования ткани почки, была предпринята попытка проведения антикоагулянтной терапии, которая позволила добиться снижения креатинина до 4,5 мг/дл, АД до 130–140/90 мм рт. ст., сохранять их на достигнутом уровне в течение 2 лет и, следовательно, отсрочить начало заместительной почечной терапии.
В обоих представленных случаях не вызывает сомнение развитие ТМА: в первом случае — с изолированным поражением сосудов почек, во втором в рамках генерализованного мультиорганного поражения. По-видимому, выраженность МАГА и тромбоцитопении, являющихся диагностическими критериями классических форм ТМА (ГУС/ТТП), зависит от обширности поражения микроциркуляторного русла. Поэтому локальное поражение почечного сосудистого русла в первом случае не привело к явному формированию этих состояний. Во втором же наблюдении, напротив, отмечалось мультиорганное повреждение с вовлечением большой площади микроциркуляторного русла, что и сопровождалось развитием массивного микроангиопатического гемолиза, подтвержденного лабораторно (анемия, повышение ЛДГ), и тромбоцитопении.
Обычно органом-мишенью микроангиопатического тромбообразования при ТМА служат почки, однако в ряде случаев, как в нашем втором наблюдении, возможна генерализация процесса, приводящая к развитию полиорганной ишемии и недостаточности. В качестве причины подобных состояний в последнее время широко обсуждается в том числе и развитие аГУС взрослых. Основу этой патологии составляет дефект регуляторных механизмов системы комплемента, приводящий к неконтролируемой активации его конечных компонентов (комплекс мембранной атаки), что сопровождается повреждением эндотелия и тромбообразованием в сосудах микроциркуляторного русла жизненно важных органов.
При этом в обоих описанных случаях имеются генетические отклонения, что позволяет обсуждать имеющиеся наследственные формы тромбофилии в качестве важного этиологического фактора ТМА. В последние годы появились описания ТМА при наследственных тромбофилиях [9–14]. И если в первом наблюдении можно утверждать, что мультигенная тромбофилия явилась основной причиной почечной ТМА, то во втором — ее, скорее всего, можно рассматривать как дополнительный фактор риска развития аГУС, возможно, обеспечившей тяжесть и распространенность органного поражения. Несмотря на отсутствие четких лабораторных признаков заболевания, диагноз аГУС у второго больного может обсуждаться, поскольку патология системы комплемента, по современным представлениям, выявляется лишь у 50% больных с этой формой ТМА [15].
Представленные наблюдения демонстрируют необходимость активного диагностического поиска в отношении ТМА при сочетании признаков сосудистой нефропатии (небольшая протеинурия в сочетании со скудным мочевым осадком, тяжелая или злокачественная АГ, быстрое нарастание почечной недостаточности с признаками нарушения почечного кровотока при УЗДГ) с МАГА (шизоцитоз, повышение ЛДГ) и/или тромбоцитопенией. Снижение в этой ситуации общей гемолитической активности комплемента должно насторожить лечащего врача в отношении аГУС, диагноза, до настоящего времени крайне редко устанавливаемого взрослым пациентам. Особенности течения болезни у наших больных, в том числе и ответ на антитромботическую терапию, позволяют предполагать, что, кроме острых форм ТМА, к которым принадлежат постдиарейный и атипичный ГУС, ТТП и катастрофический АФС, возможно, по-видимому, и хроническое течение ТМА, обусловленной мультигенной тромбофилией. Это не противоречит современной классификации ТМА, где существует рубрика «обусловленная другими генетическими причинами» [2]. По-видимому, начальным признаком такой формы ТМА служит тяжелая АГ, как это имело место у обоих больных, причем у второго пациента она практически на год опередила развитие других симптомов. Можно предположить, что пребывание в жарком климате способствовало генерализации микроангиопатического тромбообразования и явилось разрешающим фактором, приведшим к развитию аГУС у больного с генетической формой тромбофилии и, возможно, патологией комплемента. Очевидна необходимость обязательного проведения в подобных случаях биопсии почки с иммуногистохимическим и электронно-микроскопическим исследованиями, позволяющими выявить как признаки острых тромбозов (около 30% случаев), представлявшихся ранее наиболее характерным морфологическим проявлением поражения почек у больных ТМА, так и, чаще, сочетания хронических изменений артерий в виде фиброзной гиперплазии интимы со сморщиванием или удвоением БМК. Подобные изменения описаны в биоптатах почек больных первичным АФС, содержавших фибриновые тромбы, и в случае такого сочетания с очевидностью указывают на существование хронической ТМА [11]. У обоих представленных пациентов имелись ее признаки — у первой больной в виде картины, напоминающей МКГН, у второго — в виде тяжелых ишемических изменений с коллапсом клубочков. Обязательным компонентом гистологической картины хронической ТМА являются изменения канальцев вплоть до тиреодизации и атрофии, фиброз интерстиция, как это отмечено у обоих пациентов. При хронической ТМА любой этиологии показано назначение противотромботической терапии. В обоих представленных нами случаях лечение низкомолекулярными гепаринами привело к улучшению функции почек: в первом — с полным восстановлением, а во втором — со значительным улучшением, позволившим отсрочить начало заместительной почечной терапии.
В последние десятилетия повсеместно в мире отмечается значительный рост числа венозных и артериальных тромбозов. Признание роли тромбофилии в развитии тромботических осложнений различных заболеваний является одним из важнейших открытий последних лет. Благодаря активным исследованиям в этой области выделены группы пациентов высокого риска в отношении развития тромбозов. К ним относятся: генетическая тромбофилия (дефицит антитромбина III, протеинов С и S, наличие лейденской мутации, мутации гена протромбина), АФС, рецидивирующие тромбозы в анамнезе, тромбоэмболические осложнения во время беременности у женщин. Однако очевидна и возможность развития тромбозов микроциркуляторного русла различных органов, в первую очередь почек, у пациентов с тромбофилиями. Следует отметить, что к тромбообразованию в сосудах малого калибра приводит, скорее, не дефицит естественных антикоагулянтов, а комбинация полиморфизмов нескольких генов гемостаза, в первую очередь PAI-I, FGB, MTHFR, как это оказалось у представленных пациентов. При сочетании тромбофилии с заболеванием почек отмечается нарастание тяжести почечного процесса с ускоренным развитием почечной недостаточности, поэтому такие состояния нуждаются в своевременной диагностике и лечении. Однако до настоящего времени в подавляющем большинстве случаев развитие острой почечной недостаточности у больных терапевтического профиля рассматривается либо как БПГН, либо как обострение ХГН, своевременно не диагностированного ранее. В случае явного цитопенического синдрома (анемия, тромбоцитопения), как правило, диагностируют системную красную волчанку с поражением почек, а при полиорганной недостаточности — системные васкулиты. По-видимому, пришло время включать в круг диагностического поиска при подобных ситуациях ТМА, в первую очередь аГУС. Это обусловлено особенностями течения ТМА, быстро приводящей к неблагоприятному исходу даже при хронической ее форме. Вот почему своевременно установленный диагноз, от которого зависит тактика лечения, может изменить прогноз.
Поводом для исключения ТМА, таким образом, у больных с поражением почек могут служить следующие признаки: остронефритический синдром в сочетании с анемией и/или тромбоцитопенией, развившаяся de novo тяжелая или злокачественная АГ или внезапное озлокачествление существовавшей ранее АГ, сочетание тяжелой АГ с нарушением функции почек независимо от наличия или отсутствия мочевого синдрома у молодого пациента, наличие указаний в анамнезе на перенесенную раннюю (до 34 нед беременности) преэклампсию, после которой в течение не менее 6 мес сохраняются АГ, нарушение функции почек, мочевой синдром — изолированные или в разных сочетаниях. Представление о тромбофилии и ТМА должно прочно войти в нефрологическую практику наряду с БПГН — идиопатическим или обусловленным системными заболеваниями.
Литература
Н. Л. Козловская*, доктор медицинских наук, профессор
И. Б. Колина*, **, кандидат медицинских наук
Л. А. Боброва*, **, кандидат медицинских наук
А. М. Кучиева*
Е. Ю. Хафизова*
*ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России,
**НИИ уронефрологии и репродуктивного здоровья человека, Москва








.gif)