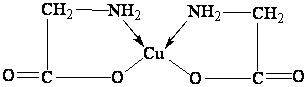что такое координационное число в химии
Координационное число
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Содержание
Координационное число в химии
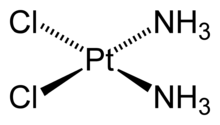
Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe 3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами.
Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным.
Координационное число в кристаллографии
В кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом.
В решётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц.
Для простой кубической решетки координационное число равно шести, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
См. также
Источники
Примечания
Полезное
Смотреть что такое «Координационное число» в других словарях:
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура … Физическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь
КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник.
координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика
координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь
координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии
координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка
координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Урок №15. Комплексные соединения
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
Соединения с комплексными катионами
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
Что такое координационное число в химии
Основы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах.
Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 
В комплексных ионах комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH 4 ] + и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO) 4 ] и [Fe(CO) 5 ], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
так и находясь в составе молекулы:
P H 3 + H + 
B F 3 + NH 3 
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число ( КЧ ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6:
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах и
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9 [Bi(NCS) 12 ].
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками:
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, либо отрицательный, например, или нулевой заряд, например, как для
При растворении в воде комплексные соединения необратимо диссоциируют на ионы:
Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу :
в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды.
Примером комплекса смешанного типа может служить карбонильный комплекс кобальта состава [Co 2 (CO) 8 ], имеющий следующее строение:
Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
Что такое координационное число в химии
Наиболее удачно свойства и строение комплексных соединений объясняет координационная теория, предложенная А. Вернером. Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами) и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих центральный ион, называется координационным числом.
Степень окисления центрального атома является основным фактором, влияющим на координационное число. Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона:
Заряд центрального атома
Координационное число
Жирным шрифтом выделены чаще встречающиеся координационные числа.
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда.
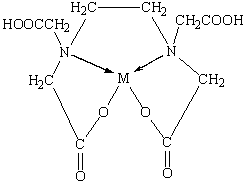
Лиганды, занимающие во внутренней координационной сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются би- и полидентатными. Примерами бидентатных лигандов могут служить оксалатный ион C 2 O 4 2- и молекула этилендамина ( NH 2 CH 2 CH 2 NH 2). Четырехдентатным лигандом является двухзарядный анион этилендиаминтетрауксусной кислоты:
Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов. Например:
Входящие в состав комплекса электронейтральные молекулы, например N Н3, Н2О, С2Н4, не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать.
Основные типы комплексных соединений. К основным типам комплексных соединений относятся следующие.
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами.
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
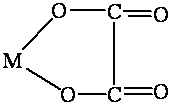
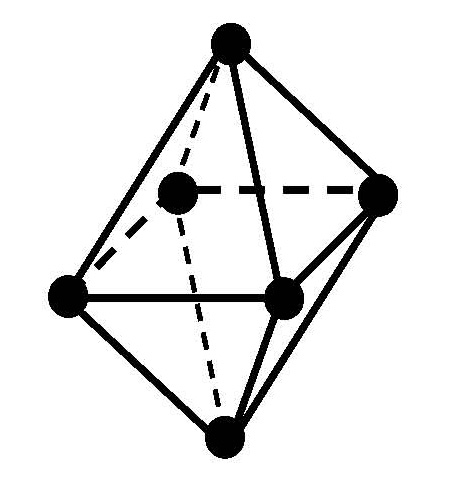
Пространственное строение и изомерия комплексных соединений
Координационное число
Геометрическая конфигурация

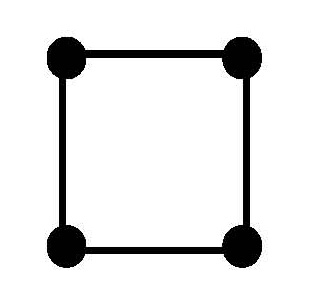
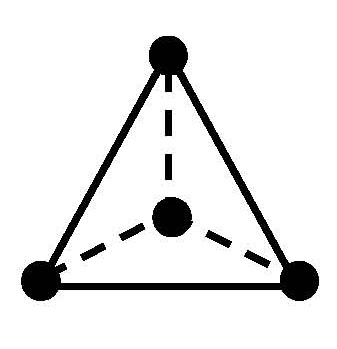
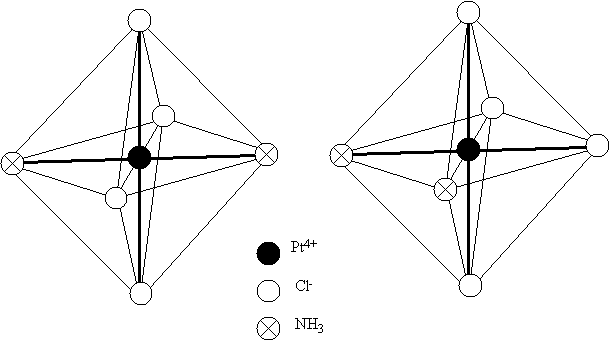
Комплексы платины ( II ), например [ Pt ( NH 3)2 Cl 2], встречаются в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. В одном из изомеров этого комплекса атомы хлора разделены центральным атомом (транс-изомер), а в другом (цис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 7.1).
Рис. 7.1. Пространственное строение изомера [ Pt ( NH 3)2 Cl 2]: а – транс-изомер, б – цис-изомер
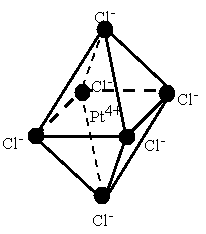
В случае комплексных соединений с координационным числом 6 лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 7.2).
Рис. 7.2. Пространственное строение комплексного иона [ PtCl 6] 2-
Рис. 7.3. Пространственное строение изомеров [ Pt ( NH 3)2 Cl 4]:
а – транс-изомер, б – цис-изомер
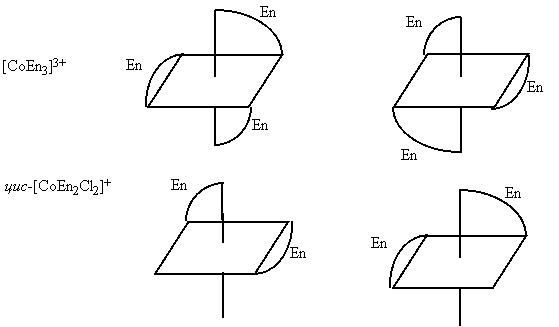
К геометрической изомерии относится и зеркальная (оптическая) изомерия. Например, комплексы [СоЕ n 3]С13 и цис-[ Co Е n 2С12]С1 существуют в виде двух зеркальных антиподов:
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидратная изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [С r (Н2О)6]С13, [С r (Н2О)5С1]С12·Н2О, [С r (Н2О)4С12]С12·2Н2О. При этом цвет комплекса меняется от сине-фиолетового до светло-зеленого.
Ионизационная изомерия определяется различным распределением ионов между внутренней и внешней сферами, например: [ Co ( NH 3)5 Br ] SO 4, [ Co ( NH 3)5 SO 4] Br ; [ Pt ( NH 3)4 Cl 2] Br 2 и [ Pt ( NH 3)4 Br 2] Cl 2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [ Co ( NH 3)6][ Cr ( CN )6] и [ Cr ( NH 3)6][ Co ( CN )6].
7.2. Природа химической связи в комплексных соединениях
Развитие представлений о химической связи в комплексных соединениях переходных металлов прошло четыре стадии. Оно началось с простейшей электростатической теории, которую сменила теория валентных связей, или локализованных молекулярных орбиталей; в дальнейшем появились теория кристаллического поля и, наконец, теория поля лигандов, или делокализованных молекулярных орбиталей. Каждая из этих теорий стала развитием предыдущей. Их последовательное рассмотрение является хорошим способом проследить за развитием представлений о химической связи и дает возможность показать, что одни и те же физические факты можно объяснить в рамках различных, и на первый взгляд, противоположных предположений.
Наши рассуждения будут относиться главным образом к комплексам с октаэдрической структурой, потому что они встречаются наиболее часто и легче поддаются интерпретации. Любая из обсуждаемых теорий должна дать ответы на следующие вопросы:
¨ Как объяснить различие в окраске (поглощении энергии) комплекса при изменении типа лиганда?
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом металла и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными лигандами. В результате образуется наиболее устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексов, но многие другие их свойства остались необъясненными. Так, электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание их свойств и строения может быть получено только на основе квантовомеханических представлений.
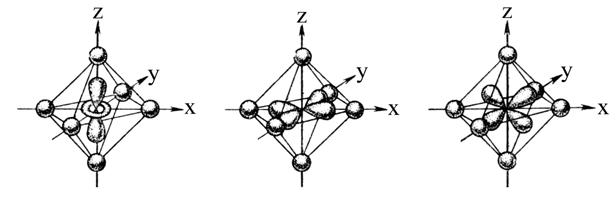
Рис. 7.5. Орбитали dz 2 (а), dx 2 — y 2 (б) и dx (в) в октаэдрическом поле лигандов
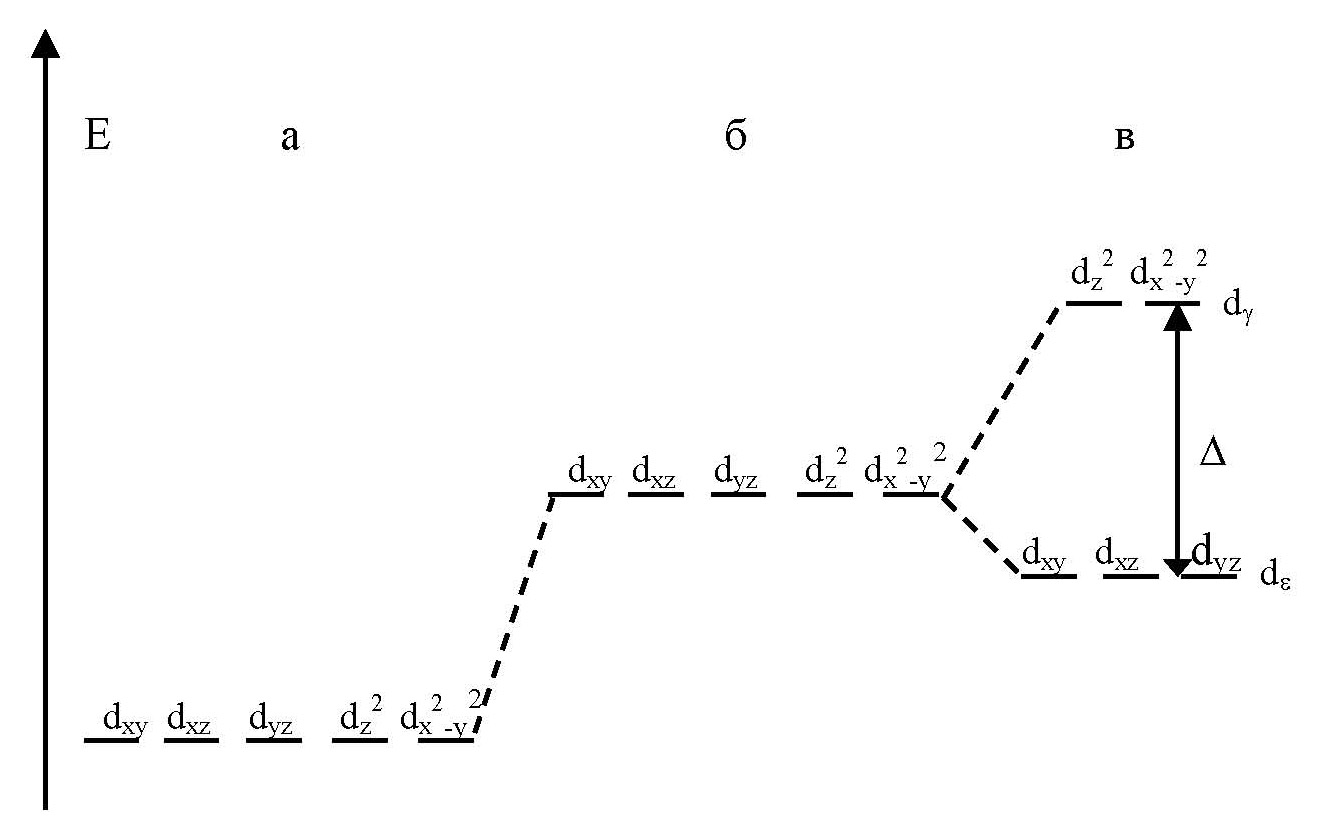
Величина энергии расщепления определяет свойства комплексных соединений, поэтому важно знать факторы, от которых она зависит:
¨ Тип координации центрального атома. На параметр ∆ влияет как число лигандов, окружающих центральный атом, так и их взаимное расположение. Энергия расщепления октаэдрическим полем лигандов (∆о) при прочих равных условиях всегда выше, чем тетраэдрическим (∆ t ): ∆ t = 4/9 ∆о. Это объясняется разной величиной электростатического взаимодействия электронов центрального атома с лигандами.
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце – слабое.
Теория кристаллического поля не может объяснить такое расположение лигандов, связанное с их электронной структурой, которую данная теория не принимает во внимание.
Координационное число
Полезное
Смотреть что такое «Координационное число» в других словарях:
Координационное число — (в химии и кристаллографии) характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле. Содержание 1 Координационное число в химии … Википедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура … Физическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь
КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник.
координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика
координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь
координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии
координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка
координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas