что такое кондиционирование в отделении трансплантации костного мозга
Высокодозная химиотерапия и трансплантация костного мозга в детской онкологии
Трансплантация (пересадка) гемопоэтических стволовых клеток (ТГСК) костного мозга и периферических стволовых клеток является одним из ведущих методов лечения детей, страдающих злокачественными опухолями.
Необходимо отметить следующие принципиально важные моменты, от которых зависит успех выполнения ТГСК:
ВИДЫ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Трансплантацией гемопоэтических стволовых клеток называется введение реципиенту (больному) взвеси гемопоэтических стволовых клеток (ГСК) после назначение ему миелоаблативных доз облучения и (или) максимально переносимых доз цитостатических (противоопухолевых) препаратов.
В зависимости от источника получения трансплантируемых клеток ТГСК подразделяется на следующие виды:
Показания к выполнению алло-ТГСК у детей со злокачественными опухолями:
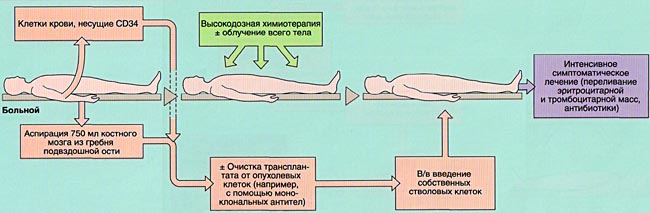
Показания для проведения ауто-ТГСК у детей со злокачественными опухолями:
Злокачественные заболевания системы крови.
Абсолютными показаниями для выполнения алло-ТКМ при наличии HLA-совместимого донора костного мозга являются:
Безрецидивная выживаемость в течение 5 лет у больных ХМЛ, перенесших алло-ТКМ в хронической стадии, составляет 50-60%, ОЛЛ (высокий риск, 1-2 ремиссия) – 50-60%, ОнеЛЛ – 45-65%.
После ауто-ТКМ у детей 5-летняя безрецидивная выживаемость при экстрамедуллярном рецидиве ОЛЛ достигает 65%, а при ОнеЛЛ – 50%.
Тем не менее до настоящего времени нет однозначного времени о сроках выполнения алло-ТГСК и ауто-ТГСК у детей при ОЛЛ и ОнеЛЛ, болезни Ходжкина и неходжкинских лимфомах, поскольку результаты стандартной химиотерапии в некоторых случаях не уступают эффективности ТГСК.
РЕЖИМЫ КОНДИЦИОНИРОВАНИЯ
Эффект цитостатической химиотерапии и лучевой терапии при злокачественных опухолях зависит от дозы назначаемых препаратов и дозы облучения. Режимом кондиционирования называется назначение миелоаблативных доз и (или) максимально переносимых доз цитостатических препаратов с целью достижения высокого уровня иммуносупрессии и по возможности полной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением ему ГСК костного мозга или периферической крови.
Степень иммуносупрессии определяет не только приживление аллогенного костного мозга, но вероятность реакции отторжения трансплантата после алло-ТГСК. Выбор комбинации различных цитостатиков и лучевой терапии перед ТГСК зависит от источника трансплантируемых клеток (аллогенный, аутологичный), типа и стадии заболевания )заболевания системы крови, солидные опухоли, рецидив, ремиссия).
Наиболее распространенные режимы кондиционирования
Использование сверхвысоких доз цитостатиков и лучевой терапии часто приводит к развитию осложнений со стороны внутренних органов (сердца, печени, легких, почек и др.) как в ближайшие сроки после назначения высокодозной химиолучевой терапии, так и в отдаленном периоде.
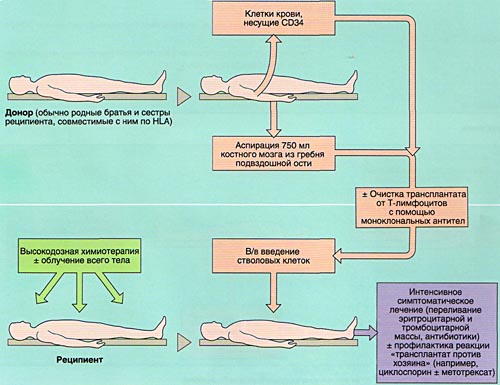
ПОДБОР ДОНОРА КОСТНОГО МОЗГА (ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК)
Одним из основных факторов, определяющих успешность выполнения алло-ТКМ, является подбор совместимого по HLA- системе донора костного мозга (периферических стволовых клеток) Донором костного мозга может являться полностью совместимый по HLA-системе здоровый человек в возрасте до 50 лет.
В случае отсутствия полностью совместимого донора возможно использование частично совместимого донора. При выборе донора костного мозга не имеют различия по группе крови и половой хромосоме.
Подбор донора периферических стволовых клеток (ПСКК) осуществляется на основании принципов выбора донора костного мозга.
ВЗЯТИЕ КОСТНОГО МОЗГА
Забор костного мозга выполняется под общей анестезией (наркозом), хотя возможно использование перидуральной (спинномозговой) анестезией. Костный мозг получают с помощью игл с большим диаметром отверстия путем множественных пункций гребня крыла подвздошной кости с обеих сторон. Объем костного мозга, получаемы в результате этой процедуры, не должен превышать 10-15 мл/кг массы тела донора.
С целью профилактики развития острой реакции “трансплантат против хозяина” (РТПХ) возможно удаление Т-лимфоцитов с помощью моноклональных антител из аллогенного костного мозга перед его введением. Аутлогичный костный мозг может быть очищен от примеси злокачественных клеток с использованием цитостатиков.
Процедура взятия (эксфузии) костного мозга не вызывает серьезных осложнений у 99% доноров, однако развитие осложнений может быть обусловлено влиянием наркоза или состоянием после быстрой кровопотери.
Инфузия (введение) костного мозга реципиенту при алло-ТКМ или сингенной ТКМ производится внутривенно, капельно, через 24-48 часов после окончания химио- или лучевой терапии. Введение аутологичного костного мозга проводится тем же способом, максимально быстро после его размораживания при температуре +42…+45 гр.С.
ВЗЯТИЕ ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
До последнего времени основным источником ГСК при трансплантации был костный мозг (аллогенный, аутологичный).
Вместе с тем ТКМ имеет ряд недостатков:
В вязи с этим была предложена ТПСКК, физиологической основой которой явились данные о выходе стволовых клеток из костного мозга в кровь.
ТПСКК имеет ряд преимуществ по сравнению с ТКМ:
Мобилизация ПСКК может выполняться с помощью цитостатиков (циклофосфан, ифосфамид и др.). Однако у детей основным средством для мобилизации ПСКК являются рекомбинантные ростовые факторы (нейпоген, граноцит, лейкомакс).
Забор ПСКК проводят обычно на 4, 5, 6-й дни с начала введения колониестимулирующего фактора (КСФ). В это время наблюдается значительное повышение количества лейкоцитов периферической крови (в 4-10 раз) и ГСК.
Криоконсервация ПСКК осуществляется методом, аналогичным замораживанию костного мозга.
ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С ТРАНСПЛАНТАЦИЕЙ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У ДЕТЕЙ.
Осложнения раннего период после трансплантации (возникают в течение 100 дней после ТГСК).
1. Осложнения, связанные с назначением режима кондиционирования:
2. Осложнения, связанные с инфекциями.
Развитие тяжелых иммунодефицитных состояний после ТГСК приводит к возникновению различных инфекций (бактериальных, вирусных, грибковых), возникающих почти у всех больных на том или ином этапе после ТКМ.
Для профилактики и лечения таких инфекций назначаются соответствующие препараты.
3. Острая реакция “трансплантат против хозяина”.
При алло-ТКМ наиболее грозным осложнением и одной из основных причин смерти остается реакция “трансплантат против хозяина” (о.РТПХ), которая возникает в 30-60% случаев и обычно сопровождается появлением признаков приживления донорского (пересаженного) костного мозга.
При выполнении алло-ТКМ от неродственного совместимого донора костного мозга вероятность развития о.РТПХ возрастает до 80%. Острая РТПХ подразделяется на I, II, III и IV степени в зависимости от интенсивности клинических проявлений.
Существуют данные о взаимосвязи проявлений о.РТПХ с развитием в последующем рецидива злокачественного заболевания, поскольку параллельно о.РТПХ проходит так называемая реакция “трансплантат против лейкоза”.
Таким образом, о.РТПХ I и II степени является желательной, т.к. ее течение либо не требует специального лечения, либо находится под контролем. Это же касается о.РТПХ III и IV степени, но ее появление крайне опасно, так как терапия этого состояния нередко бывает безуспешной (при о.РТПХ III и IV степени смертность достигает 80-100%).
Клиническими проявлениями о.РТПХ являются:
Лечение о.РТПХ проводится большими дозами гормонов, возможно применение моноклональных антител.
4. Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток
Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток сопровождается развитием панцитопении и аплазии (снижение количества всех клеток крови и костного мозга) и возникает у 1-3% больных после алло-ТГСК.
Вероятность ее значительно возрастет (до 20%) у больных с анемией, после множественных переливаний крови, а также у получивших донорский костный мозг от частично совместимого донора или после удаления Т-лимфоцитов.
Мерами профилактики развития реакции отторжения являются проведение режима кондиционирования в полных дозах, а также назначение иимунодепрессантов в течение длительного периода времени после алло-ТГСК. При подозрении на отторжение трансплантата необходимо применение ростовых факторов (Г-КСФ, ГМ-КСФ, эритропоэтин).
5.Веноокклюзивная болезнь печени (ВОБ).
Тяжелое осложнение, возникающее у 10-60% больных после ТГСК. Заболевание обусловлено повреждением клеток печени высокими дозами цитостатических препаратов. Клинически ВОБ характеризуется желтухой, быстрым увеличением размеров печени, прибавкой веса, асцитом (скоплением жидкости в животе) и болями в брюшной полости.
При тяжелом течении ВОБ развиваются почечная недостаточность, снижение количества тромбоцитов, энцефалопатия (повреждение головного мозга). Первые признаки ВОБ могут появиться на 10-14 день после ТГСК.
Лечение ВОБ сложное и включает комплекс мероприятий, направленных на подержание вводно-электролитного баланса, мочегонных средств. При развитии почечной недостаточности показан гемодиализ (очищение крови с помощью аппарата искусственной почки).
В качестве мер профилактики развития ВОБ используют гепарин и простагландин Е.
Осложнения позднего периода после трансплантации (возникают позднее 100 дней после ТГСК).
1.Хроническая реакция” трансплантат против хозяина” (хр.РТПХ) наблюдается в 30% и более случаев после алло-ТКМ от HLA-совместимого донора костного мозга и может возникнуть как самостоятельно, так и быть продолжением в течении о.РТПХ.
Клиническими проявлениями хр.РТПХ являются склеротические изменения кожи, депигментация или гиперпигментация кожи, выпадение волос, поражение желудочно-кишечного тракта, легких, печени, суставов, мышц, глаз, атрофия лимфоидных органов.
Хроническая РТПХ подразделяется на ограниченную и распространенную в зависимости от степени вовлечения в процесс кожи и печени. Лечение хр.РТПХ проводится циклоспорином и гормонами. Возможно также сочетание с другими иммунодепрессантами (иммуран).
2.Задержка роста является особенностью течения посттрансплантационного периода у детей. Наиболее часто это осложнение встречается при включении в режим кондиционирования тотального облучения тела (ТОТ) и связано с влиянием больших доз облучения на выработку гормона роста (ГР).
Дефицит (нехватка) ГР наблюдается у 90% детей, подвегшихся облучению головы в момент режима кондиционирования и получавших эту терапию на этапе до ТГСК, а также у 40% детей. получавших облучение только в момент ТГСК.
3.Нарушение функции репродуктивных (воспроизводительных) органов и щитовидной железы. Изменение функции репродуктивных органов связано с непосредственным влиянием высокодозной химиотерапии и лучевой терапии. Менее чем у 10% женщин восстанавливается функция яичников в течение 3-7 лет после ТГСК. Сперматогенез (образование спермы) полностью отсутствует после проведения лучевой терапии, однако в течение длительного периода времени возможно его восстановление.
Нарушение функции щитовидной железы возможно у 40% больных после ТГСК и чаще всего развивается у детей с болезнью Ходжкина (лимфогранулематозом), получавших облучение шеи.
4.Поражение глаз наиболее часто сопутствует развитию хр. РТПХ. Возникновение катаракты является осложнением высокодозной лучевой терапии и выявляется у 20% больных, имевших в режиме кондиционирования ТОТ.
5. Возникновение второй злокачественной опухоли. У больных после ТГСК увеличен риск возникновения второй опухоли (лимфома, лейкоз, опухоль головного мозга, меланома, рак печени, остеогенная саркома, рак щитовидной железы), что связано с применением химиотерапии, облучения и иммунодепрессантов.
Вероятность развития второй опухоли больше у пациентов, возраст которых был менее 30 лет на момент ТГСК и увеличивается параллельно длительности жизни после ТГСК.
Рецидивы (возврат) основного заболевания являются нередкой причиной смерти после ТГСК.
В связи с этим все большее внимание уделяется использованию иммунотерапии (интерлейкин-2, интерфероны и пр.) после трансплантации, особенно после проведения ауто-ТГСК.
Целью уничтожения клеток крови является, во-первых, создание пространства для нового костного мозга, во-вторых, предотвращение возможности рецидива после пересадки костного мозга, в-третьих, уничтожение здоровых клеток крови, чтобы они не распознали донорский костный мозг как чужеродный и пытались его отторгнуть.
В зависимости от основного заболевания, в Германии применяются три различные формы кондиционирования:
Облучение всего тела в Германии
Облучение в Германии проводится в специализированном отделении лучевой терапии. В отделении подробно разъясняют пациенту побочные эффекты и риски лучевой терапии. Перед облучением на теле пациента маркируют поля облучения. Любая маркировка может быть удалена с кожи только с разрешения медицинских сотрудников. Даже принимая душ, необходимо следить за маркировкой на коже, стараясь не повредить её. Для предотвращения возникающей тошноты используется специальный медикамент, действующий целый день.
Химиотерапия в Германии
В зависимости от назначенного протокола химиотерапии ее длительность в Германии варьируется от трех до семи дней. Время введения каждой ежедневной дозы, в зависимости от медикамента, от 1 до 6 часов. Во время сеанса химиотерапии в Германии пациент подключен к монитору, который позволяет постоянно следить за состоянием пациента. Однако, кроме мониторирования, врачам очень важно знать о состоянии пациента от него самого. Поэтому нужно обращаться к персоналу клиники, если что-то беспокоит. К побочным явлениям химиотерапии относятся: быстрая утомляемость, слабость, выпадение волос (волосы перед кондиционированием лучше коротко постричь), тошнота и рвота, понос, воспаление слизистой оболочки рта, покраснение кожи.
Пациенты, которым проводится пересадка костного мозга в Германии от неродственного донора во время подготовительной терапии получают препарат из белка кролика, облегчающий приживление чужеродного костного мозга и предотвращающий реакцию «трансплантат-против-хозяина». При этом возможно возникновение лихорадки и озноба.
Спасибо! Мы получили Вашу заявку на консультацию.
Если Вы хотите оформить Запрос на лечение, продолжите заполнение. Располагая всеми необходимыми данными, мы сможем подобрать наилучшее решение Вашей проблемы в максимально короткие сроки
Что такое кондиционирование в отделении трансплантации костного мозга
Режимом кондиционирования называется подготовка больного с помощью цитостатической и лучевой терапии к инфузии аутологичных или аллогенных гемопоэтических стволовых клеток.
Существует два принципиальных подхода при назначении режима кондиционирования перед трансплантацией гемопоэтических стволовых клеток: миелоаблативное и немиелоаблативное воздействие. При этом все известные режимы кондиционирования обладают этими свойствами в разной степени и находятся в диапазоне от немиелоаблативного до миелоаблативного эффекта. Примеры воздействия различных комбинаций цитостатических препаратов, используемые в качестве режимов кондиционирования, представлены в таблице.
Дозы цитостатических препаратов и лучевой терапии, используемые в качестве режимов кондиционирования, приведены в таблицах.
При ауто-трансплантации гемопоэтических стволовых клеток режим кондиционирования включает, как правило, миелоаблативные или близкие к ним дозы цитостатических препаратов либо лучевой терапии для полной эрадикации кроветворения (нормального и злокачественного клонов) пациента перед инфузией аутологичных гемопоэтических стволовых клеток.

Полная замена кроветворения реципиента на гемопоэз донора при алло-трансплантации гемопоэтических стволовых клеток осуществляется с помощью цитостатического и иммунологического воздействия, баланс внутри которых определяется дозой цитостатических препаратов, степенью иммуносупрессии и клеточным составом трансплантата. От уровня иммуносупрессии реципиента зависят скорость приживления гемопоэтических стволовых клеток донора и вероятность развития первичной «реакции отторжения» трансплантата.
До сих пор не разработано идеального режима кондиционирования, в основе которого находилась бы комбинация лучевой терапии и цитостатических препаратов, обладающих максимально высокими противоопухолевым и иммуносупрессивным эффектами у реципиента, без каких-либо проявлений органотоксичности. Наиболее часто встречающиеся токсические осложнения существующих режимов кондиционирования хорошо изучены, их тяжесть зависит от возраста реципиента (менее выражены у детей и подростков), генетической предрасположенности, общего состояния (индекс Карновского), стадии заболевания в момент трансплантации (рецидив, ремиссия).
При алло-трансплантациии гемопоэтических стволовых клеток используют миелоаблативные режимы кондиционирования и достаточно часто режимы кондиционирования с уменьшенной интенсивностью дозы (R1 — HSCT — reduce intensity — hematopoietic stem cell transplantation, «мини-трансплантат», «немиелоаблативные»), особенности которых учитывают при назначении определенной схемы подготовки пациента перед трансплантацией.
До последнего времени миелоаблативные режимы кондиционирования были основой успеха при проведении алло-трансплантации гемопоэтических стволовых клеток. Миелоаблативным режимом кондиционирования называется использование комбинации доз цитостатических препаратов или лучевой терапии для достижения полной эрадикации кроветворения (нормального и злокачественного клонов) и иммуноаблативного эффекта у реципиента перед введением аллогенных гемопоэтических стволовых клеток.
Режимом кондиционирования с уменьшенной интенсивностью дозы («немиелоаблативные») называется назначение комбинации немиелоаблативных, но иммуноаблативных доз цитостатических препаратов или лучевой терапии для достижения высокой степени иммуносупрессии при неполной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением донорских гемопоэтических стволовых клеток.
Внедрение «немиелоаблативных» режимов кондиционирования приобрело актуальность по следующим причинам:
— наличие большого количества тяжелых осложнений, связанных с органотоксичностью при назначении цитостатических препаратов в миелоаблативных дозах;
— сложность применения миелоаблативных режимов кондиционирования у пациентов старше 50 лет и низким индексом Карновского;
— относительно высокая частота развития рецидивов основного заболевания после алло-трансплантации гемопоэтических стволовых клеток, несмотря на использование цитостатических препаратов в максимальных дозах, и, следовательно, невозможность преодоления резистентности злокачественного клона клеток путем наращивания доз;
— появление экспериментальных и клинических данных, свидетельствующих о наличии иммунологической реакции «трансплантат против опухоли (лейкоза/лимфомы/миеломы/солидной опухоли)».
Внедрение «немиелоаблативных» режимов кондиционирования стало возможным в связи с появлением новых цитостатических препаратов — аналогов пуриновых оснований (флударабин, 2-CDA), оказывающих выраженное иммуносупрессивное действие. Эти препараты создают условия для развития абсолютной иммунологической толерантности в организме реципиента, что позволяет использовать гемопоэтические стволовые клетки, полученные из различных источников (родственные, неродственные доноры, ПК) и с различной степенью совместимости по HLA-системе (полностью, частично совместимые, гаплоидентичные).
Миелоаблативные режимы кондиционирования
Достижение полного «химеризма» (100 % приживления гемопоэтических стволовых клеток донора) у реципиента после режимов кондиционирования с уменьшенной интенсивностью дозы происходит медленнее по сравнению с миелобластными дозами с минимальными проявлениями органотоксичности, что расширяет возрастной диапазон для применения алло-трансплантациии гемопоэтических стволовых клеток. Другим преимуществом режимов кондиционирования с уменьшенной интенсивностью дозы является то, что комбинация цитостатического и в большей степени иммунологического воздействия на лейкозный клон клеток может быть высокоэффективной при резистентных формах заболевания. Создание этих схем подготовки реципиента и первые данные, свидетельствующие в пользу возможности достижения успеха, ведут к ежегодному росту количества алло-трансплантации гемопоэтических стволовых клеток с использованием режимов кондиционирования с уменьшенной интенсивностью дозы.
Выбор комбинации различных цитостатических препаратов и лучевой терапии перед трансплантацией гемопоэтических стволовых клеток зависит от возраста реципиента, индекса Карновского, источника трансплантируемых клеток (аллогенный, аутологичный), степени совместимости по HLA-системе между донором и реципиентом, типа и стадии болезни (злокачественные заболевания системы крови, солидные опухоли, апластическая анемия, генетические заболевания или рецидив, ремиссия), а также собственного опыта работы центра трансплантации.
Применение лучевой терапии в режиме кондиционирования обусловлено способностью тотального облучения тела (ТОТ) вызывать выраженный миело- и иммуноаблативный эффект. Включение тотального облучения тела (ТОТ) в режим кондиционирования обсуждается при проведении трансплантации гемопоэтических стволовых клеток у больных ОЛЛ, лимфомами, множественной миеломой, а также при выполнении неродственной алло-трансплантации гемопоэтических стволовых клеток и трансплантации от частично совместимого или гап-лоидентичного донора. Манипулирование дозой ТОТ также позволяет достигнуть состояния иммуно-аблативного воздействия без миелоаблативного эффекта, что создает условия для создания «немиелоаблативных» режимов кондиционирования на его основе.
Однако, несмотря на преимущества тотального облучения тела (ТОТ), связанные с высокими проявлениями иммуносупрессии и профилактикой развития рецидивов заболевания (в первую очередь нейролейкемии), невозможность проведения тотального облучения тела (ТОТ) у больных с гемобластозами по тем или иным причинам не исключает применения режимов кондиционирования, полностью основанных на цитостатических препаратах с той же степенью эффективности.
Для достижения максимального иммуносупрессивного воздействия возможно дополнительное включение в режим кондиционирования антилимфоцитарного (антитимоцитарного) глобулина (АЛГ/ АТГ). Введение АЛГ/АТГ в режим кондиционирования служит мерой для профилактики первичного «отторжения» трансплантата и развития острой РТПХ при проведении родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток, а также при алло-трансплантации гемопоэтических стволовых клеток от частично совместимого или гаплоидентичного донора. Этот эффект связан с длительной персистенцией препарата в плазме крови (до 7 дней) и двусторонним повреждающим эффектом АЛГ/АТГ (до 120 дней) на лимфоидную популяцию клеток реципиента и лимфоциты, присутствующие во введенном трансплантате (Т-клеточное «истощение» in vivo).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
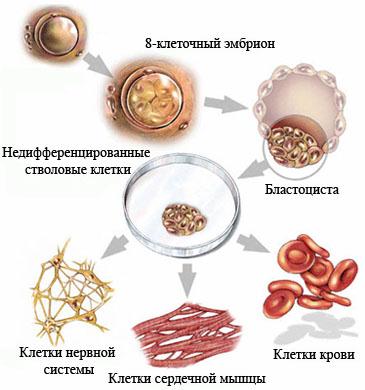
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 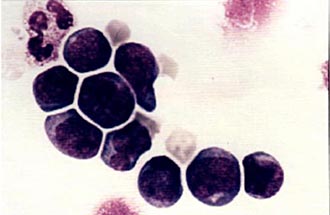 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>