что такое комбинированное лечение тест
Провокационные тесты в аллергологии
В последние годы отмечается значительный рост аллергических заболеваний, особенно среди населения крупных индустриальных центров и мегаполисов, что диктует необходимость постоянного поиска новых диагностических приемов и методов лечения аллергии. Диагно
В последние годы отмечается значительный рост аллергических заболеваний, особенно среди населения крупных индустриальных центров и мегаполисов, что диктует необходимость постоянного поиска новых диагностических приемов и методов лечения аллергии.
Диагноз ставится на основании физикальных, а также лабораторных, инструментальных и других методов общеклинического и аллергологического обследования.
Особое место среди методов специфического аллергологического обследования занимают так называемые провокационные тесты, направленные на выявление ответной реакции на специфический раздражитель — аллерген.
Условия проведения аллергологического тестирования
Провокационные тесты с использованием аллергенов может проводить исключительно специалист — аллерголог-иммунолог, владеющий практическими навыками проведения подобных исследований, способный быстро и грамотно провести лечебные мероприятия при возникновении системных реакций.
Возможность развития системных реакций при проведении такого тестирования делает данную процедуру опасной, поэтому ее следует осуществлять только в условиях специализированного кабинета или стационара, оборудованных всем, что необходимо для купирования системных реакций. Провокационные тесты имеют свои показания и противопоказания, которые нужно учитывать при назначении подобных методов диагностики.
Наиболее распространенные методы аллергологического тестирования
Для проведения специфического провокационного тестирования используются стандартизированные лечебно-диагностические аллергены, прошедшие регистрацию в России и допущенные к применению. Основные группы лечебно-диагностических аллергенов, применяемых на данный момент в России для диагностики немедленной аллергии, следующие: пыльцевые аллергены; аллергены домашней и библиотечной пыли; аллергены клещей домашней пыли; аллергены эпидермиса животных; аллергены из пера и пуха птиц; пищевые аллергены; инсектные аллергены; бактериальные и грибковые аллергены.
Основная цель провокационных тестов — выявить наличие гиперчувствительности к тому или иному аллергену, установить ее степень, а также подобрать спектр аллергенов для дальнейшего проведения аллерген-специфической иммунотерапии.
При проведении тестирования производится нанесение на кожу или слизистые конъюнктив либо дыхательного тракта одного или нескольких разведений аллергена, после чего оценивается выраженность реакции в ответ на этот раздражитель. Основные методы провокационного аллергологического тестирования: кожный (в том числе аппликационный); назальный; конъюнктивальный; ингаляционный; сублингвальный.
Кожное тестирование
Кожное тестирование — наиболее доступный и высокоспецифичный метод выявления гиперчувствительности как немедленного, так и замедленного типа.
Данный метод тестирования имеет противопоказания, которые также необходимо учитывать и при применении других провокационных тестов.
Противопоказания к проведению кожного тестирования: обострение основного заболевания; тяжелое, нескомпенсированное течение бронхиальной астмы; острые интеркуррентные инфекции (ОРЗ, ангина, пневмония и др.); декомпенсация заболеваний внутренних органов (печени, почек, сердечно-сосудистой системы, эндокринной системы, крови и др.); обострение очагов хронической инфекции. Активная фаза хронических инфекционных заболеваний (туберкулеза, сифилиса, бруцеллеза и др.); аутоиммунные заболевания (СКВ, склеродермия, ревматоидный артрит, дерматомиозит и др.); злокачественные новообразования; психические заболевания; беременность и лактация; синдром приобретенного иммунодефицита.
С целью диагностики одной из самых распространенных форм немедленной аллергии — атопии — применяют скарификационные и prick-методы кожного тестирования. Для диагностики гиперчувствительности замедленного типа (ГЗТ) используют внутрикожные тесты с бактериальными и грибковыми аллергенами, для общей оценки ГЗТ возможно проведение кожных тестов с туберкулином и бруцеллином. Реакция оценивается через 24—48 ч. И в том и в другом случае используется тест-контрольная жидкость как отрицательный и раствор гистамина как положительный контроль.
Кожное тестирование с определенной долей вероятности может быть неинформативным (ложноположительные или ложноотрицательные результаты) по целому ряду причин — неправильное хранение аллергенов, снижение кожной реактивности, нарушения техники проведения кожного тестирования и др. Поэтому, как и другие виды провокационного тестирования, кожные тесты можно рассматривать в качестве уточняющего метода диагностики. При этом необходимо также учитывать, что по результатам кожного тестирования можно установить лишь наличие сенсибилизации (повышенной чувствительности организма к определенному аллергену). Для того чтобы поставить заключительный диагноз, необходимо установить четкую связь между наличием данной сенсибилизации и клиническими проявлениями заболевания, т. е. подтвердить, что именно этот аллерген ответственен за появление симптомов аллергии.
Для оценки степени чувствительности пациента к данному аллергену (а также с целью подбора начальной дозы лечебного аллергена для проведения аллерген-специфической иммунотерапии) проводится аллергометрическое титрование, т. е. тестирование с разными разведениями аллергена. Исследование осуществляют путем постановки кожных проб с различными разведениями аллергенов.
Кожные тесты можно проводить только с использованием специально разработанных диагностических аллергенов. Тесты с нанесением лекарственного препарата на кожу, внутрикожным или подкожным его введением с целью выявления лекарственной аллергии использовать не рекомендуется. Во-первых, это создает опасность возникновения системной реакции, а во-вторых, есть риск развития неспецифической местной воспалительной реакции, которая не может достоверно указывать на наличие или отсутствие аллергии.
Методика постановки кожных аллергологических проб
На кожу предплечья, предварительно обработанную спиртом, наносят каплю тест-контрольной жидкости, каплю 0,01% раствора гистамина, а также каплю аллергена (аллергенов). Раствор с гистамином является положительным контролем, а с тест-жидкостью — отрицательным. Расстояние между местами нанесения капель не менее 2,5-3 см. После этого производится повреждение эпидермиса в области каждой капли. При этом используют разные скарификаторы. Скарификацию также можно выполнять ланцетами — специальными скарификаторами с фиксированными на них аллергенами. При проведении prick-тестирования повреждение наносится посредством укола, при проведении скарификации — поверхностной царапины эпидермиса (при проведении этой процедуры важно не повредить кровеносные сосуды!). Реакции оценивают через 10–20 мин. Оценка скарификационных и prick-тестов по степени выраженности реакции приведена в таблицах 1 и 2.
Аппликационные кожные тесты
Аппликационные кожные тесты (patch-tests) применяются для диагностики контактного аллергического дерматита и фотодерматита. Для проведения тестирования используются стандартизированные диагностикумы для выполнения аппликационных тестов: медикаменты местного действия, металлы, компоненты резины, клеящие вещества, антимикробные средства, ароматизаторы и другие вещества. Реакция оценивается через 48–72 ч.
Назальный тест
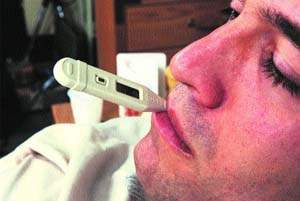
Назальный тест применяют для диагностики аллергического ринита. В один носовой ход закапывают 1 каплю тест-контрольной жидкости. При отсутствии какой-либо реакции в другой носовой ход последовательно закапывают по 1 капле десятикратного разведения аллергена (1:100, 1:10), затем цельный аллерген. Интервал между закапыванием аллергена с более высокой концентрацией должен составлять не менее 20–30 мин. Увеличение концентрации аллергена производится только при отсутствии реакции на предыдущее разведение. Тест считается положительным при появлении симптомов ринита. Проявления ринита также можно зафиксировать при передней риноскопии.
Конъюнктивальный тест
Конъюнктивальный тест используют для диагностики аллергического конъюнктивита. В нижний конъюнктивальный мешок глаза закапывают тест-контрольную жидкость. При отсутствии реакции в другой конъюнктивальный мешок последовательно закапывают по 1 капле аллергена в двукратных разведениях (1:2048, 1:1024, 1:512 и т. д., до 1:2). Интервал между нанесениями аллергена с разными концентрациями не менее 20–30 мин. Увеличение концентрации аллергена производится только при отсутствии реакции на предыдущую концентрацию. Тест считается положительным при появлении симптомов конъюнктивита.
Ингаляционный тест
Ингаляционный тест применяют для диагностики бронхиальной астмы и проводят только в условиях стационара. Сначала оценивают показатели функции внешнего дыхания — ОФВ1 (первоначально не менее 70% от должных величин). Затем ингалируют контрольную жидкость. Ингаляции можно проводить с помощью дозирующего струйного ингалятора. При отсутствии реакции производятся ингаляции аллергена в двукратных разведениях (1:1024, 1:512, 1:256 и т. д., до 1:16). Через каждые 10 мин после очередной ингаляции регистрируется ОФВ1. При снижении показателя более чем на 20% тест считается положительным. После проведения теста пациент должен оставаться под наблюдением врача 24 ч. В течение одних суток возможно проведение ингаляционного теста только с одним аллергеном.
Сублингвальный тест
Сублингвальный тест применяют для диагностики лекарственной и пищевой аллергии. При наличии в анамнезе пациента тяжелых реакций, предположительно связанных с исследуемым препаратом или пищевым продуктом, предпочтительнее использовать лабораторные методы исследования. Перед началом тестирования измеряют ЧСС, АД, осматривают полость рта. Затем 1/8 (1/4) таблетки (или 2-3 капли растворенного лекарственного препарата) или натуральный пищевой продукт в разведении 1:10 помещают под язык пациента на 5–15 мин. Тест считается положительным при возникновении местной воспалительной реакции на слизистой оболочке полости рта или системной реакции. После тестирования больной должен находиться под наблюдением врача в течение суток. За этот период времени врач проводит мониторинг состояния сердечно-сосудистой и дыхательной систем пациента.
Реакции при проведении аллергологического тестирования
Возникновение местной аллергической реакции при проведении аллергологического тестирования является ожидаемой, однако, учитывая наличие провокации, подобный метод обследования сопряжен и с опасностью появления системных реакций, которые требуют принятия немедленных мер. Возникновение подобных осложнений при проведении тестирования возможно как в первые секунды (минуты), так и часы, а в некоторых случаях — и сутки.
Легкие признаки системной реакции: боли в суставах, головная боль, ощущение дискомфорта.
Умеренные признаки системной реакции: легкие проявления ринита, конъюнктивита или бронхиальной астмы (пиковая скорость выдоха не ниже 60% от должных величин или от показателя пациентов в период ремиссии). Симптомы хорошо контролируются соответствующими лекарственными препаратами (Н1-блокаторами или ингаляционными β2-агонистами).
Выраженные признаки системной реакции: крапивница, отек Квинке, нарушение бронхиальной проводимости (с показателем пиковой скорости выдоха ниже 60% от должной величины или от показателя пациента в период ремиссии), симптомы контролируются соответствующим лечением.
Угрожающие жизни состояния — анафилактический шок, отек жизненно важных органов (отек гортани) — требуют интенсивной терапии.
Основными причинами развития подобных реакций могут быть: несоблюдение требований, предъявляемых в отношении противопоказаний к провокационному тестированию; использование нестандартизированных аллергенов или препаратов, которые хранились без соблюдения соответствующих требований; нарушения технологии проведения тестирования; высокая индивидуальная чувствительность пациента.
Объем терапевтической помощи при возникновении системных реакций зависит от ее выраженности.
Во всех случаях возникновения системных реакций при проведении аллергологического тестирования необходима госпитализация для стационарного наблюдения и лечения пациента. Лечение тяжелых системных реакций необходимо проводить в условиях отделения реанимации и интенсивной терапии.
При возникновении системных реакций первое, что необходимо сделать,— прекратить введение (аппликацию, ингаляцию и т. д.) аллергенов. После этого следует начать проведение терапии, направленной на купирование реакции: введение системных антигистаминных препаратов (Н1-блокаторов), а также системных глюкокортикостероидов парентерально. В случае возникновения бронхообструктивного синдрома применяются β2-агонисты, холинолитики (ингаляционно), парентеральное введение метилксантинов, системных ГКС с учетом степени выраженности реакции.
Анафилактический шок — одно из самых серьезных проявлений аллергической реакции немедленного типа, сопровождающееся рядом системных нарушений и требующее оказания немедленной врачебной помощи. Время развития — от нескольких секунд до нескольких часов. Анафилактический шок может развиваться по разным сценариям. Клинические симптомы обусловлены сокращением гладких мышц, увеличением сосудистой проницаемости, дисфункцией эндокринных желез, нарушением свертываемости крови. Ведущими в клинической картине анафилактического шока являются кардиоваскулярные и респираторные нарушения, одно из которых может превалировать над другим.
В более легких случаях анафилактический шок начинается с появления предвестников — чувства тревоги, страха, слабости, ощущения жара. Могут появляться кожный зуд, высыпания по типу крапивницы, эритема, отек Квинке, осиплость голоса (вплоть до афонии), затруднение глотания, головокружение, головная боль, шум в ушах, онемение и покалывание пальцев, языка и губ, симптомы ринита и конъюнктивита, боли в животе, пояснице и в области сердца. При осмотре — бледность кожных покровов, иногда с синюшным оттенком. Наблюдаются одышка, стридорозное дыхание, хрипы; рвота, непроизвольная дефекация и мочеиспускание. Снижение АД на 30–50 мм рт. ст., тоны сердца глухие, пульс нитевидный. Тахикардия, тахиаритмия. Потеря сознания отмечается не сразу или вовсе не происходит.
При анафилактическом шоке средней степени тяжести указанные выше симптомы носят более выраженный характер. Потеря сознания происходит быстро, нередко отмечаются тонические и клонические судороги, холодный липкий пот, цианоз губ, расширение зрачков. Тоны сердца глухие, сердечный ритм неправильный, нитевидный, АД не определяется.
При тяжелом течении — развитие стремительное. Потеря сознания немедленная. Тоны сердца не выслушиваются, АД не определяется. Дыхание не выслушивается из-за полной обструкции дыхательных путей.
Лечебные мероприятия при возникновении анафилактического шока
Лечебные мероприятия при возникновении анафилактического шока должны проводиться незамедлительно. Ввести подкожно 0,3–0,5 мл 0,1% раствор адреналина. Место нанесения аллергена (по возможности) обколоть 0,1% раствором адреналина или норадреналина в дозе 0,1–0,3 мл с 4–5 мл физиологического раствора. Можно приложить лед. Необходимо начать внутривенное капельное введение: 300 мл 5% раствора глюкозы + 1 мл 0,1% раствора норадреналина. Альтернативно: введение допамина (от 300–700 мкг/мл, но не более 1500 мкг/мл) с постепенным снижением. При необходимости можно продолжать введение прессорных аминов (0,1% раствор адреналина подкожно) с интервалами 5–10 мин. Длительность введения определяется гемодинамическими показателями. Внутривенное капельное введение системных ГКС-препаратов: гидрокортизона 250 мг, или преднизолона 90–120 мг, или дексаметазона 8–32 мг. При возникновении бронхообструктивного синдрома ввести эуфиллин 10,0 мл 2,4% раствора в/в на физиологическом растворе. При отеке легких дозу ГКС можно увеличить, а также ввести в/в 0,5 мл 0,5% строфантина с 10 мл 40% глюкозы. При необходимости проводится: интубация или трахеостомия и перевод на ИВЛ, оксигенация — ингаляция увлажненного кислорода с помощью носового катетера (скорость — 5–10 л/мин). Применение диуретиков показано только при нормализации АД. При систолическом АД выше 90 мм рт. ст. могут быть введены антигистаминные препараты: тавегил — 2,0 мл. Осуществляется введение плазмозамещающих препаратов, жидкости в/в капельно или струйно. Возможно введение декстранов. Введение ГКС и антигистаминных препаратов продолжить до улучшения состояния пациента. Отмена вышеуказанных препаратов производится постепенно и сообразно объективным признакам стабилизации. Необходим постоянный мониторинг функции дыхательной и сердечно-сосудистой систем. Возможно развитие осложнений (инфаркт миокарда, отек легких, отек мозга и проч.).
Длительность лечения варьирует от нескольких часов до нескольких суток.
Таким образом, провокационное тестирование с использованием диагностических аллергенов продолжает оставаться важной, а в ряде случаев незаменимой частью специфического аллергологического обследования. Провокационные методы позволяют оценить аллергологический статус пациента, проводить подбор и оценку эффективности терапии, осуществлять динамическое наблюдение за состоянием пациента.
В последнее время во всем мире проводится работа, направленная на создание новых диагностических препаратов на основе аллергенов. Однако основной принцип подобной диагностики остается неизменным: назначение, проведение и оценка результатов провокационного аллергологического тестирования должны производиться исключительно специалистом — аллергологом-иммунологом.
Е. Н. Медуницына, кандидат медицинских наук НИИ аллергологии и иммунологии, Москва
ИММУНОДЕФИЦИТЫ:диагностика и иммунотерапия
Целью настоящего обзора является анализ современных данных о диагностике и иммунотерапии иммунодефицитов. Иммунодефицит — это понижение функциональной активности основных компонентов иммунной системы, ведущее к нарушению защиты организма от микробов и пр
Целью настоящего обзора является анализ современных данных о диагностике и иммунотерапии иммунодефицитов. Иммунодефицит — это понижение функциональной активности основных компонентов иммунной системы, ведущее к нарушению защиты организма от микробов и проявляющееся в повышенной инфекционной заболеваемости. Иммунодефициты делятся на первичные и вторичные.
 |
Первичные иммунодефициты (ПИД) — это врожденные нарушения иммунной системы, связанные с генетическими дефектами одного или нескольких компонентов иммунной системы, а именно: комплемента, фагоцитоза, гуморального и клеточного иммунитета. Общей чертой всех видов ПИД является наличие рецидивирующих, хронических инфекций, поражающих различные органы и ткани и, как правило, вызываемых оппортунистическими или условно-патогенными микроорганизмами, т. е. низковирулентной флорой. ПИД часто бывают ассоциированы с анатомическими и функциональными нарушениями других систем организма и имеют некоторые характерные черты, позволяющие поставить предварительный диагноз у новорожденных без лабораторно-иммунологического обследования (см. табл.).
Таблица. Данные физикального обследования, позволяющие сделать предварительный диагноз ПИД [8]
Различные компоненты иммунной системы могут принимать неодинаковое участие в элиминации микробов из макрорганизма. Поэтому по характеру инфекционного процесса можно также предварительно судить о том, какой компонент иммунитета работает недостаточно. Так, при развитии в течение первых дней жизни ребенка гнойно-воспалительных процессов кожи и слизистых оболочек, вызываемых пиогенными кокками, есть повод думать о наличии врожденных дефектов фагоцитарной системы. Для них также характерно очень медленное заживление пупочной раны и отпадение пупочного канатика. Инфекционные процессы, связанные с дефектом антителообразования, развиваются, как правило, во втором полугодии жизни ребенка после исчезновения из кровяного русла материнских иммуноглобулинов. Чаще всего эти инфекции вызываются инкапсулированными пиогенными микроорганизмами (стрептококками, пневмококками, Haemophiluls influlenzae и др.), поражающими верхние и нижние отделы респираторного тракта. Упорные нейссериальные инфекции часто ассоциируются с врожденными дефектами в компонентах комплемента С5-С9. Частые инфекционные процессы, вызываемые вирусами и другими внутриклеточными возбудителями, дают основание предполагать наличие дефекта в Т-системе иммунитета. Об этом также может свидетельствовать кожно-слизистый кандидоз. Триада — хронические пневмонии, длительная, трудно поддающаяся лечению диарея и кандидоз — всегда служит основанием для предположения о наличии врожденных дефектов Т-лимфоцитов. Для комбинированных дефектов Т- и В-систем иммунитета характерно необычайно тяжелое течение инфекционных процессов, которые развиваются в первый месяц жизни ребенка. Без соответствующего лечения ребенок погибает, как правило, в течение первого года жизни.
Лабораторно-иммунологическое обследование проводится с целью идентификации конкретного нарушения иммунной системы и подтверждения клинического диагноза. Первичная диагностика может осуществляться с помощью панели скрининговых лабораторных тестов.
Применение панели скрининговых лабораторных тестов возможно практически в любой областной или городской больнице, где имеется клинико-диагностическая лаборатория. Однако углубленный анализ можно провести лишь в специализированном лечебно-профилактическом учреждении, имеющем современную лабораторию клинической иммунологии. У больного с подозрением на ПИД следует детально исследовать функциональную активность фагоцитов, Т- и В-систем иммунитета. Более подробно методические подходы к оценке иммунитета будут описаны в соответствующем разделе.
В настоящее время идентифицировано более 70 врожденных дефектов иммунной системы, и, вероятно, их число по мере совершенствования методов молекулярной иммунодиагностики будет расти. ПИД — это относительно редкие заболевания: их частота составляет в среднем 1/25000-1/100000. Исключением является селективный IgA-дефицит, встречающийся с частотой 1/500-1/700. Изучение ПИД представляет большой интерес для теоретической и прикладной иммунологии. Анализ молекулярно-генетических механизмов, лежащих в основе этих дефектов, дает возможность выявлять принципиально новые механизмы функционирования иммунной системы и, следовательно, разрабатывать новые подходы к иммунодиагностике и иммунотерапии заболеваний, связанных с нарушениями иммунной системы.
Вторичные иммунодефициты (ВИД). Значительный интерес для клинической иммунологии представляет и изучение ВИД, которые в количественном отношении среди иммунодефицитов являются, без сомнения, доминирующими. Под ВИД понимают такие нарушения иммунной системы, которые развиваются в позднем постнатальном периоде или у взрослых и, как принято считать, не являются результатом какого-то генетического дефекта. Среди ВИД условно можно выделить три формы: приобретенную, индуцированную и спонтанную. Наиболее ярким примером первой формы является синдром приобретенного иммунодефицита (СПИД), развивающегося в результате поражения лимфоидной ткани человека соответствующим вирусом. Индуцированные ВИД — это такие состояния, возникновение которых связано с какой-то конкретной причиной: рентгеновское облучение, кортикостероиды, цитостатики, травмы и хирургические операции, а также нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (диабет, заболевания почек и печени, злокачественные процессы и т. д.). Индуцированные формы ВИД, как правило, являются транзиторными, и при устранении вызвавшей причины в большинстве случаев происходит полное восстановление иммунитета. В отличие от индуцированной, спонтанная форма ВИД характеризуется отсутствием явной причины, вызвавшей нарушение иммунологической реактивности. Так же как и при ПИД, эта форма иммунодефицита проявляется в виде хронических, рецидивирующих, инфекционно-воспалительных процессов бронхолегочного аппарата и околоносовых придаточных пазух, урогенитального и желудочно-кишечного трактов, глаз, кожи и мягких тканей, вызываемых, как и ПИД, оппортунистическими или условно-патогенными микроорганизмами с атипичными биологическими свойствами и часто с наличием множественной устойчивости к антибиотикам. В количественном отношении спонтанная форма является доминирующей формой ВИД.
Как уже отмечалось, изучение иммунного статуса при иммунодефицитах должно включать изучение количества и функциональной активности основных компонентов иммунной системы, играющих главную роль в противоинфекционной защите организма. К ним относятся фагоцитарная система, система комплемента, Т- и В-системы иммунитета. Методы, применяемые для оценки функционирования этих систем, условно разделены Петровым Р. В. с соавт. (1984) на тесты 1-го и 2-го уровней. По данным этих авторов, тесты 1-го уровня являются ориентировочными и направлены на выявление грубых дефектов в иммунной системе; тесты 2-го уровня являются функциональными и направлены на идентификацию конкретной “поломки” в иммунной системе. Мы относим к тестам 1-го уровня методы, направленные на идентификацию того продукта функционирования соответствующей системы иммунитета, который определяет ее антимикробный эффект. Тесты 2-го уровня являются дополнительными. Они существенно обогащают информацию о функционировании соответствующей системы иммунитета.
К тестам 1-го уровня для оценки фагоцитоза относится определение:
Процесс фагоцитоза состоит из нескольких этапов: хемотаксиса, адгезии, поглощения, дегрануляции, киллинга и разрушения объекта. Их изучение имеет определенную значимость в оценке фагоцитарного процесса, так как существуют иммунодефициты, связанные с наличием поломок практически в каждом этапе. Главным итогом работы нейтрофила и моноцита является киллинг и разрушение микроба, т. е. завершенный фагоцитоз. Для оценки киллинга можно рекомендовать определение образования активных форм кислорода в процессе фагоцитоза. Если нет возможности определять активные формы кислорода с помощью хемолюминесценции, об образовании супероксидного радикала можно судить по восстановлению нитросинего тетрозолия. Но в данном случае следует помнить, что киллинг микробов в фагоците осуществляется с помощью как кислородозависимых, так и кислородонезависимых механизмов, т. е. определение активных форм кислорода не дает полной информации об этом процессе.
К тестам 2-го уровня оценки фагоцитоза можно отнести определение:
К тестам 1-го уровня оценки B-системы иммунитета можно отнести определение:
Определение уровня иммуноглобулинов — это по-прежнему важный и надежный метод оценки B-системы иммунитета. Его можно считать главным методом диагностики всех форм иммунодефицитов, связанных с биосинтезом антител.
К тестам 2-го уровня оценки В-системы иммунитета можно отнести определение:
Определение субклассов IgG представляет определенную диагностическую ценность, так как при нормальном уровне IgG могут быть дефициты по субклассам иммуноглобулинов. У таких людей в ряде случаев наблюдаются иммунодефицитные состояния, проявляющиеся в повышенной инфекционной заболеваемости. Так, IgG2 является субклассом иммуноглобулина G, который преимущественно содержит антитела против полисахаридов инкапсулированных бактерий (Haemophiluls influlenzae, Steptococculs pneulmoniae). Поэтому дефицит, связанный с IgG2, а также с IgA, ведет к повышенной заболеваемости респираторными инфекциями. Нарушения в соотношении субклассов IgA и в соотношении каппа- и лямбда-цепей также могут быть причиной иммунодефицитных состояний. Важную информацию о состоянии гуморального иммунитета дает определение антител к бактериальным белковым и полисахаридным антигенам, так как степень защиты организма от данной конкретной инфекции зависит не от общего уровня иммуноглобулинов, а от количества антител к ее возбудителю. Особенно наглядно демонстрируют это данные, свидетельствующие о том, что развитие хронических синуситов и отитов зависит только от дефицита у таких больных IgG3-антител к Moraxella catarrhalis. Другим наглядным примером важности определения специфических антител могут служить данные, доказывающие, что у лиц, страдающих частыми инфекционными процессами дыхательных путей, при нормальном уровне всех классов иммуноглобулинов существенно понижен титр антител к Haemophiluls influlenzae.
Ценную информацию о состоянии гуморального иммунитета можно получить не только при определении уровня иммуноглобулинов, их субклассов или антител к определенным антигенам, но и путем изучения их функциональных свойств. К ним в первую очередь следует отнести такое свойство антител, как аффинность, от которого в значительной степени зависит прочность взаимодействия антител с антигеном. Продукция низкоаффинных антител может вести к развитию иммунодефицитного состояния. Нами было доказано, что у лиц, часто и длительно страдающих заболеваниями дыхательного тракта, при нормальном уровне иммуноглобулинов, несколько повышенном уровне антител к пептидогликану St.aulreuls, Str.pneulmoniae, Br.catarrhalis, аффинность антител к этим микробам существенно снижена.
Важным фунцинальным свойством является опсонизирующая активность иммуноглобулинов. Как уже отмечалось, нейтрофил — это центральная фигура в защите организма от внеклеточных микробов. Однако выполнение им этой функции в значительной степени зависит от опсонизирующей активности сыворотки крови, где иммуноглобулинам и комплементу принадлежит ведущая роль в этой активности. При исследовании 30 больных с бактериемией, вызванной грамотрицательными бактериями, было установлено, что нейтрофилы этих больных обладали пониженной способностью к киллингу E.coli. Это зависело только от неспособности сыворотки крови больных к опсонизации, так как добавление к нейтрофилам этих больных сыворотки здоровых доноров полностью восстанавливало способность нейтрофилов к киллингу E.coli.
К тестам 1-го уровня оценки T-системы иммунитета можно отнести определение:
К скрининговым лабораторным тестам относится определение:
При оценке B-системы иммунитета мы рекомендовали в качестве тестов 1-го уровня определение числа B-лимфоцитов, а также и уровня иммуноглобулинов. Так как последние являются главным конечным продуктом B-клеток, то это позволяет оценить B-систему иммунитета как с количественной, так и с функциональной стороны. Такой подход пока трудно осуществить в отношении T-системы иммунитета, так как главным конечным продуктом Т-лимфоцитов являются цитокины, а системы для их определения пока еще мало доступны практическим лабораториям клинической иммунологии. Тем не менее оценка функциональной активности T-системы иммунитета представляет задачу исключительной важности, так как она может быть понижена, иногда даже существенно, при нормальном количестве T-клеток и их субпопуляций. Методы оценки функциональной активности T-лимфоцитов достаточно сложны. Простейшим из них, на наш взгляд, является реакция бласт-трансформации с применением двух основных T-митогенов: фитогемагглютинина и конканавалина А. Пролиферативный ответ T-лимфоцитов на митогены понижен практически при всех хронических инфекционно-воспалительных процессах, злокачественных заболеваниях, особенно кроветворной системы; при всех видах иммунодепрессивной терапии, при СПИД и при всех первичных T-клеточных иммунодефицитах.
С помощью скрининг-тестов можно выявить следующие виды ПИД:
К тестам 2-го уровня для оценки T-системы иммунитета мы относим определение:
Без сомнения, определение продукции цитокинов лимфоцитами и макрофагами должно стать главным методическим приемом в иммунодиагностике заболеваний, связанных с нарушениями иммунной системы. Идентификация цитокинов в ряде случаев позволит более точно установить диагноз заболевания и механизм иммунного нарушения.
Важным является и определение таких провоспалительных цитокинов, как ФНО, ИЛ-1 и гамма-интерферон. Велика их роль в этиопатогенезе различных острых и хронических воспалительных процессов как инфекционной, так и аутоиммунной природы. Их повышенное образование является главной причиной септического шока. При сепсисе уровень ФНО в крови может достигать 1 нг/мл. Накапливаются данные о роли провоспалительных цитокинов в этиопатогенезе неспецифического язвенного колита, рассеянного склероза, ревматоидного артрита, инсулинзависимого диабета и др.
Мы считаем важным для иммунодиагностики изучение экспрессии активационных молекул и молекул адгезии на поверхности T-лимфоцитов. Как указывает само название, идентификация активационных молекул дает важную информацию о степени активации T-клеток. Нарушения экспрессии рецептора для ИЛ-2 наблюдаются при многих злокачественных заболеваниях крови — T-клеточной лейкемии, волосатоклеточной лейкемии, лимфогрануломатозе и др. — и аутоиммунных процессах: ревматоидном артрите, системной красной волчанке, апластической анемии, склеродермии, болезни Крона, саркоидозе, инсулинзависимом диабете и др.
Особым, на наш взгляд, является вопрос о применении кожных проб в диагностике T-клеточных иммунодефицитов. Как уже отмечалось, по рекомендации зарубежных специалистов и в соответствии с рекомендациями экспертов ВОЗ они применяются в качестве скринирующих или тестов 1-го уровня для оценки T-системы иммунитета. Это связано с двумя обстоятельствами. Во-первых, кожные пробы — это простейшие и в то же время информативные тесты, позволяющие оценить функциональную активность T-лимфоцитов. Положительные кожные тесты с некоторыми микробными антигенами с большой степенью вероятности позволяют исключить наличие у больного T-клеточного иммунодефицита. Во-вторых, рядом западных фирм разработаны системы для постановки кожных проб, которые включают основные антигены для определения T-клеточного иммунитета. Это позволяет в строго контролируемых условиях оценить функциональную активность T-системы иммунитета. К сожалению, такие системы в России отсутствуют и, следовательно, практически не применяются для оценки T-системы иммунитета.
Оценка иммунной системы у людей с признаками ВИД может встретить ряд трудностей, и прежде всего связанных с оценкой причинно-следственных отношений. Нередко те изменения, которые регистрируются при анализе параметров иммунной системы, являются следствием, а не причиной патологического процесса. Так, у лиц, часто и длительно болеющих (ЧДБ) респираторными инфекциями, уровень антител к основным бактериальным возбудителям этих инфекций резко повышен. Аналогичная ситуация наблюдается у больных СПИД, имеющих инфекционные осложнения со стороны респираторного тракта. Естественно, что повышение титров антител к возбудителям респираторных инфекций как у больных группы ЧДБ, так и у больных СПИД является следствием активации иммунной системы в результате инфекционно-воспалительного процесса в респираторном тракте. Еще одна трудность, с которой врач может столкнуться при оценке иммунного статуса у больных с хроническими инфекционно-воспалительными процессами, — это выбор адекватного методического подхода и выбор адекватного материала для исследования. Хотя достижения теоретической и клинической иммунологии трудно переоценить и врач-иммунолог располагает большим набором современных методик для определения состояния иммунной системы, все-таки следует признать, что мы все еще мало знаем о функционировании иммунной системы в целом. Недостаточно изучена и конкретная взаимосвязь между развитием тех или иных заболеваний и нарушением различных звеньев иммунитета. Поэтому нередко при использовании стандартных методов оценки фагоцитоза, Т- и В-систем иммунитета у больных с хроническими инфекционно-воспалительными процессами врач не получает убедительной информации о нарушении иммунитета. Так, например, при определении иммунного статуса по указанным выше параметрам у больных с хроническими заболеваниями придаточных околоносовых пазух мы не выявили существенных отклонений. Вместе с тем оказалось, что у таких больных имеется дефект по синтезу IgG3-антител к Branhamella catarrhalis, и это является главной причиной развития основного патологического процесса. Как уже отмечалось, у лиц, страдающих частыми инфекционными заболеваниями бронхолегочного аппарата, повышен титр антител к возбудителям этих заболеваний. Оказалось, что аффинность этих антител у значительной части больных существенно снижена. А низкоаффинные антитела малоэффективны в элиминации возбудителя из организма, и это может быть одной из причин хронизации инфекционного процесса. Можно привести много таких примеров. Во всех этих случаях клинически имеются отчетливые признаки нарушения иммунной системы, но они не всегда убедительно подтверждаются с помощью иммунолабораторных методов исследования.
Мы предлагаем рассматривать хронические, рецидивирующие, вялотекущие, трудно поддающиеся традиционному лечению инфекционно-воспалительные процессы самых различных локализаций, выявляемые у взрослых больных, как проявление вторичного иммунодефицитного состояния, вне зависимости от того, обнаружены или нет изменения в иммунной системе с помощью использованных в данной лаборатории тестов, т. е. рассматривать в данных случаях ВИД как чисто клиническое понятие. У нас нет никаких сомнений, что наличие хронического инфекционно-воспалительного процесса является следствием какой-то поломки в одном или нескольких компонентах иммунной системы, осуществляющих защиту организма от инфекции. И если эти поломки не выявлены, то это могло быть, как только что указывалось, следствием неадекватного методического подхода, использования неадекватного материала для исследования или невозможности идентифицировать имеющуюся поломку на данном этапе развития науки. Типичным примером последнего положения может служить LAD-синдром, заключающийся в нарушении экспрессии молекул адгезии на фагоцитарных клетках. Его обнаружение стало возможным только благодаря возникновению гибридомной технологиии и появлению моноклональных антител.
В то же время мы отдаем себе отчет в том, что в основе развития спонтанной формы ВИД должны лежать какие-то конкретные причины. Чтобы рассмотреть эти причины, уместно еще раз вспомнить, что иммунитет человека является сложной многокомпонентной системой и в защите организма от инфекции участвуют факторы как врожденной резистентности, так и приобретенного иммунитета. На ранних этапах развития инфекционного процесса — в первые 96 часов — защита организма от инфекционного агента осуществляется совокупностью неспецифических факторов иммунитета, как-то: системой комплемента, белками острой фазы, монокинами, фагоцитами, естественными киллерами и т. д. Возможно, что дефект одной из этих систем может какое-то время не проявляться клинически в виде повышенной инфекционной заболеваемости, так как все другие компоненты иммунитета находятся в нормальном функциональном состоянии и компенсируют этот дефект. Однако происходящие со временем и под влиянием различных неблагоприятных факторов изменения в этих компенсаторных компонентах, пусть даже не очень значительные, могут давать кумулятивный эффект, ведущий к фенотипическому проявлению первичного дефекта и развитию повышенной заболеваемости. Можно предположить, что в основе многих, а может быть практически и всех клинических форм ВИД, проявляющихся у взрослых в виде повышенной инфекционной заболеваемости, лежит первичная иммунологическая недостаточность какого-то компонента иммунной системы, скомпенсированная до определенного времени за счет нормальной или высокой функциональной активности других компонентов этой системы. Подтверждением такой возможности может служить общая вариабельная иммунная недостаточность (ОВИН), чаще всего проявляющаяся в хронических, рецидивирующих инфекциях бронхолегочного аппарата и придаточных пазух носа. Для этого заболевания является характерным понижение уровня всех классов иммуноглобулинов. У ОВИН имеется два пика: первый пик развивается между 6-10 годами, второй — между 26-30 годами, причем до развития заболевания эти больные являются практически здоровыми людьми. Имеется немало доказательств того, что дефект гуморального иммунитета у больных ОВИН имеет генетическое происхождение. Следовательно, этот дефект до определенного времени был компенсирован за счет нормальной или повышенной функциональной активности других компонентов иммунной системы, обеспечивающих защиту организма от инфекции. Помимо ОВИН имеется ряд болезней, относящихся к ПИД, но иногда проявляющихся клинически во взрослом возрасте. К ним относятся селективный IgA-дефицит, дефицит субклассов IgG, дефицит системы комплемента. Описаны случаи первичного проявления у взрослых форм ПИД, типичных только для детского возраста. К ним относятся дефицит аденозиндезаминазы, синдром Вискотта-Олдрича, X-сцепленная агаммаглобулинемия. Как правило, в этих случаях отсроченное наступление симптомов заболевания является результатом наличия у данного индивидуума умеренного генетического дефекта. Но нельзя исключить и компенсаторной коррекции первичного дефекта за счет других компонентов иммунитета. Их изменение со временем и позволяет клинически проявиться первичному, пусть даже легкому дефекту иммунной системы.
Иммуномодулирующая терапия является неэффективной или малоэффективной при ПИД. Основные методы их лечения — это антимикробная и заместительная терапия. За рубежом применяется реконструктивная терапия, заключающаяся в пересадке больным детям костного мозга. Также интенсивно разрабатываются методы генной терапии.
Применение иммуномодуляторов более оправданно и целесообразно при ВИД. Назначение последних должно всегда проводиться на основании клинического и иммунологического обследования. В зависимости от результатов этого обследования можно выделить две группы людей:
Главным критерием при назначении иммуномодуляторов является клиническая картина. Иммуномодуляторы можно (или целесообразно) использовать в комплексной терапии больных как первой, так и второй групп. Возникает вопрос, какие конкретно иммуномодуляторы следует назначать при наличии признаков ВИД? Особенно остро этот вопрос встает у больных без выявленных отклонений в иммунной системе. Для того чтобы ответить на этот вопрос, следует кратко разобрать основные механизмы антиинфекционной защиты, так как основным проявлением иммунодефицитов, как уже отмечалось, является повышенная инфекционная заболеваемость. Первоочередная цель применения иммуномодуляторов у больных с признаками ВИД — это повышение антиинфекционной резистентности организма.
Условно все микроорганизмы можно разделить на внеклеточные и внутриклеточные. Главными эффекторными клетками в борьбе с внеклеточными возбудителями являются нейтрофилы. Их поглотительная и бактерицидная функции резко усиливаются в присутствии комплемента и IgG, а также при их активации фактором некроза опухолей — (ФНО), интерлейкином-1 (ИЛ), ИЛ-6 и другими цитокинами, продуцируемыми макрофагами, NK-клетками и Т-лимфоцитами. Главными эффекторными клетками в борьбе с внутриклеточными возбудителями являются макрофаги, NK-клетки и Т-лимфоциты. Их микробоцидные и цитотоксические свойства резко повышаются под влиянием интерферонов, ФНО, и других цитокинов, продуцируемых после активации антигенами возбудителя этих же трех популяций клеток. Первой клеткой, с которой встречается возбудитель, преодолевший слизистые или кожные покровы, является тканевой макрофаг. Макрофаг, захвативший микроб, активируется и синтезирует ряд монокинов, которые повышают функциональную активность новых моноцитов/макрофагов, нейтрофилов и NK-клеток. Этот макрофаг, расщепив с помощью своей ферментной системы микроб, представляет его антигенные детерминанты Т- и В-лимфоцитам, инициируя тем самым развитие гуморального и клеточного ответов и продуцируя некоторые цитокины, необходимые для их развития.
На основании анализа этой упрощенной схемы антиинфекционной защиты (см. рисунок) можно сделать вывод, что для ее стимуляции наиболее целесообразным является применение таких иммуномодуляторов, которые преимущественно действуют на клетки моноцитарно-макрофагальной системы (ММС). При активации этой системы приводится в движение вся совокупность специфических и неспецифических факторов защиты организма от инфекции. Ранее все иммуномодуляторы мы разбили на три группы: экзогенные, эндогенные и химически чистые или полимерные. Препараты, оказывающие преимущественное воздействие на клетки ММС, имеются во всех этих трех группах иммуномодуляторов. К высокоэффективным лечебным средствам последнего поколения с преимущественным воздействием на клетки ММС относятся полиоксидоний, ликопид, миелопид, его фракция МП-3.
Подводя итог вышесказанному, мы считаем, что использование иммуномодуляторов в комплексе с другими лекарственными средствами поможет врачам-иммунологам более эффективно лечить больных с признаками ВИД.
Об иммунодефиците в целом
Сущность любого иммунного ответа заключается в распознавании и элиминации из организма чужеродных веществ антигенной природы, как экзогенно проникающих (микроорганизмы), так и эндогенно образующихся (вирусинфицированные клетки, клетки, модифицированные ксенобиотиками, старением, опухолевые клетки и др.). Защита организма от чужеродных веществ осуществляется гуморальными и клеточными факторами врожденного и приобретенного иммунитета, которые составляют единый функциональный комплекс, дополняя друг друга и находясь в постоянном контакте и взаимодействии.
В функционировании иммунной системы, как и в любой другой системе организма, могут возникнуть нарушения, которые ведут к развитию заболеваний, характерных, прежде всего, для этой системы. К таким нарушениям относятся [20]:
Обратите внимание!
Некоторые общие принципы иммунотерапии больных с признаками ВИД