что такое коллоидные частицы
Коллоидные системы
Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями. Или это система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в другой фазе, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой.
Размеры коллоидных частиц варьируются в пределах от 0.001 до 0.1 мкм. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Содержание
Основные свойства
Основные виды
Коллоидные системы, применяемые в химическом анализе
Из коллоидных систем наибольшее значение для химического анализа имеют гидрозоли — двухфазные микрогетерогенные дисперсные системы, характеризующиеся предельно высокой дисперсностью, в которых дисперсионной средой является вода — наиболее часто применяемый в аналитической практике растворитель. Встречаются также органозоли, в которых дисперсионной средой являются неводные (органические) растворители. В результате молекулярного сцепления частиц дисперсной фазы из золей при их коагуляции образуются гели. При этом не происходит разделения фаз; другими словами, переход золей в гель не является фазовым превращением.
При образовании геля вся дисперсионная среда (например, вода в гидрозоле) прочно связывается поверхностью частиц дисперсной фазы и в ячейках пространственной структуры геля. Гели способны обратимо восстанавливать свою пространственную структуру во времени, но после высушивания наступает разрушение их структуры и они теряют эту способность.
Коллоидные свойства галогенидов серебра
mAgHal + nНаl − → [AgHal]m • nНаl −
В присутствии избытка Ag±ионов (то есть до точки эквивалентности при титровании ионов серебра галогенидами или после точки эквивалентности при титровании галогенидов ионами серебра) взвешенные частицы приобретают положительный заряд:
mAgHal + nAg + → [AgHal]m • nAg +
Например, в процессе титрования иодида калия раствором нитрата серебра
образуются мицеллы следующего строения:
б) мицеллы, образуемые AgI при избытке иодида калия <[AgI]m • nI − • (n-x)K + >x − • xK +
Анализ коллоидных систем
Существует несколько методов анализа коллоидных систем, среди них есть химические и физико-химические методы: анализ с помощью адсорбционных индикаторов; методы на основе измерения рассеяния проходящего света (нефелометрия и турбидиметрия); методы на основе измерения скорости седиментации (Седиментационный анализ), а также скорости Броуновского движения в коллоидных системах (анализ траекторий наночастиц, динамическое и статическое светорассеяние.
Холодный утренний туман, оседающий на землю, столб дыма над костром, взвешенные частицы в воде рек и озер — все это мы видели множество раз.
Нас постоянно окружают дисперсные системы
Понимание коллоидных систем важно для общего понимания образования гидроокиси железа в водоочистке и принципов фильтрации. Этот старый советский обучающий фильм отлично рассказывает о том, что такое коллоиды, как они образуются и взаимодействуют с окружающей средой. СМОТРИМ! Если смотреть не получается — читаем.
Они состоят из вещества в мелкораздробленом состоянии — дисперсной фазы и среды в которой эта фаза распределеа и которую называют дисперсионной средой.
Величина частиц и степень их дисперсности может быть различной. Сравнительно большие размеры частиц имеют грубодисперсные системы — взвеси и эмульсии.
В истинных растворах вещество находится в виде молекул или оинов распределенных равномерно среди молекул растворителя.
Частицы грубодисперсных систем хорошо видны в микроскоп. Например, молоко, представляющее эмульсию капелек жира в сыворотке, дым — это множество твердых частиц, взвешенных в воздухе.
Грубодисперсные системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды (выпадает в осадок).
По размеру частиц промежуточной положение между истинными растворами и взвесями занимают коллоидные растворы — золи.
Коллоидные частицы очень малы. И все же они могут состоять из сотен и тысяч молекул.
Свойства коллоидных растворов
Коллоидные частицы настолько малы, что не видны в обычный микроскоп. По внешнему виду коллоидный раствор нельзя отличить от истинного. Однако, если на освещенный коллоидный раствор посмотреть сбоку, то свет луча будет виден, как светлая дорожка, образовавшаяся от рассеивания света частицами. Это явление используют для распознавания коллоидных растворов.
В истинном растворе свет луча не виден, так как молекулы и ионы истинного раствора слишком малы и не рассеивают его.
В коллоидном — свет хорошо заметен. Он образует так называемый конус Тиндаля. Частицы коллоидных растворов под уадарами молекул растворителя совершают непрерывные хаотические перемещения. Это явление носит название Броуновского движения.
Из-за очень малых размеров коллоидные частицы имеют огромную суммарную поверхность.
Поверхность кубика с длинной ребра в 1 см составляет всего 6 квадратных сантиметров.. Но если 1 кубический сантиметр вещества раздробить на части объемом в 1 кубический микрон, то общая их поверхность увеличится в 10 тысяч раз. Поэтому и поглотительные свойства у коллоидных частиц проявляются значительно сильнее, чем у нераздробленного вещества.
Коллоиды
Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид) — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями и эмульсиями.
Содержание
Основные свойства
Основные виды
Коллоидные системы, применяемые в химическом анализе
Из коллоидных систем наибольшее значение для химического анализа имеют гидрозоли — двухфазные микрогетерогенные дисперсные системы, характеризующиеся предельно высокой дисперсностью, в которых дисперсионной средой является вода — наиболее часто применяемый в аналитической практике растворитель. Встречаются также органозоли, в которых дисперсионной средой являются неводные (органические) растворители. В результате молекулярного сцепления частиц дисперсной фазы из золей при их коагуляции образуются гели. При этом не происходит разделения фаз; другими словами, переход золей в гель не является фазовым превращением.
При образовании геля вся дисперсионная среда (например, вода в гидрозоле) прочно связывается поверхностью частиц дисперсной фазы и в ячейках пространственной структуры геля. Гели способны обратимо восстанавливать свою пространственную структуру во времени, но после высушивания наступает разрушение их структуры и они теряют эту способность.
Коллоидные свойства галогенидов серебра
В процессе титрования галогенид-ионов растворами солей серебра получаются галогениды серебра, весьма склонные к образованию коллоидных растворов. В присутствии избытка На1—ионов, то есть до точки эквивалентности при титровании галогенидов ионами серебра или после точки эквивалентности при титровании ионов серебра галогенидами, вследствие адсорбции Hal—ионов взвешенные частицы AgHal приобретают отрицательный заряд:
В присутствии избытка Ag+-ионов (то есть до точки эквивалентности при титровании ионов серебра галогенидами или после точки эквивалентности при титровании галогенидов ионами серебра) взвешенные частицы приобретают положительный заряд:
Таким образом, заряд взвешенной частицы [AgHal]m•nHal- или [AgHal]m•nAg+ определяется зарядом ионов, адсорбированных на поверхности ядра мицеллы [AgHal]m, и зависит от наличия в системе избытка Hal- или Ag+, обусловливающих отрицательный или положительный заряд взвешенной частицы золя. Помимо адсорбционного слоя, находящегося на поверхности ядра мицеллы и обусловливающего определенный электрический заряд, в состав мицеллы входит также часть ионов противоположного знака, образующих второй (внешний) слой ионов.
Например, в процессе титрования иодида калия раствором нитрата серебра
образуются мицеллы следующего строения:
а) мицеллы, образуемые Ag при избытке нитрата серебра: <[AgI]m• nAg+ • (n-x)NO >x+ • xNO
б) мицеллы, образуемые AgI при избытке иодида калия <[AgI]m • nI- • (n-x)K+>x- • xK+
Коллоидные частицы, несущие одноимённые электрические заряды, отталкиваются друг от друга. Силы взаимного отталкивания мешают частичкам сблизиться настолько, чтобы произошло взаимное притяжение. В то же время заряженные частички обладают высокой адсорбционной способностью, они притягивают к себе частицы, несущие обратные по знаку электрические заряды, и образуют с ними малорастворимые соединения. В первую очередь на поверхности заряженных коллоидных частиц адсорбируются те ионы, которые дают наименее растворимые осадки с ионами, входящими в состав этих частиц. Кроме того, адсорбируются те ионы, концентрация которых наибольшая. Например, при осаждении AgI могут соосаждаться вместе с ним Вr-, CI-, SCN- и другие ионы. При титровании галогенидов, не содержащих посторонних примесей, осадком адсорбируются имеющиеся в растворе На1—ионы, сообщая частичкам AgHal отрицательные заряды. И в том, и в другом случаях результаты титрования искажаются. Поэтому требуется строго соблюдать условия осаждения, рекомендуемые в методиках определения тех или иных веществ.
Анализ коллоидных систем
Существует несколько методов анализа коллоидных систем, среди них есть химические и физико-химические методы: анализ с помощью адсорбционных индикаторов; методы на основе измерения рассеяния проходящего света (нефелометрия и турбидиметрия); методы на основе измерения скорости седиментации.
Х и м и я
Коллоидная химия
Коллоидные частицы.
Коллоидные растворы
Коллоидными растворами называют микрогетерогенные дисперсные системы с частицами размером от 1 до 100 мкм. Их характеризует не только наличие поверхности раздела между дисперсной фазой и дисперсионной средой (т.е. между частицами растворяемого вещества и растворителем), но и малая устойчивость. Коллоидные растворы не образуются самопроизвольно.
Виды коллоидных частиц
Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах.
Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
1. Суспензоиды (или необратимые коллоиды),
2. Мицеллярные коллоиды (или ассоциативные коллоиды),
3. Молекулярные коллоиды (обратимые коллоиды).
Суспензоиды
Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей.
Мельчайшие частицы перечисленных веществ, имеющих молекулярную или ионную кристалические решётки, составляют дисперсную фазу суспензоидов.
От суспензий они отличаются более высокой дисперсностью.
Суспензоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности.
Необратимыми их назвали потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой.
Суспензоиды называют лиофобными коллоидами. Название происходит от греческих слов: лиос – жидкость, фобио – ненавижу. Такое название они получили из-за предположения, что дисперсная фаза в них очень слабо взаимодействует с дисперсионной средой.
Суспензоиды, как и вообще дисперсные системы, могут быть получены двумя путями:
Измельчение путём дробления, помола, истирания даёт сравнительно крупнодисперсионные прошки (> 60 мкм). Более тонкого измельчения достигают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применением ультразвука.
Метод конденсации состоит в получении нерастворимых соединений путём реакций обмена, гидролиза, восстановления, окисления.
Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы.
К конденсационным методам относится также получение лизолей путём замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая её спиртовой раствор в воду, в которой канифоль не растворима.
Мицелярные коллоиды
Их называют также полуколлоидами. Коллоидные частицы этого типа возникают при достаточной концентрации дифильных* молекул низкомолекулярных веществ путём их ассоциации в агрегаты молекул – мицеллы – сферической или пластинчатой формы.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.
Образование мицелл характерно для водных растворов моющих веществ (например, мыл – щелочных солей высших жирных кислот).
Минимальную концентрацию поверхностно-активных веществ в растворе, при которой в системе образуются устойчивые мицеллы, находящиеся в равновесии с неассоциированными молекулами поверхностно-активного вещества, называют критической концентрацией мицеллоообразования.
Молекулярные коллоиды (обратимые коллоиды)
К молекулярным коллоидам относятся природные и синтетические высокомолекулярные вещества с молекулярным весом от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц. Из-за огромного размера такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений – это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем.
Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
Растворение макромолекулярных коллоидов проходит через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа.
При набухании молекулы растворителя проникают в твёрдый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличеннии объёма полимера.
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и, часто, понижение температуры приводят к застудневанию, т.е. к превращению сильно вязкого, но всё же текучего раствора, в сохраняющий форму твёрдообразный студень.
Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студни и гели в 0,2-1% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Строение коллоидной мицеллы
Строение коллоидных частиц удобнее рассматривать, если проследить процессы их образования. Сделаем это на примере частиц AgI.
Образование коллоидной частицы AgI происходит в результате реакции:
Новообразованные частицы сначала имеют аморфное строение, затем в них постепенно происходит кристаллизация.
Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Ионы Ag + будут продолжать достраивать кристаллическую решётку ядра, прочно входя в её структуру и сообщая ему электрический потенциал.
В связи с этим ионы, достроившие кристаллическую решётку ядра, называются потенциалопределяющими ионами.
Величина электродинамического потенциала, или Е-потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3 (называемые поэтому противоионами). Начнётся процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами.
Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой (позиция 3 на рисунке выше).
Ядро и адсорбционный слой вместе составляют гранулу. Гранула имеет электрический потенциал того же знака, что и Е-потенциал, но величина его меньше и зависит от количества противоионов в адсорбционном слое.
Так, если 90% их адсорбировано, то и потенциал гранулы составит 10% от Е-потенциала.
Потенциал гранулы называется электрокинетическим или дзета-потенциалом (ζ-потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить также, как потенциал на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями. (о диффузном слое см. ниже)
Остаток противоионов удерживается электростатическими силами притяжения вблизизи гранулы, образуя диффузный слой (позиция 5 на рисунке ниже).
Гранула вместе с диффузным слоем образует мицеллу.
Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше.
Концентрация противоионов в диффузном слое убывает по направлению к переферии. Соответственно этому убывает и потенциал частицы, падая на границе дифузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Если переместить в адсорбционный слой большое количество противоионов, например 95%, электрокинетический (ζ-потенциал), измеряемый на поверхности гранулы, уменьшится до 5% от величины Е-потенциала. Величина Е-потенциала, зависящая от потенциал-определяющих ионов меняться не будет.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита и зависит от величины заряда гранулы (ζ-потенциала). Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
5.4. ДИСПЕРСНЫЕ И КОЛЛОИДНЫЕ СИСТЕМЫ
Важная роль в пищевой технологии принадлежит дисперсным и коллоидным системам и их свойствам.
Дисперсные системы гетерогенны и состоят из двух фаз. Одна из них — сплошная, называется дисперсионной средой. Другая — раздробленная и распределенная в первой, называется дисперсной фазой.
Дисперсными системами являются большинство продуктов питания, сырье и полуфабрикаты: хлеб, мука, шоколад, сыры, творог, сухое молоко, соки, шампанское, пиво, конфеты и т. п.
5.4.1. Классификация дисперсных систем
Все дисперсные системы классифицируют по степени дисперсности.
Дисперсные системы с частицами, размер которых превышает 10
3 см, относятся к грубодисперсным системам. Эти частицы при распределении в жидкости или газе, где они постепенно оседают или всплывают, наблюдаются визуально.
Дисперсные системы классифицируются не только по размерам частиц, но и по агрегатному состоянию дисперсной фазы и дисперсионнойсреды.
Сочетание трех агрегатных состояний (твердое, жидкое и газообразное) дает 9 типов дисперсных систем (см. табл. 3). Условно их обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель— дисперсионной среды. Например, обозначение Г/Ж показывает, что система состоит из газообразной дисперсной фазы и жидкой дисперсионной среды (газообразное вещество в жидкости).
Типы дисперсных систем
5.4.2. Коллоидные системы
Дисперсные системы с частицами коллоидных размеров принято называть золями (от лат. solutio — раствор).
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой — лиозолями (от греч. lios — жидкость).
По размеру частиц золи занимают промежуточное положение между истинными растворами и грубодисперсными системами — порошками, суспензиями и эмульсиями.
Коллоидные системы образуются двумя путями.
При этом необходимыми условиями образования коллоидных систем являются нерастворимость вещества дисперсной фазы в дисперсионной среде; достижение частицами дисперсной фазы коллоидной дисперсности; наличие стабилизатора, сообщающего коллоидной системе агрегативную устойчивость.
Стабилизаторами могут быть вещества, специально вводимые в дисперсионную среду, например, поверхностно-активные вещества или продукты взаимодействия дисперсной фазы с дисперсионной средой. Стабилизаторы создают вокруг коллоидных частиц адсорбционный защитный слой, препятствующий их агрегатированию.
В производстве различных пищевых продуктов диспергирование и конденсация занимают одно из ведущих мест. Это обусловлено особенностями вещества в дисперсном состоянии, которые обеспечивают удобства фасования, транспортирования, дозирования, способствуют увеличению скоростей химических и биохимических реакций и процессов растворения, сорбции, экстракции и других процессов.
Диспергирование используют при дроблении и измельчении зерна в муку, какао-бобов в какао тертое и какао-порошок, сахара в сахарную пудру, в консервной промышленности при гомогенизации плодово-ягодных пюре и т. п.
Конденсация возникает в ректификационных аппаратах при получении спирта, кристаллизации сахара, выпаривании растворов, оклейке вин и т. д.
Коллоидные системы обладают молекулярно-кинетическими свойствами, обусловленными самопроизвольным движением частиц. Это такие свойства, как диффузия, осмотическое давление и распределение частиц по высоте.
На коллоидные частицы, распределенные в дисперсионной среде, действуют две противоположно направленные силы: сила тяжести и сила диффузии. Под действием силы тяжести частицы стремятся осесть на дно — седиментировать (от латинского слова sedimentum — осадок). Силы диффузии же стремятся распределить частицы равномерно по всему объему системы. Таким образом, дисперсные системы способны сохранять определенное распределение частиц по объему. Эта способность называется седиментационной или кинетической устойчивостью.
Грубодисперсные системы кинетически неустойчивы, их частицы велики и поэтому под действием силы тяжести оседают на дно. Молекулярные системы (газы, растворы) обладают очень высокой кинетической устойчивостью. Кинетическая устойчивость коллоидных систем зависит от размеров их частиц: чем меньше размер частиц, тем более кинетически устойчива коллоидная система.
5.4.3. Микрогетерогенные системы
СУСПЕНЗИИ
Суспензии представляют собой дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К ним относятся фруктовые и овощные пасты, помадные конфетные массы, какао тертое и др.
ЭМУЛЬСИИ
Дисперсные системы, состоящие из жидкой дисперсной фазы и жидкой дисперсионной среды, называются эмульсиями. Обязательное условие образования эмульсии — нерастворимость вещества дисперсной фазы в дисперсионной среде.
Обычно эмульсии получают методом механического диспергирования. Для этого используют различные мешалки, смесители, гомогенизаторы, коллоидные мельницы и ультразвук.
Жидкости, из которых получают эмульсии, нерастворимы друг в друге и, следовательно, отличаются по своим свойствам. Практически одной из жидкостей всегда является вода, а другой — какая-либо неполярная, нерастворимая в воде жидкость, например, масло.
Эмульсии — неустойчивые системы. Неустойчивость этой системы проявляется в самопроизвольном слиянии капелек дисперсной фазы — коалесценции, что приводит к разрушению эмульсии и разделению ее на два слоя.
Устойчивость эмульсиям может придать только третий компонент — стабилизатор или эмульгатор. Роль эмульгатора в образовании устойчивой эмульсии заключается, во-первых, в том, что он адсорбируется на границе раздела фаз масло — вода (М/В) и снижает межфазное поверхностное натяжение, т. е. является поверхностно- активным веществом, а во-вторых, концентрируясь на поверхности капелек дисперсной фазы, эмульгатор образует механически прочный слой (пленку). Наличие такой защитной пленки на поверхности частиц дисперсной фазы препятствуют их слиянию, т. е. предохраняет эмульсию от коалесценции.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Эмульгаторы, растворимые в воде, способствуют образованию прямых эмульсий (М/В); эмульгаторы, растворимые в неполярных жидкостях, дают обратные эмульсии (В/М).
К представителям эмульсий относится ряд важнейших жиросодержащих продуктов, например, молоко, сливки, сливочное масло, сметана и майонез. Все это — эмульсии.
АЭРОЗОЛИ И ПОРОШКИ
Аэрозоли и порошки — это дисперсные системы, дисперсионной средой которых является газ (воздух), а дисперсной фазой могут быть твердые частицы или капельки жидкости.
Аэрозоли имеют большое практическое значение в ряде отраслей пищевой промышленности. К типичным аэрозолям относятся водяной туман, топочный дым, мучная и сахарная пыль. В ряде случаев в промышленности прибегают к искусственному получению аэрозолей. Так, для высушивания соки, пюре, молоко распыляют до мельчайших капелек в сухом горячем воздухе. Из образующегося аэрозоля благодаря его большой удельной поверхности испарение влаги идет очень интенсивно, и сушка заканчивается за 15-20 с.
Образование аэрозолей может привести к нежелательным и опасным последствиям. Так, пыль многих веществ — муки, сахара, крахмала, угля — образует с воздухом взрывоопасные смеси.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами. Однако частицы в них могут быть более крупными и достигать в диаметре 1-2 мм. Размер частиц промышленных порошков определяется их целевым назначением и часто является одним из основных показателей качества продукта. Например, дисперсность и распределение частиц по размерам в какао-порошке влияют на вкусовые качества и пищевую ценность этого продукта. Степень помола зерна оказывает влияние на качество муки.
ПЕНЫ
Высококонцентрированные дисперсные системы, в которых дисперсионная среда — жидкость, а дисперсная фаза — газ, называются пенами.
Пузырьки газа в пенах имеют большие размеры, форму многогранников и отделены друг от друга очень тонкими слоями дисперсионной среды.
Для получения пен применяют диспергационные методы: интенсивное встряхивание или перемешивание жидкости.
Устойчивую пену можно получить только в присутствии стабилизатора — пенообразователя. Это связано с тем, что поверхность жидкости, соприкасающаяся с газообразной средой, находится в особых условиях по сравнению с основной массой жидкости. Эти условия возникают потому, что молекулы поверхностного слоя жидкости в отличие от молекул, находящихся в глубине, подвергаются неодинаковому притяжению молекул жидкости и газа. Каждая молекула внутри жидкости со всех сторон притягивается соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил. В результате силы притяжения компенсируются, и равнодействующая этих сил равна нулю. У молекул поверхностного слоя часть сферы действия межмолекулярных сил находится в газовой фазе, плотность которой меньше плотности жидкости, поэтому равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно к ее поверхности. Вследствие этого поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости всегда стремится сократиться. Этим объясняются и шарообразная форма капли жидкости (шар имеет минимальную поверхность), и идеально гладкая поверхность жидкости в широком сосуде. При увеличении поверхности некоторое число молекул из глубины жидкости переходит на поверхность. Процесс переноса молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы. Работа по увеличению площади поверхности жидкости переходит в потенциальную энергию молекул поверхностного слоя— поверхностную энергию. Последняя, в свою очередь, отнесенная к единице поверхности, называется поверхностным натяжением.
Пенообразующие вещества с длинной молекулярной цепью уменьшают поверхностное натяжение, облегчают образование пены и придают ей стабильность, так как они адсорбируются на границе вода-воздух и образуют высоковязкую структурированную пленку, препятствующую стеканию жидкости. В этом случае толщина слоя жидкости между пузырьками воздуха уменьшается медленно, и пена может существовать длительное время.
Пенообразование имеет важное практическое значение. В частности, многие продукты, такие как хлеб, ряд кондитерских изделий, имеют структуру пены, что определяет их вкусовые свойства и пищевую ценность.
5.4.4. Молекулярные коллоиды (растворы высокомолекулярных соединений)
Вещества, имеющие молекулярную массу от 10000 до нескольких миллионов, называются высокомолекулярными соединениями (ВМС). Размеры макромолекул этих соединений в вытянутом состоянии могут достигать 1000 нм и более, т. е. они соизмеримы с размерами частиц ультрамикрогетерогенных (коллоидных) дисперсных систем.
Вследствие большой молекулярной массы и гибкости цепей макромолекул ВМС га растворы обладают специфическими свойствами: способностью образовывать волокна и пленки, эластичностью, набухаемостью, структурообразованием.
К важнейшим природным полимерам относятся белки и полисахариды.
По химической структуре белки являются полиамидами, исходными мономерами для их синтеза служат а-аминокислоты.
Полисахариды представляют собой соединения, состоящие из многих сотен и даже тысяч моносахаридных звёньев. К наиболее важным полисахаридам относятся крахмал, целлюлоза, пектин и др.
Растворы ВМС по своим свойствам аналогичны коллоидным системам. Так же, как и у коллоидных растворов, у них сравнительно невелика скорость диффузии, небольшое осмотическое давление, они не проходят через полунепроницаемые мембраны.
В отличие от золей растворы ВМС образуются самопроизвольно и не нуждаются в стабилизаторе.
Растворению ВМС предшествует его набухание.
Набухание — это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением массы и объема последнего. Набухание часто является начальным этапом растворения высокомолекулярных веществ.
Существует ограниченное и неограниченное набухание. При ограниченном набухании объем и масса полимера достигают определенных значений, и дальнейший контакт полимера с растворителем не приводит к каким-либо изменениям. Ограниченно набухший полимер называется студнем. У неограниченного набухания отсутствует предел набухания; с течением времени полимер поглощает все большее количество жидкости и набухание переходит в растворение.
Причиной набухания является диффузия молекул низкомолекулярного растворителя в высокомолекулярное вещество. Между макромолекулами полимера обычно имеются небольшие промежутки, размер которых соизмерим с размером молекул растворителя. Благодаря этому молекулы низкомолекулярной жидкости достаточно быстро проникают между макромолекулами, раздвигая молекулярные цепи.
Набухание включает не только простую диффузию, но и сольватацию макромолекул, т. е. взаимодействие молекул растворителя с молекулами полимера.
При взаимодействии высокомолекулярного вещества с полимером сольватируется не вся макромолекула. Если растворитель полярен, то сольватируются полярные группы, если неполярен — то сольватируются неполярные группы. В зависимости от того, каких групп в полимере больше, он будет быстрее набухать в полярном или неполярном растворителе. Обычно набухание — избирательное явление, так как полимер набухает в жидкостях, близких к нему по химическому строению. Так, углеводородные полимеры типа каучук набухают в неполярных жидкостях — бензине, бензоле. Полимеры, в состав молекул которых входят полярные группы, набухают в воде и спиртах.
Чаще всего жидкой дисперсионной средой в пищевых производствах служит вода. При этом следует учитывать, что часть воды находится в свободном состоянии, а часть — в связанном.
В системах, в состав которых входят биополимеры (высокомолекулярные природные соединения — белки, полисахариды), часть воды, прочно связанная с поверхностью этих макромолекул, образует гидратную оболочку. Например, 1 г яичного альбумина связывает 0,25 г воды, образуя гидратный слой толщиной 0,25 нм.
Свободная же вода служит реакционной средой и растворителем веществ. При участии гидролитических ферментов она вступает во множество реакций, в результате которых образуются новые вещества. Таким образом, свободная вода является и активным участником биохимических реакций.
Мука, состоящая главным образом из сухих протеиновых гелей и крахмальных зерен, при замешивании теста (при взаимодействии с водой) проявляет коллоидные свойства.
Крахмал муки, смоченный водой при комнатной температуре, может адсорбционно связать 35-40% влаги. При более высокой температуре и достаточном количестве воды связывание крахмала с водой увеличивается, и при температуре 60°С и избытке воды происходит процесс клейстеризации крахмала, т. е. нарушение структуры крахмальных зерен и образование коллоидного раствора.
Крахмал, смоченный водой в любом соотношении и в любых условиях, не образует связного теста.
Ведущая роль в образовании теста принадлежит белкам пшеничной муки.
Белки способны набухать в холодной воде и удерживать воду в количестве в 2-2,5 раза больше своей массы. При замешивании теста из пшеничной муки белки при достаточном количестве воды легко и сравнительно быстро (через 3-5 мин) образуют тончайшие нити и пленки, связывающие и склеивающие между собой зерна увлажненного крахмала. Благодаря этому пшеничное тесто приобретает упруговязкопластичные свойства, какими не обладает тесто из других злаков.
Крахмал муки состоит из двух основных фракций — амилозы и амилопектина. Амилоза содержится внутри крахмальных зерен, а амилопектин образует их наружную оболочку. Амилоза отличается меньшей величиной частиц и меньшей молекулярной массой (около 80000), а амилопектин — большей величиной частиц и большей молекулярной массой (115000). Это позволяет рассматривать зерно крахмала как осмотическую ячейку, внутри которой находится растворимая низкомолекулярная фракция — амилоза, обусловливающая избыточное осмотическое давление и приток воды внутрь ячейки.
Гидратация муки при разных температурах зависит от поведения белков и крахмала. В температурном интервале 25-40°С гидратация муки происходит преимущественно за счет белков клейковины. Повышение температуры до 60°С приводит к резкому усилению этого процесса в результате значительного увеличения гидратации крахмала при понижении этой способности у белков клейковины.
Таким образом, набухание пшеничной муки при низкой температуре (25-40°С) в основном протекает вследствие осмотического набухания бежов, а при более высокой температуре (60°С) — в результате осмотического связывания воды крахмалом.
В связи с этим схему образования теста можно представить в следующем виде.
Белки, содержание которых в пшеничной муке составляет 10- 20%, при температуре замеса около 30°С поглощают незначительное количество воды путем взаимодействия гидрофильных групп белка с водой, а значительное количество воды диффундирует внутрь белка в результате наличия в нем избыточного осмотического давления.
Крахмал, содержание которого в пшеничной муке достигает 70%, при той же температуре теста поглощает до 30% воды благодаря активности гидрофильных групп. Так как крахмал количественно преобладает в муке, то содержание влаги, связанное крахмалом и белками клейковины, приблизительно одинаково.
При неограниченном оводнении коллоидов муки часть воды находится в свободном состоянии в капиллярах теста. Незначительная часть растворимых белков, а также сахара и неорганические соли находятся в растворе.
Набухшие белки во время замеса плотно соприкасаются друг с другом и образуют сплошную белковую сетку с адсорбционно связанными с ними, слабо набухшими крахмальными зернами. В белковую сетку, кроме того, входят другие нерастворимые вещества. Это приводит к образованию массы (теста), обладающей упруговязкопластичными свойствами.
Недостаточное количество воды при замесе теста приводит к получению несвязной массы увлажненного сырья. При избыточном количестве воды, добавляемой к муке, не образуется связного теста, а получается мучная болтушка, в которой частицы набухшего белка разделены водными оболочками, препятствующими соприкосновению их и образованию клейковинных нитей.
Тесто, используемое для мучных кондитерских изделий, — более сложный комплекс, так как в состав его кроме муки и воды входят и другие виды сырья, в первую очередь сахар и жир, влияющие на набухаемость коллоидов муки.
Сахар, присутствующий в кондитерском тесте в виде водного раствора, оказывает влияние на степень набухания белков клейковины. С увеличением концентрации сахара степень набухания белков снижается.
Жир, адсорбируясь на поверхности белков, образует пленки, препятствующие проникновению воды внутрь макромолекул белков, что ослабляет связь между ними, при этом уменьшается упругость и увеличивается пластичность теста.
Таким образом, регулируя количество сахара и жира, добавляемых при замесе теста, можно получать тесто с определенными физическими свойствами.
5.4.5. Структурообразование в дисперсных системах
Одно из важных свойств дисперсных систем и растворов ВМС — способность их к структурообразованию.
Коллоидные системы, частицы которых удалены друг от друга на достаточно большое расстояние и практически не взаимодействующие между собой, называются свободнодисперсными системами. Такие коллоидные системы по своим свойствам похожи на обычные жидкости. Их вязкость очень мало отличается от вязкости дисперсионной среды.
Дисперсные системы, в которых частицы связаны между собой и не способны к взаимному перемещению, называются связнодис- персными системами. В таких системах частицы дисперсной фазы образуют пространственную сетку или структуру.
Рассмотрим процесс структурообразования на примере пектина при производстве фруктового желе.
Желеобразная консистенция фруктовых консервов достигается благодаря присутствию в сырье пектина, который образует в сахарокислотном растворе пространственную сетку. Пектин при нагревании образует коллоидные растворы. На поверхности молекул пектина адсорбированы молекулы воды, которые создают сольватную (водную) оболочку вокруг частиц пектина. Это препятствует соединению пектиновых молекул для образования пространственной сетки. Для формирования желе необходимо присутствие наряду с пектином Сахаров и кислот.
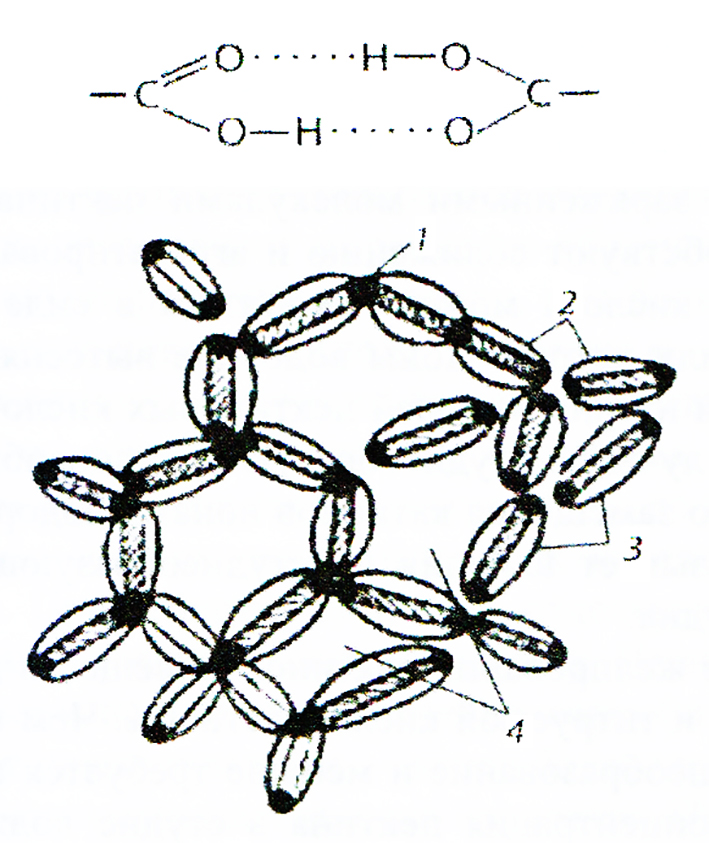
Сила притяжения частиц пектина сосредоточена по краям молекулы. Соединение частиц концами приводит к образованию пространственной сетки, которая охватывает весь объем продукта и служит каркасом студня (см. рис. 25). Укрепление сетки происходит за счет водородных мостиков, которые образуются между карбоксильными и гидроксильными группами соседних пектиновых молекул.
Образовавшиеся ячейки внутри заполнены жидким сахарокислотным раствором. По мере остывания студня тепловое движение замедляется и продолжается процесс укрупнения студня, т. е. сближение молекул и образование цепей. Чем выше концентрация пектина, тем легче сближение молекул и прочнее их сцепление и тем быстрее идет застудневание.
Механическое воздействие на студень при его остывании ослабляет его прочность. Но при нагревании структура студня может быть восстановлена. Это свойство пектиновых студней называется тиксотропией.
Пектино-сахаро-кислотный студень — упруго-эластичная система, в которой каждый компонент выполняет свои функции.
Схема сцепления частиц пектина в желе:
1 — концевые участки, свободные от зарядов; 2 — частицы пектина; 3 — соль- ватные оболочки;
4 — петли пектиновой сетки с дисперсионной средой.
Каркас студня составляет пектин, поэтому прочность студня будет зависеть от вида и качества пектина. Лучше и прочнее студень образуется в присутствии высокометоксилированного пектина, который имеет длинную цепочку с числом метоксильных групп более 70%. Значение имеет также общее содержание пектина в сырье и его природа. Наилучшей желирующей способностью обладает пектин яблок, крыжовника, черной смородины, кожуры цитрусовых. Концентрация пектина должна быть около 1%.
Количество сахара, которое требуется для образования студня, зависит от свойств и количества применяемого пектина. Чем больше пектина и выше его желирующие свойства, тем больше требуется сахара для студнеобразования. Максимальное количество сахара, которое может быть использовано для образования студня, — показатель «сахароемкости» пектина. Он определяет студнеобразующую способность и измеряется в градусах. Это масса сахара, приходящаяся на единицу массы пектина. Для пектина средней студнеобразующей способности содержание сахара должно быть близким к насыщенному раствору при комнатной температуре, т. е. 65%.
Еще один компонент пектинового студня — кислота. Она определяет рН студня. Чем больше диссоциирована кислота, тем более она способствует образованию агрегатов пектиновых молекул, так как при диссоциации кислоты в растворе появляются свободные положительно заряженные ионы водорода (Н + ). Они взаимодействуют с отрицательно заряженными молекулами пектина, нейтрализуют их заряд и способствуют сближению и агрегатированию. Полиметилга-лактуроновая кислота может находиться в виде слаборастворимых солей калия или натрия. Ионы водорода вытесняют и замещают катионы калия и натрия из солей пектиновых кислот, а пектиновые кислоты имеют лучшую студнеобразующую способность, чем их соли. После полного замещения катионов ионами водорода добавление кислоты не оказывает влияния на студнеобразующую способность и прочность студня.
Хорошее желирование пектиновых веществ достигается при рН среды 3,0-3,4 и титруемой кислотности 1%. Чем ниже рН, тем быстрее идет студнеобразование и меньше требуется пектина. Например, при рН 3,1 концентрация пектина в студне должна быть не менее 0,7%, при рН 3,-0,8%, при рН 3,-0,9%. При рН более 3,5 студень образуется непрочный.
Используя способность ВМС к образованию студней, можно получить более сложные дисперсные системы, например, пенообразные кондитерские массы (пастилу). Эти изделия являются в основном агаровым студнем. Он имеет пористую структуру с ячейками микроскопических размеров (до 20 мкм).
В пастильном студне распределены мелкие воздушные пузырьки, и готовая сухая пастила напоминает по своей структуре твердый крем. В производстве пастилы процесс обычного студнеобразования мармелада сочетается с процессом пенообразования (сбивания) яблочно-сахарной смеси.
При сбивании пастилы путем продолжительного встряхивания яблочно-сахарной смеси происходит вспенивание ее, т. е. масса насыщается воздухом; при этом воздух захватывается яблочно-сахарной массой и дробится на мелкие частички. По мере увеличения скорости механического взбалтывания степень раздробленности воздуха увеличивается, размеры пузырьков воздуха уменьшаются, а вязкость массы повышается. Постепенно образуется густая пена, состоящая из мелких пузырьков воздуха, затянутых в тонкую пленку из окружающей полужидкой яблочно-сахарной смеси.
В физико-химическом смысле пена представляет собой двухфазную систему газ-жидкость. В данном случае дисперсной фазой является газ-воздух, а дисперсионной средой — полужидкий раствор сахара, кислоты и пектина. Этот раствор образует оболочку дисперсных частиц газа (воздуха), которая несет на себе поверхностный пограничный слой, отделяющий одну фазу от другой.
В процессе образования пены происходит сильное развитие поверхности раздела на границах газообразной и жидкой фаз. Увеличение поверхности раздела зависит от размеров образующихся воздушных ячеек. Чем меньше размеры последних, тем больше эта поверхность, тем больше сила поверхностного натяжения o.
Сила поверхностного натяжения всегда стремится сократить до минимума общую поверхность раздела всей системы, сделать ее наименьшей. В данном случае она стремится сократить до возможных пределов общую сумму поверхностей отдельных капелек, образующих пенную эмульсию. При действии этой силы отдельные пузырьки воздуха в пене стремятся соединиться в одну массу. Пленка капелек прорывается, отдельные капельки, постепенно сливаясь (агрегируясь) друг с другом, образуют новые пузырьки — капли более крупных размеров, степень дисперсности уменьшается, пена «опадает». Процесс самопроизвольного разрушения пены и эмульсии называется коалесценцией.
В пенах процесс коалесценции идет весьма интенсивно благодаря близкому расположению капелек по отношению друг к другу.
Чтобы сделать пену более устойчивой, стабилизировать ее, в качестве пенообразующего средства (ПАВ) при сбивании пастилы обычно используют белок куриного яйца, который, располагаясь в поверхностном слое пленки пузырьков пены, увеличивает механическую прочность этого слоя и тем самым препятствует прорыванию пленки пузырьков и агрегированию последних.
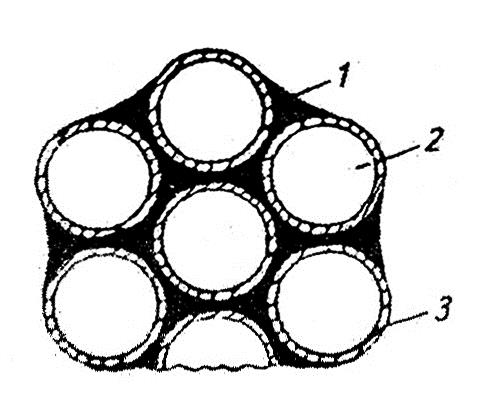
Механизм совмещения студневой и пенной структур при смешивании сбитой массы с агаровой (или мармеладной) можно представить так: при смешивании с холодной сбитой массой горячая масса агарового сиропа или мармелада заполняет воздушные пространства между пузырьками сбитой массы, вытесняя оттуда воздух (см. рис. 26).
При этом прочность пленки структурных элементов массы значительно увеличивается. Последняя возрастает благодаря тому, что температура всей массы поднимается до 50°С и адсорбированный альбуминовый гель пленки при указанной температуре, близкой к свертыванию альбумина, фиксируется в ней в виде плотного коагулята. Одновременно же по мере остывания массы в пространстве между пузырьками происходит формирование прочного агарового (или пектинового) студня. Смешивание сбитой массы с горячей желейной (или мармеладной) массой создает, таким образом, необходимые условия для образования структуры пастилы.
Схема совмещения пенной и студневой структур пастилы:
1 — агаро-сахаро-водный студень; 2 — воздух; 3 — пектино-белково-сахаро- водная пленка.
После остывания массы получается характерный пастельный студень, который отличается от мармеладного только пористой структурой благодаря мельчайшим воздушным включениям, равномерно распределенным в его массе.