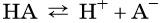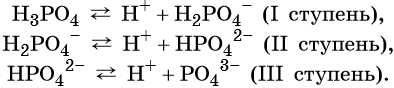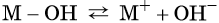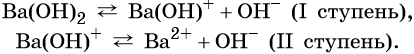что такое катион и анион в химии
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Многоосновные кислоты диссоциируют ступенчато, например:
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
10. Степень диссоциации слабых электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Что такое катион и анион в химии
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Что такое катион и анион в химии
7.1. Что такое химические связи
В предыдущих главах вы познакомились с составом и строением изолированных атомов различных элементов, изучили их энергетические характеристики. Но в окружающей нас природе изолированные атомы встречаются крайне редко. Атомы почти всех элементов » стремятся» соединиться, образуя молекулы или другие более сложные химические частицы. Принято говорить, что при этом между атомами возникают химические связи.
Химические связи – взаимодействия, которые соединяют атомы в единые более сложные химические частицы.
В образовании химических связей участвуют электроны. Каким образом это происходит, вы узнаете, изучив эту главу. Но прежде нам надо ответить на вопрос, почему атомы образуют химические связи. На этот вопрос мы можем ответить, даже не зная ничего о природе этих связей: » Потому что это энергетически выгодно!» А вот, отвечая на вопрос, откуда при образовании связей возникает выигрыш в энергии, мы постараемся понять, как и почему химические связи образуются.
Как и электронное строение атомов, подробно и строго научно химические связи изучает квантовая химия, а мы с вами можем только воспользоваться некоторыми важнейшими выводами, сделанными учеными. При этом для описания химических связей мы будем пользоваться одной из простейших моделей, предусматривающей существование трех типов химической связи (ионной, ковалентной и металлической).
Вспомните – грамотно пользоваться любой моделью можно, только зная границы применимости этой модели. Модель, которой мы будем пользоваться, тоже имеет свои границы применимости. Например, в рамках этой модели нельзя описать химические связи в молекулах кислорода, большинства бороводородов и некоторых других веществ. Для описания химических связей в этих веществах используют более сложные модели.

7.2. Типы химических связей
Чтобы понять, за счет чего может возникнуть выигрыш в энергии, рассмотрим систему, состоящую из двух разноименно заряженных частиц а– и б + (рис. 7.1). Расстояние между частицами l (состояние I). Так как разноименно заряженные частицы притягиваются, то такая система обладает потенциальной энергией, которая может выделиться при сближении этих частиц. В результате система перейдет в состояние II с меньшей энергией. Именно это и происходит при образовании химической связи между ионами. Ведь получившиеся разноименно заряженные ионы притянутся друг к другу, между ионами возникнет ионная связь и образуется ионный кристалл. Выигрыш в энергии при образовании связи компенсирует затраты на образование ионов.
Если же у атомов близкие склонности отдавать (или принимать) электроны, то передать электроны друг другу они не могут, и им остается только попытаться использовать и свои, и чужие электроны совместно, не отдавая и не принимая их полностью. Это – вторая возможность атома образовать завершенную электронную оболочку. В этом случае при образовании связи также компенсируются все энергетические затраты, но причины здесь более сложные.
Посмотрим, в каких случаях и как атомы осуществляют эти возможности.
Электронные
формулы
исходных атомов
Уравнения
передачи
электронов
Электронные
формулы
образующихся ионов
Структурная
формула
вещества(*)
Простейшая
формула
вещества
Cl – [Ne]3s 2 3p 5
(Na

Br – [Ar,3d 10 ]4s 2 4p 5
Br + e– = Br–
(Ca 2 

CaBr2
S – [Ne]3s 2 3p 4
S + 2e– = S 2–
(Fe2

*)В структурных формулах веществ с ионными связями указываются формальные заряды: 


1. Если связываемые атомы сильно отличаются по размерам, то маленькие атомы (склонные принимать электроны) отнимут электроны у больших атомов (склонных отдавать электроны), и образуется ионная связь. Энергия ионного кристалла меньше, чем энергия изолированных атомов, поэтому ионная связь возникает даже тогда, когда атому не удается, отдавая электроны, полностью завершить свою электронную оболочку (незавершенным может остаться d— или f-подуровень). Рассмотрим примеры.
2. Если связываемые атомы маленькие(ro 1А), то все они более или менее склонны отдавать свои электроны, а склонность принимать чужие электроны у них незначительна. Поэтому образовать между собой ионную связь эти большие атомы тоже не могут. Ковалентная связь между ними также оказывается невыгодной, так как электронная плотность в больших по размеру внешних электронных облаках незначительна. В этом случае при образовании из таких атомов химического вещества происходит обобществление валентных электронов всех связываемых атомов (валентные электроны становятся общими для всех атомов), и образуется металлический кристалл (или жидкость), в котором атомы связаны металлической связью.
Как определить, связи какого типа образуют атомы элементов в определенном веществе?
По положению элементов в естественной системе химических элементов, например:
1. Хлорид цезия CsCl. Атом цезия (IА группа) большой, легко отдает электрон, а атом хлора (VIIА группа) маленький и легко его принимает, следовательно, связь в хлориде цезия ионная.
2. Диоксид углерода CO2. Атомы углерода (IVА группа) и кислорода (VIА группа) не сильно отличаются по размерам – оба маленькие. По склонности принимать электроны они отличаются незначительно, следовательно связь в молекуле CO2 ковалентная.
3. Азот N2. Простое вещество. Связываемые атомы одинаковые и при этом маленькие, следовательно, связь в молекуле азота ковалентная.
4. Кальций Са. Простое вещество. Связываемые атомы одинаковые и довольно большие, следовательно связь в кристалле кальция металлическая.
5. Барий-тетраалюминий BaAl4. Атомы обоих элементов достаточно велики, особенно атомы бария, поэтому оба элемента склонны только отдавать электроны, следовательно, связь в этом соединении металлическая.

2.Почему благородные газы состоят не из молекул, а из атомов?
3.Определите тип химической связи в бинарных соединениях: а) KF, K2S, SF4; б) MgO, Mg2Ba, OF2; в) Cu2O, CaSe, SeO2. 4.Определите тип химической связи в простых веществах: а) Na, P, Fe; б) S8, F2, P4; в) Mg, Pb, Ar.
7.З. Ионы. Ионная связь
В предыдущем параграфе вы познакомились с ионами, которые образуются, когда отдельные атомы принимают или отдают электроны. В этом случае число протонов в атомном ядре перестает быть равным числу электронов в электронной оболочке, и химическая частица приобретает электрический заряд.
Но в состав иона может входить и не одно ядро, как в молекуле. Такой ион представляет собой единую систему, состоящую из нескольких атомных ядер и электронной оболочки. В отличие от молекулы общее число протонов в ядрах не равно общему числу электронов в электронной оболочке, отсюда – электрический заряд иона.
Какие бывают ионы? То есть, чем они могут различаться?
По числу атомных ядер ионы делятся на простые (или одноатомные), то есть содержащие одно ядро (например: K



По знаку заряда ионы делятся на катионы и анионы.
Катионы – положительно заряженные ионы
Анионы – отрицательно заряженные ионы.
Примеры катионов: K 







По значению заряда ионы делятся на однозарядные (K 








Итак, ион РО4 3 

Кроме этого, ионы различаются еще и своими размерами. Размер простого иона определяется радиусом этого иона или ионным радиусом. Размер сложных ионов охарактеризовать труднее. Радиус иона, как и радиус атома, непосредственно измерить невозможно (как вы понимаете, четких границ у иона нет). Поэтому для характеристики изолированных ионов используют орбитальные ионные радиусы (примеры – в таблице 17).