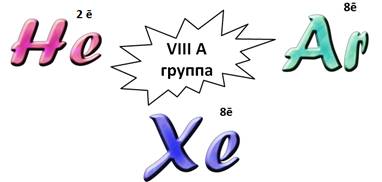что такое ионная связь в химии 8 класс
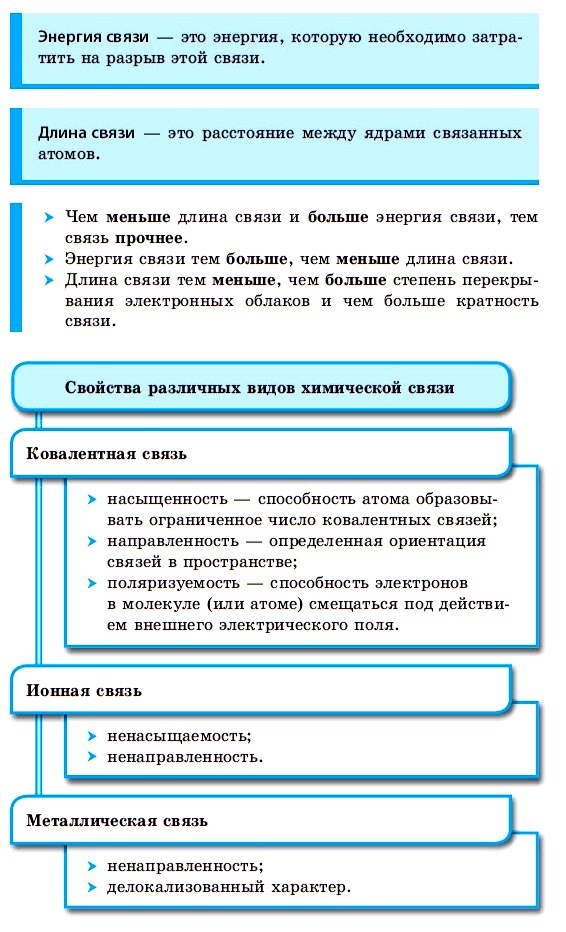
Ионная связь.
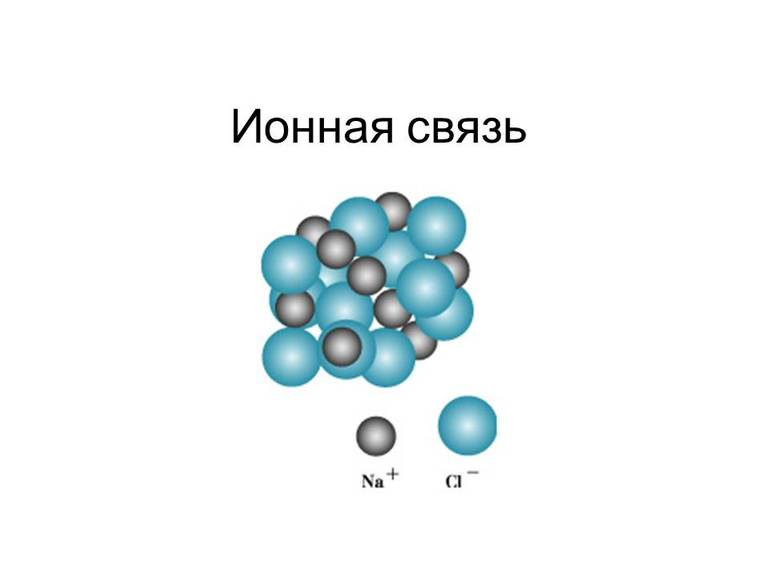
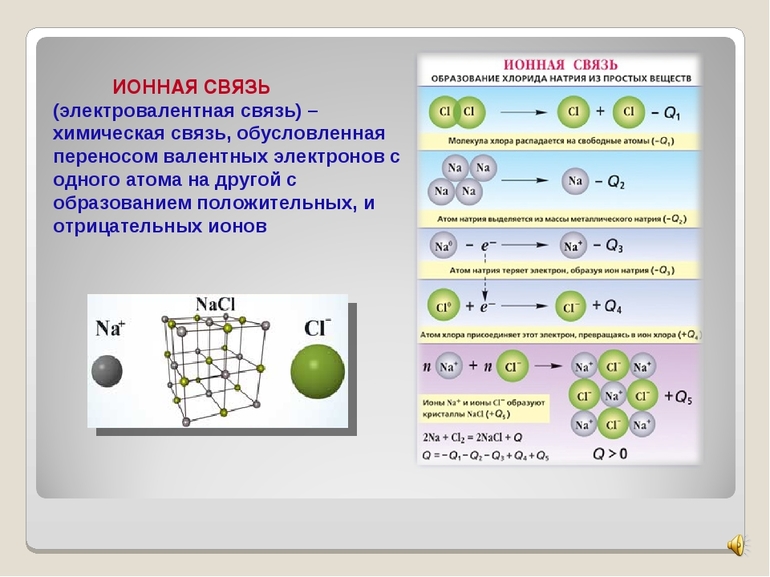
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 



Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 



По значению заряда ионы подразделяются на:
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
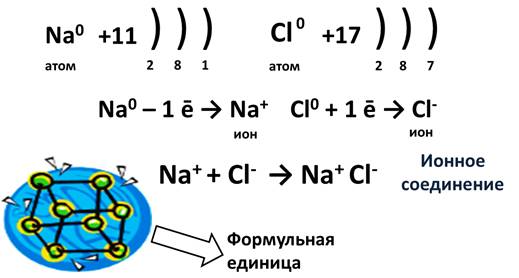
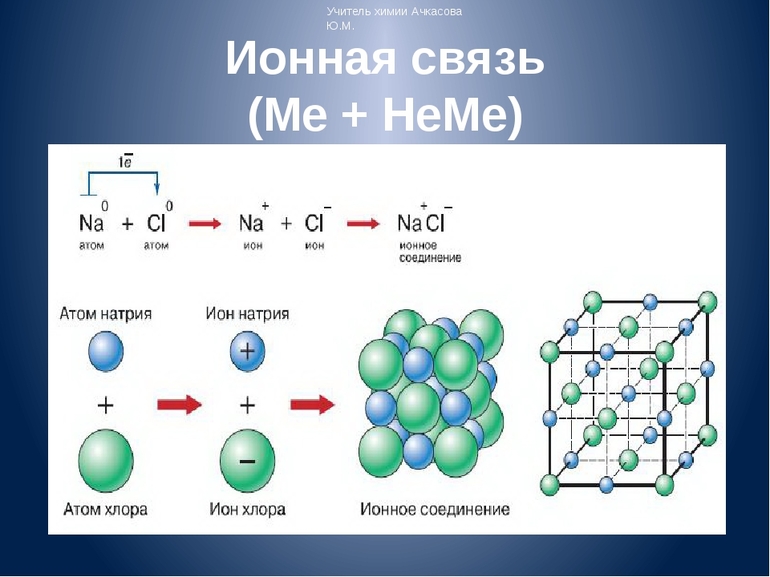
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.
Для ионной связи характерно:
Пример. Схема образования ионного соединения:



Ионная связь
Урок 9. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Ионная связь»
Прежде, чем узнать, что такое ионная связь и как она образуется, побываем в одной удивительной стране.
Народ этой страны был беден, но беспечен. Хотя в карманах у большинства из них не было ни одной свободной монеты (а «валюта» в этой стране называлась электронами), никто не горевал по этому поводу. Напротив, если у них заводился хоть один лишний электрон, то характер их портился, они становились агрессивными и даже опасными, потому скорее хотели от него избавиться, чтобы стать опять добрыми и веселыми.
Надо сказать, что «высшая знать» этой страны отличалась от простых граждан своей скупостью. Свою «электронную валюту» они неохотно одалживали, и, наоборот, при малейшей возможности стремились забрать еще.
Давайте теперь разберёмся, кто же такие были «простые жители», а кем бала «знать».
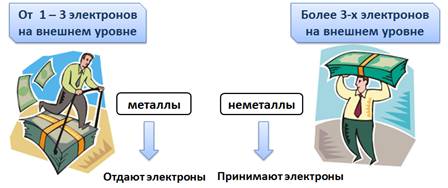
Речь в истории шла об элементах металлах и неметаллах. Разберёмся почему.
У атомов металлов на внешнем уровне всегда мало электронов (от одного до трех), естественно, что им легче отдать электроны для завершения энергетического уровня, а для неметаллов, у которых более трех электронов, легче присоединить электроны для завершения энергетического уровня.
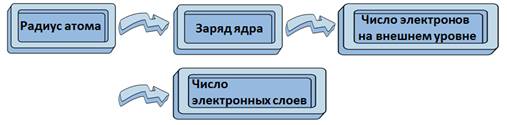
Главной характеристикой атома является заряд его ядра, от которого зависит и радиус атома. Чтобы определить число электронов на внешнем уровне достаточно знать номер группы.
Теперь, составим логическую цепочку: радиус атома зависит от заряда ядра, числа электронов на внешнем уровне, числа электронных слоев.
Рассмотрим, как изменяются металлические и неметаллические свойства по периодам и группам периодической системы.
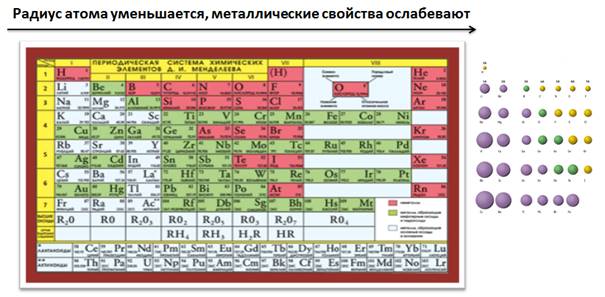
В периодах слева направо увеличивается заряд ядра, радиус атома постепенно уменьшается, увеличивается число электронов на внешнем уровне, которые сильнее притягиваются к положительно заряженному ядру, и атомам становится легче присоединить электроны до завершения уровня, чем отдать их, поэтому металлические свойства ослабевают, а увеличиваются неметаллические.
В Периодической таблице каждый период начинается металлом IA группы (это типичные металлы) и заканчивается неметаллом, в VIIA группе уже находятся типичные неметаллы.
В пределах одной группы главной подгруппы, сверху вниз увеличивается заряд ядра атома, увеличиваются радиусы атомов, число электронов на внешнем уровне остается постоянным, но увеличивается число энергетических уровней, и электроны будут удаляться от ядра, поэтому атомам их легче отдать, чем присоединить до завершения внешнего уровня, следовательно, металлические свойства будут увеличиваться, а неметаллические ослабевать. Поэтому атомы элементов, расположенные внизу в пределах одной группы, будут проявлять более металлические свойства, нежели которые находятся вверху.
Элементы VIIIА группы называют благородными или инертными газами. У всех этих атомов завершен энергетический уровень, для любого атома – это устойчивое состояние. Поэтому они не отдают и не присоединяют электроны. Они практически не соединяются с другими атомами и друг с другом, т.е. они инертны.
Представьте себе, встречается элемент IA группы, у которого 1 электрон, и элемент VIIA группы, у которого 7 электронов. Пусть это будут Na и Cl. У натрия один единственный электрон, а хлору как раз не хватает одного электрона для завершения внешнего уровня. Если натрий отдаст свой электрон, то он приобретет положительный заряд, а когда атом хлора заберет этот электрон, он превратится в отрицательно заряженную частицу. Эти заряженные частицы, называются ионами. Из курса физики известно, что разноименные заряды притягиваются, поэтому ион натрия и хлора соединятся и между ними возникнет химическая связь. Эта связь и будет называться ионной. В результате этого взаимодействия образуется ионное соединение. Для выражения этих ионных соединений пользуются формульными единицами, т.е. говорят не молекула NaCl, а формульная единица NaCl.
Ионная связь образуется между типичным металлом и типичным неметаллом.
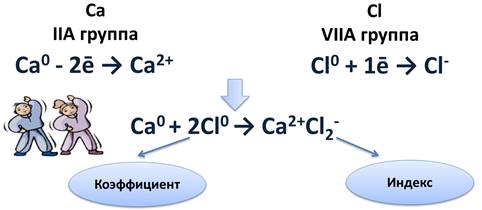
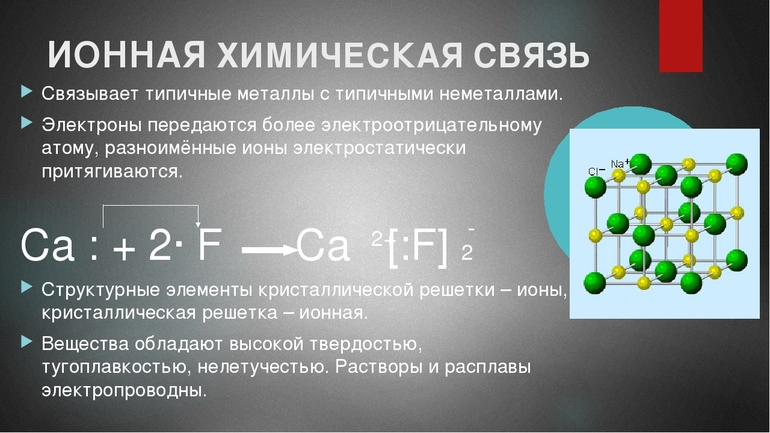
Схема образования ионной связи между атомами кальция и хлора
Кальций расположен во IIA группе, значит, на внешнем энергетическом уровне у него два электрона, которые легче отдать, чем присоединить шесть до завершения энергетического уровня. После чего он становится положительным ионом.
Атому хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона, атом хлора становится отрицательным ионом.
Найдём наименьшее общее кратное между образовавшимися ионами. Оно равно двум. Следовательно, нужно взять 1 атом кальция и 2 атома хлора. Это схематично можно показать так:
Цифра 2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент обычно показывает число атомов, молекул или формульных единиц, а цифра 2 после иона хлора, называется индексом. Индекс показывает число атомов в молекуле или ионов в формульной единице.
Возвращаясь истории, нетрудно догадаться теперь, почему «простыми» жителями были металлы, а «знатью» неметаллы.
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
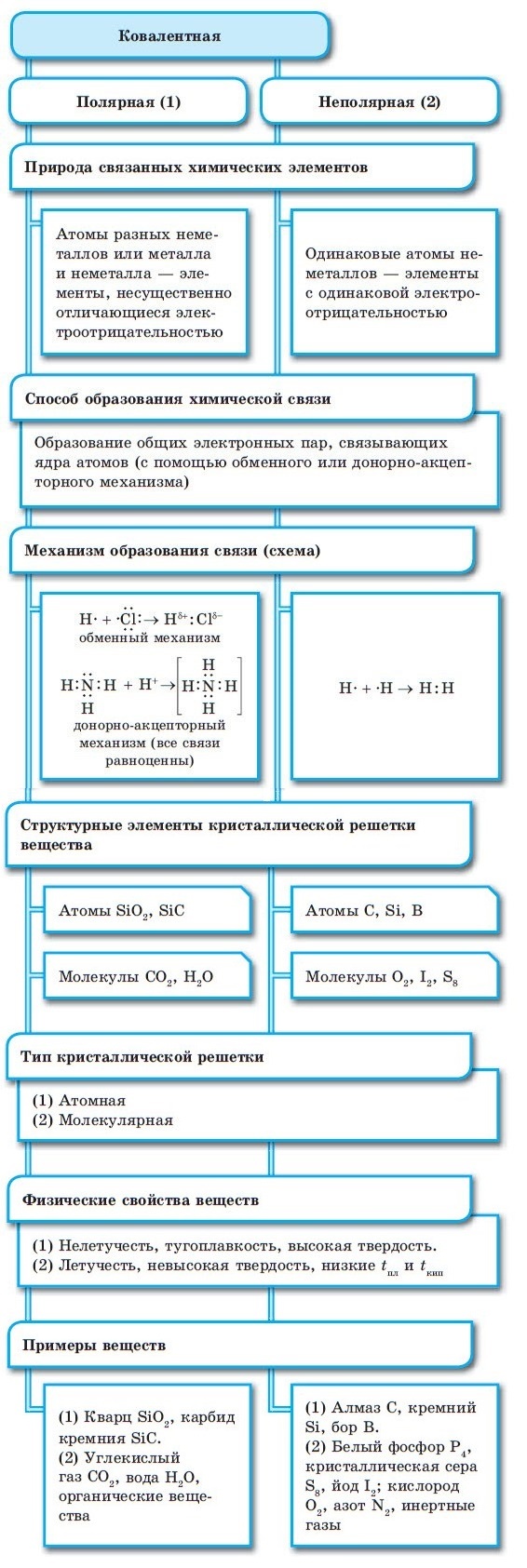
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
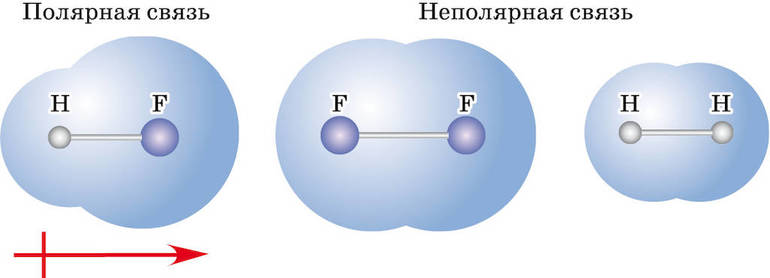
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.
Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na 0 )2e)8e)1e + Cl 0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na 0 + Cl 0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи
Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Что такое ионная связь в химии 8 класс
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
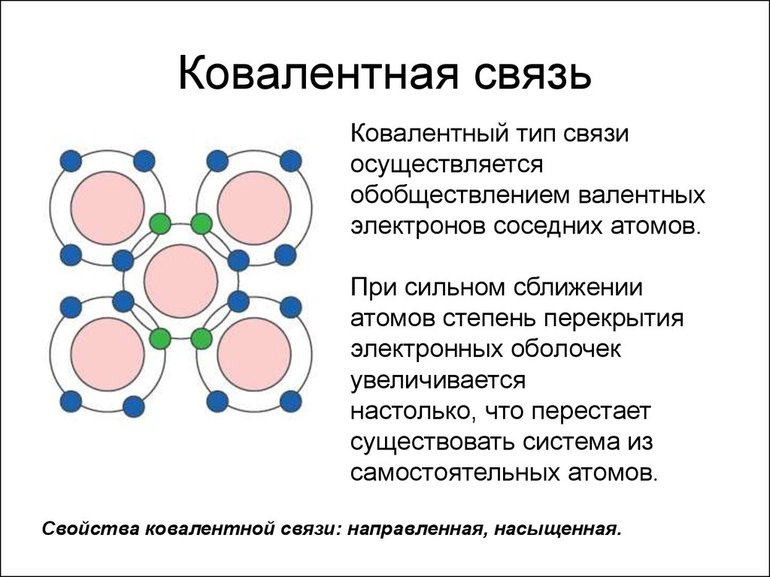
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
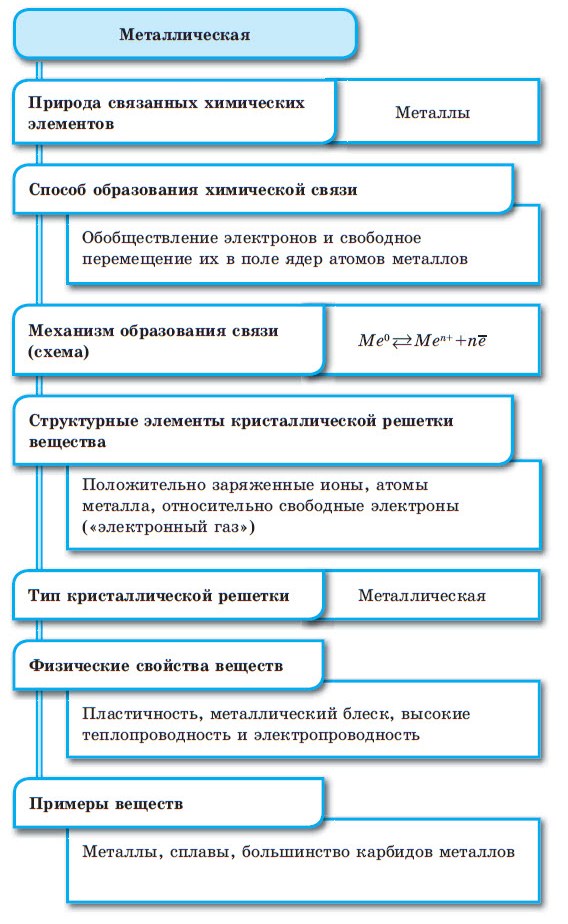
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».