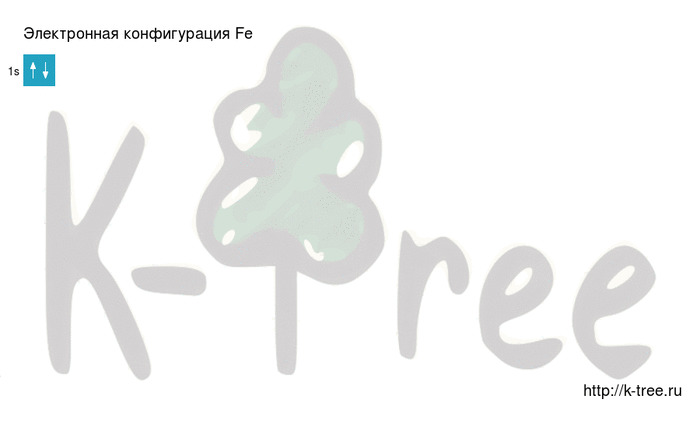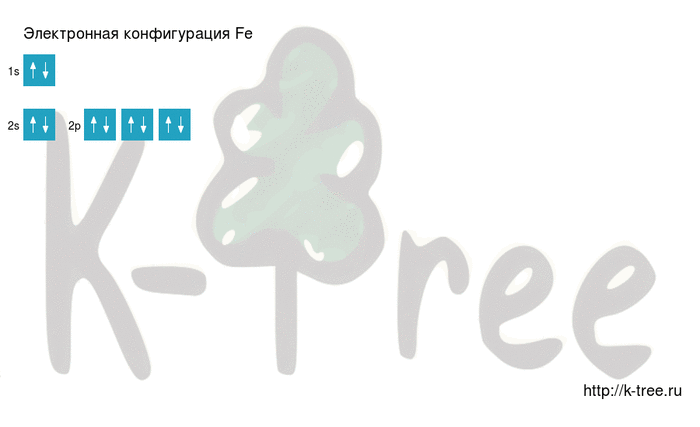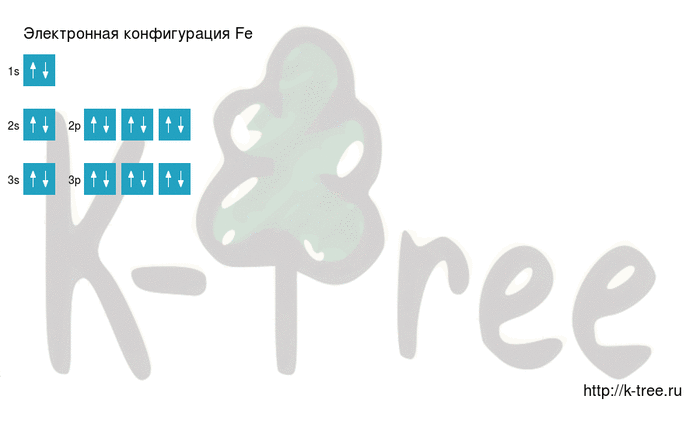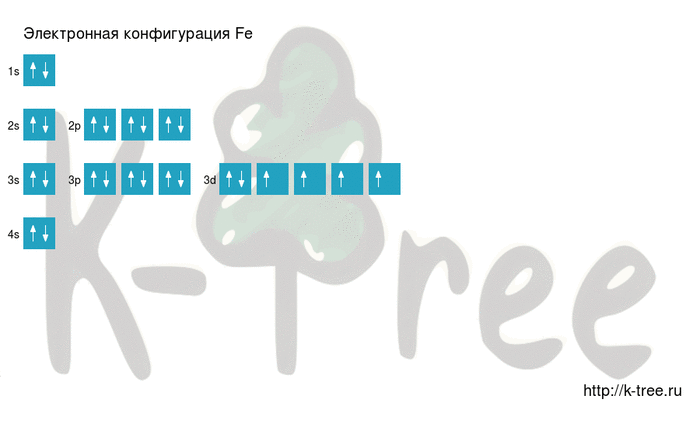что такое ион железа
Ионы железа и содержание электронов: характеристика, описание
Содержание:
Характеристика железа
Железо – второй по распространенности элемент в коре Земли. В чистом виде железо нельзя обнаружить. Оно часто входит в структуру различных веществ.
Железо располагается в четвертом периоде в восьмой побочной группе. Оно включает электроны, находящиеся на d-подуровне, поэтому относится к группе d-элементов.
Число электронов в ионах железа варьируется. У каждого атома железа есть по 8 валентных электронов. В составе веществ они проявляют различные степени окисления и образовывают соответствующие ионы:
На нашей планете наиболее распространены соединения с железом, степень окисления которого +2 или +3.
Катион Fe 2+
При реакции с кислородом из воздуха в солях и гидроксидах железо меняет валентность с II на III. Fe(OH)2 – белый осадок, который при контакте с кислородом темнеет, т. к. окисляется до Fe(OH)3.
Для оксида и гидроксида характерны основные свойства. Их получают только косвенным путем.
Качественные реакции
При действии кислорода железо в составе гидроксида меняет валентность с II на III. Раствор становится желто-зеленым.
Катион Fe 3+
Число электронов в ионе железа Fe +3 равно 23. Оксид и гидроксид выражают амфотерные (с преобладанием основных) свойства. Соли сильно гидролизованы, поэтому не могут быть выделены из водного раствора. Соединения железа с валентностью III являются окислителями.
Сталь и чугун, в состав которых входит железо, используются в народном хозяйстве. Хлорид железа (III) применяется при травлении меди. В компьютерной технике и радиотехнике используются ферриты двухвалентных металлов.
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
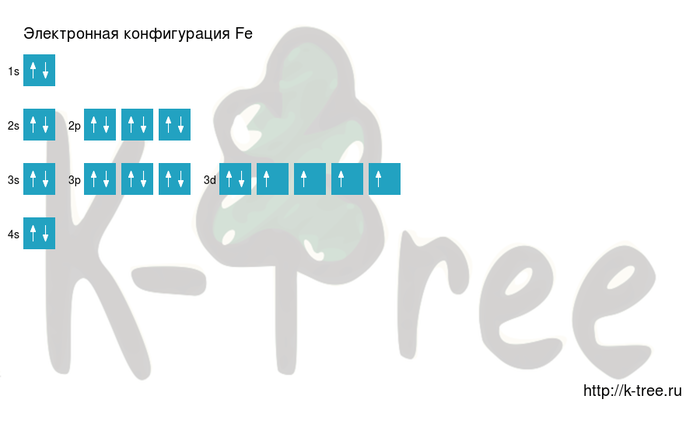
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Роль железа в организме: дефицит, избыток, источники
Материал прокомментировала и проверила Наталья Поленова, семейный доктор, кардиолог и диетолог GMS Clinic
Организм не вырабатывает железо самостоятельно, человек получает 1-2 мг этого элемента вместе с пищей. Примерно столько же каждый из нас теряет с ороговевшими клетками кожи и кишечника.
Функции железа
Железо помогает поддерживать многие важные функции организма, влияя на уровень жизненной энергии, концентрацию внимания, желудочно-кишечные процессы, иммунную систему и регуляцию температуры тела. Его недостаток или избыток моментально сказывается на самочувствии.
Обменные процессы
Железо — важный компонент гемоглобина, состоящего из красных кровяных телец (эритроцитов). Гемоглобин содержит около двух третей железа в организме. Он соединяется с кислородом, а эритроциты разносят его из легких по всему телу. Этот минерал также входит во многие элементы, отвечающие за холестериновый обмен, переработку калорий в энергию, борьбу с токсинами. Благодаря железу со своими функциями лучше справляется иммунная система, а эритроциты с его помощью отправляют углекислый газ в легкие для переработки. Оно также необходимо для поддержания здоровья клеток, кожи, волос и ногтей.
Беременность
В период беременности в женском организме увеличивается количество жидкости. За счет этого резко растет объем крови и производство эритроцитов, которые нужны для обеспечения плода кислородом и необходимыми веществами. Кровь становится жиже, падает уровень гемоглобина. Организм потребляет железо максимально. Дефицит минерала может привести к ранним родам, низкому весу младенца после рождения, а также к нарушению его когнитивного развития. Беременные женщины с железодефицитом больше склонны к инфекционным заболеваниям, поскольку он негативно влияет на иммунную систему [1].
Энергия
Недостаточное количество железа в рационе может повлиять на эффективность, с которой организм использует энергию. Благодаря роли переносчика кислорода к мышцам и мозгу, железо играет важную роль в умственной и физической активности. Низкий уровень этого элемента может привести к проблемам с концентрацией внимания, раздражительности и снижению выносливости.
Норма железа
Рекомендуемая суточная норма потребления железа зависит от возраста, пола, образа жизни и состояния здоровья [2].
Дети нуждаются в большем количестве железа, чем взрослые: в период роста и формирования организма любые полезные вещества расходуются гораздо быстрее. Дневная норма зависит от возраста ребенка: 4 –8 лет — 10 мг, 9–13 лет — 8 мг. Начиная с подросткового возраста, когда у девочек начинается менструация, их суточная потребность в железе увеличивается.
В возрасте 19 –50 лет женщины должны получать 18 мг железа каждый день, в то время как мужчинам того же возраста достаточно 8 мг [3]. После наступления менопаузы ежедневная норма железа для женщин приравнивается к мужской — 8 мг каждый день.
Иногда человеку требуется больше железа, чем обычно. Следить за уровнем железа в крови необходимо при беременности и кормлении, почечной недостаточности, язве или желудочно-кишечных расстройствах, которые препятствуют нормальному усвоению минерала. В случае дефицита следует проконсультироваться с врачом.
К уровню железа необходимо относиться с особенным вниманием спортсменам, поскольку интенсивные тренировки могут разрушать эритроциты. Также следить за этим параметром нужно вегетарианцам и веганам, поскольку железо, получаемое из растительной пищи, усваивается недостаточно.
Дефицит железа
Если наступает железодефицит, то ткани и мышцы перестают получать необходимый объем кислорода, который способствует их эффективному функционированию. Это может привести к анемии.
Причины, по которым может наступить анемия [4]:
Снижение уровня железа может также происходить во время внешних и внутренних кровотечений, операций с кровопотерями, частого донорства. Влияют на уровень этого минерала перенесенная анорексия и хронические заболевания, связанные с нарушением всасывания железа. Также риск дефицита повышается во время активного роста ребенка, при приеме антикоагулянтов и антиагрегантов. Анемия может быть вызвана нерегулярным питанием, скудным и однообразным рационом, а также питанием, основанным на схемах вегетарианства и веганства.
Дефицит железа приводит к симптомам, которые могут значительно повлиять на качество жизни. Признаки его нехватки в организме бывают разными в зависимости от тяжести анемии, скорости ее развития, возраста, состояния здоровья. В некоторых случаях люди долгое время не испытывают никаких симптомов.
Симптомы дефицита железа
Самыми распространенными признаками дефицита считаются:
Также при дефиците железа встречаются следующие симптомы:
Длительная железодефицитная анемия приводит к тяжелым последствиям. Нарушается работа сердечно-сосудистой системы, пищеварительного тракта, развивается постепенная атрофия мышц. У женщин происходят сбои менструального цикла, а при беременности возникает угроза выкидыша и преждевременных родов.
Избыток железа
Как и любое вещество, в больших количествах железо может быть токсично для организма. За процесс регуляции и поддержания его запасов в равновесии отвечает гормон гепсидин. Некоторые нарушения, которые подавляют выработку гепсидина, могут привести к отравлению минералом.
В обычном состоянии в крови циркулирует очень мало свободного железа, поскольку оно плотно связано с белками. При накоплении в клетках, оно катализирует вредные процессы. Ускоряется окисление жиров, из-за этого образуются свободные радикалы. Они представляют собой атомы кислорода, имеющие высокую окислительную способность, повреждающую органеллы (постоянные элементы клеток, необходимые для ее существования) клеток и их стенки.
Избыток этого элемента встречается гораздо реже, чем дефицит. Передозировка может наступить внезапно или проявляться медленно в течение долгого времени.
Такое состояние может быть вызвано:
Ранние симптомы отравления железом могут включать боль в животе, тошноту и рвоту. Постепенно избыток минерала накапливается во внутренних органах, вызывая серьезные повреждения мозга и печени.
Продукты с железом
Существует два основных типа железа, содержащиеся в продуктах питания: гемовое и негемовое.
Гемовое железо поступает в организм из животного белка — мяса или рыбы. Негемовое можно получить из зелени, орехов, бобовых, но его биодоступность составляет 5-12%, в то время как гемового железа — 14-18% [15]. Железо из продуктов животного происхождения усваивается организмом лучше, чем из растительных источников.
Наиболее богаты гемовым железом моллюски, мясные субпродукты, красное мясо, птица и яйца. Также большую порцию железа содержит шоколад — 19% от суточной нормы в 28 г [16].
Для веганов и вегетарианцев богатым источником железа могут стать гречка, нут, гранат, киноа, бобы, шпинат.
Важно правильно употреблять пищу, содержащую железо. Продукты, насыщенные этим минералом, хорошо сочетаются с фруктами и овощами с высоким уровнем витамина С. Такое соседство увеличивает усвоение железа [17]. П родукты, насыщенные кальцием, наоборот, подавляют всасывание железа, поэтому их лучше употреблять в разное время [18].
Препараты железа и витамины
Питаться сбалансировано следует всем и всегда, независимо от уровня железа в крови. Но в случае анемии, выраженного снижения уровней ферритина или железа одной диеты недостаточно.
При низком уровне железа или железодефицитной анемии врач назначает специальные препараты, которые помогут улучшить ситуацию. Адекватное медикаментозное лечение дополняет диетические рекомендации и позволяет быстро достичь нормальных параметров обмена железа в крови. Контролировать следует не только уровень гемоглобина, но и железа, ферритина, железосвязывающей способности крови.
Необходимо не просто добиться нормального уровня всех показателей обмена железа, но и постоянно поддерживать его. В этом могут помочь препараты железа или БАДы с его содержанием. Они различаются дозировкой, переносимостью и влиянием на ЖКТ. Выбор сейчас достаточно велик — не ошибиться поможет терапевт.
Для улучшения усвоения железа необходимо употреблять железосодержащие продукты совместно с продуктами, богатыми аскорбиновой кислотой (черная смородина, красный болгарский перец, шиповник, зеленый лук, грейпфрут) и медью (вишня, инжир, гречка, овсянка, шпинат, салат).
Нужно учитывать, что если запивать железосодержащие блюда чаем или молоком, то усвоение минерала снижается более чем в два раза. Лучше всего запивать их фруктовыми и овощными соками, в которых много меди, аскорбиновой кислоты и органических кислот, улучшающих усвоение железа.
Комментарий эксперта
Наталья Поленова, кандидат медицинских наук, кардиолог, терапевт GMS Clinic
К сожалению, очень часто пациентки с дефицитом железа длительное время пребывают в этом состоянии, страдают от неспецифических симптомов, таких как тахикардия, головокружение, общая слабость, выпадение волос. Они посещают врачей самых разных специальностей: кардиологов, неврологов, дерматологов, проходят множество дополнительных видов обследования, но так и не получают необходимого им простого и эффективного лечения. Если женщина детородного возраста обращается к врачу любой специальности с указанными выше неспецифическими симптомами, начинать диагностический поиск следует именно с железодефицитного состояния.
Корректировать дефицит железа можно довольно быстро, у врачей внушительный арсенал таблетированных, жидких, парентеральных лекарственных форм, а также БАДов. После коррекции железодефицитного состоянии многие пациентки сожалеют, что столько лет их качество жизни страдало, они находились в сниженном ресурсном состоянии, в то время как помочь им можно было довольно быстро и просто.
Среди пациентов мужского пола железодефицитная анемия встречается в десятки раз реже, чем у девушек. Зоной особого внимания здесь считаются доноры, регулярно участвующие в сдаче крови. Этой категории лиц тоже время от времени требуется назначение препаратов железа в адекватной дозировке. У всех остальных представителей сильного пола (без известных хронических заболеваний) риск избытка железа, конечно, выше, чем его дефицит. Поэтому самостоятельное и необоснованное применение препаратов железа молодыми здоровыми мужчинами не просто бесполезно, но и опасно.
Когда целевые показатели обмена железа на фоне приема препаратов будут достигнуты (цель лечения ЖДА — введение железа в количестве, необходимом для нормализации уровня гемоглобина: у женщин 120-140 г/л, у мужчин 130-160 г/л) и произошло восполнение тканевых запасов железа (ферритин сыворотки> 40-60 мкг/л), возникает задача в закреплении результата. Для этого необходимо профилактическое (курсовое) назначение препаратов железа группам риска: женщинам при обильных мено/метроррагиях, донорам крови, веганам, пациентам с хроническими заболеваниями ЖКТ.
Очень важно при выявлении анемии не просто назначить железосодержащие препараты, но и выявить причину дефицита, чтобы не пропустить дебют опасного, в том числе, онкологического заболевания. Исключив угрожающую здоровью патологию, можно спокойно и методично корректировать обмен железа до достижения нормальных показателей.
Железо. Свойства железа и его соединений.
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии :
+26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538 о С, температура кипения 2861 о С.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
Оксид железа (II) опускается в область с более высоких температур (до 1200 o C), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3

3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях с образованием нитрида дижелеза:
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида:
3Fe + C → Fe3C
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900 о С с водяным паром:
3 Fe 0 + 4 H2 + O → Fe +3 3O4 + 4 H2 0
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
Fe + CuSO4 → FeSO4 + Cu
Еще пример : простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2FeCl3 + Fe → 3FeCl2
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами :
1. Частичным в осстановлением оксида железа (III).
Или частичным восстановлением оксида железа (III) угарным газом:
Еще один пример : восстановление оксида железа (III) железом:
2. Разложение гидроксида железа (II) при нагревании :
Химические свойства
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
FeO + SO3 → FeSO4
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Также оксид железа (III) восстанавливается водородом:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe 3+ + H2O ↔ FeOH 2+ + H +
II ступень: FeOH 2+ + H2O ↔ Fe(OH )2 + + H +
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например : хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества: