что такое инверсия 9 хромосомы
Что такое инверсия 9 хромосомы
Хромосомные перестройки обычно не имеют фенотипического эффекта, если они сбалансированы, поскольку весь хромосомный материал присутствует, даже если он иначе упакован. Важно различать разницу между истинно сбалансированными перестройками и теми, которые цитогенетически представляются сбалансированными, но на молекулярном уровне не сбалансированы.
Более того, из-за высокой частоты в геноме CNP, увеличивающей и без того существующие различия в много миллионов пар оснований между геномами неродственных индивидуумов, понятие сбалансированности или несбалансированности отчасти произвольно и подлежит дальнейшему исследованию и уточнению.
Даже когда структурные перестройки истинно сбалансированы, они могут представлять угрозу последующим поколениям, поскольку носители могут иметь высокую частоту несбалансированных гамет и, следовательно, имеют повышенный риск аномального потомства с несбалансированными кариотипами; в зависимости от специфической перестройки, риск может колебаться от 1 до 20%.
Существует также возможность, что один из хромосомных разрывов повредит ген, вызвав мутацию. Это хорошо описаная причина Х-сцепленных болезней у женщин-носителей сбалансированных транслокаций Х-хромосомы и аутосом, такие транслокации могут быть путеводной нитью к уточнению позиции гена, ответственного за развитие болезни.
Инверсия хромосом
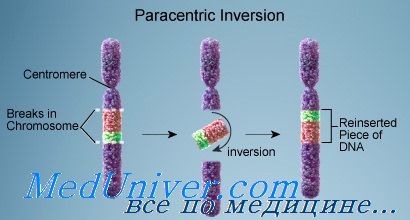
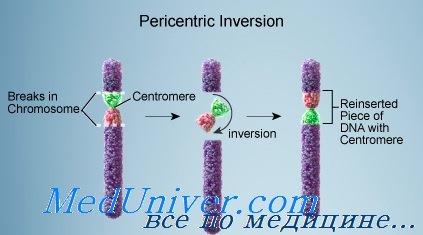
Инверсия появляется, когда в хромосоме происходят два разрыва, а сегмент между ними переворачивается. Инверсии бывают двух типов: парацентрические (не включающие центромеру), при которых оба разрыва происходят в одном плече; и перицентрические (включающие центромеру), при которых разрывы находятся в разных плечах. Поскольку парацентрические инверсии не изменяют соотношение плеч хромосомы, их можно выявить (если это вообще удастся) только при дифференциальной окраске или FISH-методом с локусспецифическими зондами.
Перицентрические инверсии цитогенетически выявить легче, поскольку они могут изменять соотношение плеч хромосом, а также расположение полос.
Инверсия обычно не вызывает аномалий фенотипа у носителей, поскольку относится к сбалансированным перестройкам. Ее медицинское значение — влияние на потомство; носитель любой инверсии попадает в группу риска по наличию аномальных гамет, приводящих к несбалансированному потомству, так как при инверсии при конъюгации хромосом в мейозе I формируется петля. Рекомбинация отчасти подавляется в пределах инверсионных петель, но если она происходит, то может вести к формированию несбалансированных гамет.
Формируются как гаметы со сбалансированным хромосомным набором (нормальным или с инверсией), так и гаметы с несбалансированными хромосомами в зависимости от позиции точек рекомбинации. Если инверсия парацентрическая, несбалансированные рекомбинантные хромосомы обычно ацентрические или дицентрические и не могут привести к жизнеспособному потомству, хотя есть и редкие исключения. Таким образом, на самом деле риск того, что носитель парацентрической инверсии будет иметь живорожденного ребенка с аномальным кариотипом, очень низкий.
Перицентрическая инверсия, со своей стороны, может привести к появлению несбалансированных гамет как с дупликацией, так и с делецией хромосомных сегментов. Удвоенный и потерянный сегменты — расположенные дистальнее инверсии. В целом риск для носителя перицентрической инверсии родить ребенка с несбалансированным кариотипом оценивают в 5-10%. Каждая перицентрическая инверсия, тем не менее, связана с конкретным риском.
Большие перицентрические инверсии с большей вероятностью, чем малые, приводят к жизнеспособному рекомбинантному потомству, так как в случае больших инверсий несбалансированные сегменты в рекомбинантном потомстве имеют меньший размер. Это положение иллюстрируют три хорошо изученных инверсии.
Перицентрическая инверсия хромосомы 3, происходящая от семейной пары из Ньюфаундленда, вступивших в брак в начале XIX в. — одна из немногих, для которой получено достаточно данных, чтобы оценить расхождение инвертированной хромосомы в потомстве носителей. Кариотип с inv(3) (p25q21) с тех пор был описан в ряде центров Северной Америки, в семьях, предки которых прослеживались до приморских провинций Канады.
Носители хромосомы inv(3) нормальны, но некоторые их дети имеют характерный аномальный фенотип, ассоциирующийся с рекомбинантной хромосомой 3, в которой отмечена дупликация дистального сегмента 3q21 и делеция дистального сегмента 3р25. Девять человек — носителей этой инверсии — имели 53 зарегистрированных беременности. Высокий риск аномального исхода беременности в группе (22/53, или больше 40%) указывает значение семейных хромосомных исследований для идентификации носителей, генетического консультирования и дородовой диагностики.
Другая перицентрическая инверсия, связанная с выраженным дупликационным или делеционным синдромом в рекомбинантных потомках, находится в хромосоме 8, inv(8) (p23.1q22.1) и первоначально обнаружена среди испанцев юго-запада США. Эмпирические исследования показали, что носители inv(8) имеют 6% риска родить ребенка с синдромом рекомбинантной хромосомы 8, летальным нарушением с серьезными сердечными аномалиями и умственным недоразвитием. В рекомбинантной хромосоме дублирован дистальный участок 8q22.1 и утерян дистальный участок 8р23.1.
Наиболее частая инверсия у человека — небольшая перицентрическая инверсия хромосомы 9, которую отмечают почти у 1% обследованных лабораториями цитогенетики. Кариотип inv(9)(pllql2) не имеет известных опасных эффектов у носителей и не дает значимого риска выкидыша или несбалансированного потомства; поэтому обычно считается вариантом нормы.
Дополнительно к цитогенетически видимым инверсиям геномными методами обнаруживают все большее количество малых инверсий. Полагают, что многие из них клинически благоприятны, без отрицательного влияния на потомство.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины генетического бесплодия
Согласно оценкам экспертов Всемирной организации здравоохранения, около 50 миллионов супружеских пар во всем мире (что составляет примерно 7% от их общего количества) не могут завести ребенка из-за мужского и/или женского бесплодия. На данный момент считается, что в 50% случаев причиной являются генетические нарушения.
Современная наука достигла больших успехов в изучении причин генетического бесплодия, особенно с появлением метода секвенирования нового поколения (next generation sequencing, NGS), позволяющего быстро и с минимальными трудозатратами «читать» последовательность ДНК. Тем не менее, этот вопрос остается сложным, и в имеющихся на данный момент знаниях остается еще немало пробелов.
Существует множество генов, влияющих на мужскую и женскую репродуктивную функцию. Например, в одних только яичках мужчины экспрессируется около 2300 генов. Наука продолжает развиваться, и список доступных анализов ежегодно пополняется новыми генетическими тестами.
Генетические изменения, способные приводить к невозможности зачатия и вынашивания беременности, бывают разными:
Хромосомные аномалии
Хромосомные нарушения представляют большой интерес в аспекте вопросов бесплодия, так как они ответственны более чем за половину всех выкидышей в первом триместре беременности. В большинстве случаев хромосомные аномалии не наследуются – они возникают случайно в половых клетках или клетках эмбриона. При этом происходят выкидыш, мертворождение, либо ребенок рождается с серьезными пороками развития.
В каждой клетке человеческого тела содержится 46 хромосом. В яйцеклетке и сперматозоиде их по 23 – соответственно, ребенок получает половину набора от матери и половину от отца. Состояние, при котором меняется количество хромосом, называется анеуплоидией. Некоторые примеры, связанные с бесплодием:
Помимо изменений количества хромосом, встречаются нарушения их структуры – аберрации.
Их основные разновидности:
Моногенные заболевания
Моногенные заболевания характеризуются возникновением мутации в одном гене, отвечающем за синтез определенного белка. Эти патологии передаются от родителей детям, причем типы наследования бывают разными.
В настоящее время известно много моногенных мутаций, связанных с бесплодием. Их список постоянно пополняется.
Мультифакториальные заболевания
Мультифакториальные, или полигенные заболевания имеют сложный патогенез. В их развитии принимают участие генетические нарушения (как наследственные, так и приобретенные), образ жизни, воздействия внешней среды. На «неправильные» гены накладываются такие факторы, как особенности питания, уровень физической активности, экологическая обстановка, вредные привычки, стрессы, прием различных лекарственных препаратов и пр.
Типичные примеры мультифакториальных заболеваний – сахарный диабет и сердечно-сосудистые патологии. Среди причин женского бесплодия важное значение имеют следующие заболевания:
Эпигенетические изменения
Эпигенетические изменения возникают в результате различных процессов, когда последовательность ДНК остается нормальной, но меняется активность генов. Например, это происходит в результате метилирования – прикрепления особых метильных групп к определенным участкам ДНК. Некоторые научные исследования показали, что эпигенетические механизмы играют роль в развитии бесплодия.
В каких случаях рекомендуется пройти генетическое тестирование?
Обычно врачи направляют пациентов на консультации к клиническим генетикам в следующих случаях:
Генетик собирает семейный анамнез, анализирует родословную и при необходимости назначает анализы. Для диагностики причин генетического бесплодия применяют разные методы: цитогенетический анализ, полимеразную цепную реакцию (ПЦР), флуоресцентную гибридизацию in situ (FISH), микрочипирование, секвенирование нового поколения.
Чтобы выявить распространенные аномалии у плода, на 16–20-й неделях беременности проводят тройной тест. По показаниям выполняют различные инвазивные исследования. Более современный и точный метод диагностики – неинвазивное пренатальное тестирование (НИПТ), во время которого изучают ДНК плода в крови матери.
Если у одного или обоих партнеров из пары, страдающей бесплодием, выявляют генетические нарушения, в ряде случаев могут помочь различные методы лечения или вспомогательные репродуктивные технологии (ЭКО, ИКСИ). Но иногда проблему не удается решить. В таких ситуациях врач предложит рассмотреть возможность использования донорских яйцеклеток или сперматозоидов.
С возрастом репродуктивные возможности уменьшаются, а в клетках накапливаются мутации, которые могут помешать наступлению и вынашиванию беременности, вызвать тяжелые патологии у ребенка. Поэтому женщинам, которые планируют забеременеть после 35 лет, стоит подумать о возможности сохранить свои яйцеклетки в криобанке. В дальнейшем ими можно воспользоваться в любое время – это будет своего рода «страховка» репродуктивной функции.
Если вы решили сохранить собственные половые клетки или воспользоваться донорскими, важно подобрать надежный банк половых клеток. На данный момент Репробанк является одним из крупнейших на территории России и СНГ. Наше криохранилище оснащено новейшим оборудованием, а в каталоге представлено большое количество доноров, среди которых любая пара наверняка сможет подобрать подходящего.
Зиновьева Юлия Михайловна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Инверсия пола 46 XY
OMIM 400044
Наша команда профессионалов ответит на ваши вопросы
Инверсия пола, 46,XY
Наличие женского фенотипа при нормальном мужском кариотипе характеризует XY-инверсию пола. Наиболее частой причиной данного нарушения формирования пола является синдром Свайера – это полная или «чистая» дисгенезия гонад при кариотипе 46,XY. Частота XY-дисгенезии гонад составляет 1 на 30000 человек. Больные имеют женский фенотип без признаков двойственности полового развития: феминное телосложение, развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку и маточные (фаллопиевы) трубы. Однако у пациентов с синдромом Свайера практически отсутствуют женские половые железы, которые в данном случае представлены дисгенетичными гонадами, представляющими собой соединительнотканные тяжи (стреки) с небольшими включениями железистой ткани, овариально-подобной стромы без фолликулов. Как правило, диагностирование синдрома Свайера происходит у девочек в пубертатный период, когда у них не происходит нормального полового развития. Причиной обращения к врачу при этом является задержка полового развития и отсутствие начала менструаций, реже наличие злокачественных новообразований, происходящих из дисгенетичных гонад. Так как дисгенетичные гонады подвержены озлокачествлению, показано их удаление в детстве или на момент постановки диагноза XY-дисгенезии гонад. После оперативного лечения пациенткам, как правило, еще в подростковом возрасте назначается заместительная гормональная терапия, чтобы достичь нормального развития вторичных половых признаков и предотвратить развитие остеопороза. У женщин с XY-дисгенезией гонад нет собственных яйцеклеток, однако в некоторых случаях она в состоянии выносить плод, полученный в программе ЭКО при оплодотворении донорской яйцеклетки сперматозоидами супруга.
Инверсия пола, 46,XY тип 1 (OMIM 400044)
Наиболее частой из известных причин «чистой» формы дисгенезии гонад 46,XY являются микроструктурные перестройки Y-хромосомы c утратой гена SRY (Sex-determining region Y), а также точковые мутации данного гена. У 10-15% больных с синдромом Свайера обнаруживают отсутствие локуса SRY. В большинстве случаев это обусловлено утратой фрагмента дистальной части короткого плеча Y-хромосомы (Yp11.3), вследствие X-Y транслокации. Еще у 10-15% пациентов с данным синдромом выявляют мутации гена SRY.
Ген SRY локализован на коротком плече Y хромосомы и кодирует транскрипционный фактор – белок, связывающийся с генами, определяющими развитие пола плода по мужскому типу. Мутации в гене SRY приводят к синтезу функционально неполноценного белка и к нарушению дифференцировки клеток Сертоли и формирования семенных канальцев в развивающихся бипотенциальных гонадах плода, что вызывает дисгенезию гонад и развитие остальных органов половой системы по женскому типу, несмотря на наличие Y-хромосомы в кариотипе.
Инверсия пола, 46,XYтип 2 (OMIM 300018)
Данный тип XY-инверсии пола обусловлен дупликаций гена NR0B1 (DAX-1). Ген NR0B1локализован на коротком плече Х хромосомы (локус Хp21.3). Кодируемый этим геном белок DAX-1 играет важную роль в развитии и функции некоторых органов эндокринной системы, в том числе и половых желез. Еще внутриутробно он контролирует активность генов, участвующих в формировании этих тканей, а в постнатальном периоде DAX-1 регулирует выработку в них гормонов. Белок DAX-1 оказывает дозо-зависимый эффект на органы эндокринной системы. Дупликация гена NR0B1, а также делеция располагающегося рядом с геном NR0B1 локуса, негативно-регулирующего его транскрипцию приводит к XY-инверсии пола, обусловленной XY-дисгенезией гонад часто сочетающейся с нарушением функции надпочечников. Точковые мутации этого гена у пациентов с кариотипом 46,XY вызывают нарушение развития тестикулярной ткани, приводят к дефициту маскулинизации. Мутации в этом гене также вызывают Х-сцепленную гипоплазию надпочечников, как у пациентов с кариотипом 46,ХХ так и 46,XY.
Инверсия пола, 46,XY тип 3 (OMIM 612965)
Инверсия пола, 46,XY тип 4 (OMIM 154230)
Эта форма XY-инверсии пола обусловлена делецией локуса 9p24.3. У пациенток отмечают нормально развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку, при гистологическом исследовании гонад обнаруживают наличие незрелой тестикулярной ткани, содержащей клетки Сертолли, и отсутствие зрелых половых клеток. Инверсия пола у данных пациентов, вероятно, обусловлена потерей одной из копий дозо-чувствительного гена, локализованного в данном локусе. Генами-кандидатами являются DMRT1 и DMRT2.
Инверсия пола, 46,XY тип 5 (OMIM 613080)
Данная аутосомно-рецессивная форма инверсии 46,XY обусловлена наличием мутаций в гене CBX2, расположенного на хромосоме 17 (локус 17q25). В 2009 году Байсон-Лаубер описал случай новорожденной девочки с кариотипом 46,XY, у которой в результате секвенированияв гене CBX2 были обнаружены две мутации (P98L и R443P). В результате исследований у девочки были обнаружены нормально развитые яичники, с наличием овариальной ткани и первичных фолликулов, а также влагалище и матка. Однако возраст еще был слишком мал, чтобы оценить ее фертильность и дальнейшее половое развитие.
Инверсия пола, 46,XY тип 6 (OMIM 613762)
XY-инверсия пола связана с наличием мутации в гетерозиготном состоянии в гене MAP3K1, расположенном в локусе 5q11.2. Пациентки с данной формой дисгенезии гонад имеют высокий рост, который, вероятно, обусловлен избыточной продукцией андрогенов, тяжевидные яичники, гипоплазированную матку, иногда наблюдается клиторомегалия.
Инверсия пола, 46,XY тип 7 (OMIM 233420)
Инверсия пола обусловлена наличием у пациенток мутаций в гомозиготном или компаунд-гетерозиготном состоянии в гене DHH, расположенного в локусе 12q13.12. У нескольких пациенток было описано наличие недоразвитой матки, также присутствовали фаллопиевы трубы и наблюдали полную форму ХY-дисгенезии гонад (тяжевидные гонады, которые часто озлокачествлялись).
Инверсия пола, 46,XYтип 8 (OMIM 614279)
Данный тип XY-инверсии пола обусловлен мутациями гена AKR1C2, лежащего в локусе 10p15, отвечающего за альтернативный путь синтеза дигидротестостерона. Мутации сцепленного с ним гена AKR1C4, который сегрегирует вместе с геном AKR1C2, могут влиять на выраженность фенотипических проявлений.
В Центре Молекулярной Генетики проводится молекулярный анализ ключевых генов, контролирующих дифференцировку пола, в частности выполняется секвенирование генов SRY и NR5A1 (SF1), а также с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY, NR5A1 (SF1), NR0B1 (DAX-1).
Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. 
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.