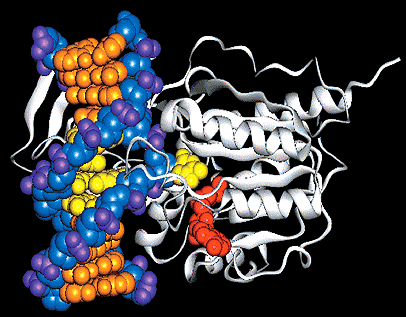что такое ген молодости
Отключение «гена молодости» SIR2 замедляет старение
Удаление из организма гена SIR2, вот уже пять лет известного как ген, замедляющий старение, приводит к фантастическому увеличению жизни — в целых шесть раз. Эти результаты пока подтверждены на дрожжах и человеческих клетках печени.
Пять лет назад профессор Леонард Гуаренте (Leonard Guarente) из Массачусетского технологического института произвел серию экспериментов, показавшую, что лишняя копия гена SIR2 может существенно увеличивать ожидаемую продолжительность жизни простейших микроорганизмов, вроде дрожжей, фруктовых мушек и некоторых видов червей. С тех пор ряд крупных фармакологических компаний пытаются создать лекарства на основе белков, кодируемых этим геном.
Однако группа ученых из Университета Южной Калифорнии под руководством Вальтера Лонго (Valter Longo) усомнилась в правильности полученных выводов и начала свое исследование гена SIR2. Результаты только что закончившегося эксперимента заставляют предположить, что SIR2 не борется со старостью, а, напротив, включает механизм старения.
Как выяснилось в ходе эксперимента, полное удаление SIR2 из генома подопытного микроорганизма, сопровождающееся внесением определенных изменений в работу генов RAS2 и SCH9, отвечающих за хранение в клетке питательных веществ и сопротивление повреждению клеточной оболочки от неблагоприятных условий, может удлинять продолжительность жизни испытуемого примерно в шесть раз. Этот эффект проявлялся не только в случае с дрожжами, но и при проведении опытов на живых человеческих клетках, говорится в пресс-релизе Университета Южной Калифорнии. То есть можно предположить, что SIR2 скорее заботится о том, чтобы организм вовремя покинул арену эволюционного противостояния, а не создавал на ней излишнюю массовость.
По мнению профессора Лонго, ген SIR2 (и его аналог у млекопитающих SIRT2) не позволяет клеткам перейти в экстренный режим работы, когда под воздействием неблагоприятной среды они пытаются сделать все возможное, чтобы пережить тяжелые времена и дать в конечном итоге новое потомство, как это делают, скажем, некоторые болезнетворные бациллы, защищающиеся от засухи, жары и холода с помощью «бронированных» спор.
Клетки-долгожители, лишенные гена SIR2, проявляли совершенно необычную способность к сопротивлению стрессам. Несмотря на то что ученые воздействовали на модифицированные клетки оксидантами и горячим воздухом, клетки упорно цеплялись за жизнь, хотя обычные клетки уже давно бы погибли.
Команда Лонго уже приступила к тестированию работы гена SIR2 на мышах. Первые результаты показывают, что при отключении этого гена продолжительность жизни мышей тоже увеличивается. Правда, при этом мыши вырастают меньшего размера, страдают бесплодием и мышечными дефектами. Это говорит о том, что ген SIR2 необходим для нормального развития плода.
«Ген молодости» Klotho повышает сопротивляемость к оксидантному стрессу
Профессор Техасского университета Макото Куро-о (Makoto Kuro-o), вот уже 8 лет исследующий открытый им ген Klotho, который называют иногда иногда «гормоном молодости», продвинулся еще на один шаг в понимании того, как работает этот ген.
Ген Klotho был открыт профессором Макото Куро-о еще в 1997 году. Свое название он получил в честь одной из трех древнегреческих мойр — богинь судьбы (Лахесис назначает жизненный жребий, Клото прядет нить жизни, а Атропос обрезает жизненную нить). Наблюдения за мышами, лишенными этого гена, показали, что животные-мутанты демонстрируют нормальное развитие лишь до третьей-четвертой недели жизни, после чего начинают быстро стареть: у них развивается остеопороз, эмфизема легких, появляются склеротические изменения сосудов. В общем, весь букет старческих заболеваний. Напротив, трансгенные мыши, отличающиеся чрезмерной экспрессией этого гена, жили на 20-30% дольше обычных.
Сначала профессор Куро-о решил, что ген Klotho поставляет организму некий белок (белок Klotho), который действует как гормон, тормозящий процессы старения. Затем оказалось, что этот белок блокирует внутриклеточные химические сигналы, которые передаются посредством инсулина и инсулиноподобного фактора роста. Известно, что повышенная чувствительность к инсулину ускоряет износ клеток. Опыты на мышах показали, что уровень инсулина в крови трансгенных мышей был гораздо выше, чем у грызунов из контрольной группы, а у мышей, лишенных Klotho, напротив, значительно ниже нормального уровня.
Дальнейшие исследования, результаты которых опубликованы в номере журнала Journal of Biological Chemistry за 11 ноября, издаваемого Американским обществом биохимии и молекулярной биологии (ASBMB), выявили сам механизм, с помощью которого Klotho борется с процессами старения, сообщается в пресс-релизе ASBMB.
Как оказалось, Klotho повышает сопротивляемость клеток к так называемому «оксидантному стрессу» — процессу избыточного накопления внутри клеток свободных радикалов, вызывающих повреждение таких важных биологических макромолекул, как ДНК, липиды и белки, что приводит к нарушению нормального функционирования клеток и старению организма. Klotho повышает способность клеток к самостоятельной детоксификации за счет выработки марганец-суперокисид-дисмутазы — важного антиоксиданта, количество которого в организме, как известно, уменьшается с возрастом. Этот фермент, который обычно находят в клеточных митохондриях, выполняет свою защитную функцию за счет гидролиза вредных супероксидов и превращения их в менее опасный пероксид водорода.
Профессор Куро-о полагает, что сделанное его группой открытие все-таки может быть полезным для создания нового класса лекарственных препаратов, замедляющих процесс старения человеческого организма.
Старение и долголетие: эпигеном раскрывает тайны
Старение и долголетие: эпигеном раскрывает тайны
Детальное изучение эпигенома дает биологам возможность выбраться из тумана многочисленных теорий старения и более точно понять коренные причины этого явления, а также связанных с ним возрастных болезней.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Эпигенетика — относительно недавно возникшая область науки. Предметом ее изучения являются устойчиво сохраняющиеся в ряду клеточных делений изменения активности генов, не связанные с изменением самой ДНК. Иными словами, за счет эпигенетических модификаций одни гены работают, а другие — молчат. Еще тридцать лет назад в научном сообществе многие из-за укоренившихся догм не хотели признавать важность эпигенетических процессов в биологическом мире. Сейчас к этой области знания приковано внимание множества лабораторий и институтов по всему миру, занимающихся в том числе и изучением природы старения. В геронтологии получило мощное развитие новое направление, связанное с описанием эпигенетических механизмов возрастных изменений.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая статья о механизмах старения и долголетия» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Эпигенетика начинает поиск
Метилирование представляет собой способ регулирования активности генов путем присоединения к цитозиновым основаниям ДНК метильной группы (-СН3). Метилирование подавляет активность гена: синтез РНК (соответственно, и белка) по такой матрице становится невозможным. Это своего рода «заглушка», которую организм использует, инактивируя те или иные гены, работа которых в данный момент ему не нужна или может представлять опасность.
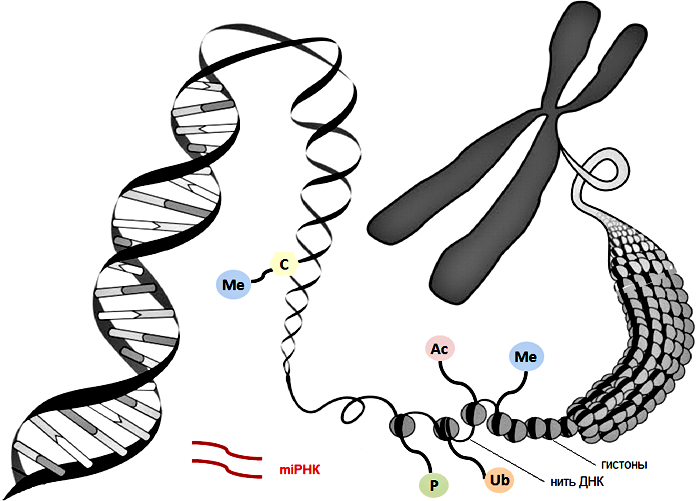
Еще одним важным механизмом эпигенетической регуляции является модификация гистонов, входящих в состав хроматина. Хроматин — это комплекс белков и нуклеотидов, обеспечивающий надежное хранение и нормальную работу ДНК. В наших клетках упаковка ДНК похожа на склад бижутерии. Иначе никак невозможно уложить спираль длиной два метра в одно маленькое клеточное ядро. Нить ДНК наматывается в полтора оборота на многочисленные «бусинки» из нескольких специальных белков, гистонов. Так формируются повторяющиеся структурные единицы эукариотического хроматина, называемые нуклеосомами. В каждой нуклеосоме содержится восемь молекул гистонов — по две молекулы каждого из четырех видов белков (H2A, H2B, H3, H4). Гистоны имеют «хвостики» — белковые «наросты», которые могут удлиняться или укорачиваться специальными ферментами. Длина такого «хвоста» напрямую влияет на активность генов, находящихся вблизи него.
Гистоновый «хвост» может подвергнуться процессу ацетилирования, то есть замене в нём атомов водорода на остаток уксусной кислоты. В результате этого связь гистонов с ДНК, основанная на притяжении разнозаряженных частиц, ослабится, гистон диссоциирует (отдалится от ДНК), и упаковка ДНК станет более «рыхлой» (менее плотной). Тогда белки-регуляторы смогут легче присоединяться к ДНК, и активность гена повысится. Эпигенетические процессы взаимосвязаны друг с другом: так, увеличение уровня метилирования ДНК обычно сопряжено со снижением уровня ацетилирования гистонов, и наоборот. Помимо ацетилирования существует множество других способов модификаций гистонов: метилирование, фосфорилирование, сумоилирование и так далее. Эти модификации могут как разрыхлять, так и «заматывать крепче» упаковку ДНК, что приводит к увеличению или уменьшению экспрессии генов соответственно.
Важные научные открытия, связанные с эпигенетикой, появляются практически ежегодно. И хотя ученые находятся в самом начале пути, полученные данные показывают исключительную ценность этого научного направления. Получив мировое признание, эпигенетика вскоре перешла из чисто научной области исследований в очень прикладную, когда выявилась ее тесная связь с развитием и старением. Не случайно одна из недавних статей в Nature вышла под названием «Эпигеномика начинает поиск» [7]. И этот поиск уже дает свои результаты.
Рисунок 1. Структура хроматина и эпигенетические механизмы воздействия на геном. Модификации гистонов: Ас, ацетилирование; Me, метилирование; Ub, убиквитинирование; P, фосфорилирование. Метилирование цитозина ДНК — Me
C. РНК-интерференция: miРНК, малые некодирующие РНК.
Метилирование и его связь со старением
В научных трудах по геронтологии часто встречается описание онтогенеза (индивидуального развития организма) лососевых рыб. И, как уже известно, молниеносно развивающееся сразу после нереста старение рыб этого вида сопровождается массивным деметилированием ДНК [8]. Установлено, что с возрастом происходит общее снижение уровня метилирования ДНК. В ДНК, которую брали у эмбрионов и новорождённых, присутствует наибольшее количество метилированных цитозиновых оснований. Получается, что некоторые гены, которые были «заглушены» и молчали в детском и молодом возрасте, к старости начинают проявлять активность. Другая, меньшая часть генов, напротив, с возрастом «замолкает», подвергшись метилированию. Последствия таких изменений генной активности сегодня еще не до конца изучены, но некоторые аспекты уже известны.
Насколько большим может быть влияние эпигенетики на продолжительность жизни, показали в своих работах ученые из Австралийского национального университета, Роберт Кухарски и его коллеги. В 2008 году Science опубликовал результаты их исследований о влиянии фермента ДНК-метилтрансферазы-3 (DNMT-3) на продолжительность пчелиной жизни [13]. Долгое время оставалось загадкой, каким образом из генетически совершенно одинаковых личинок появляются две разные касты пчел — рабочие и королевы (или матки).
Рисунок 2. Комплекс ДНК-метилтрансферазы с ДНК.
Если рабочие пчелы живут всего несколько недель, то матки — несколько лет. Такая огромная разница в длине жизненного пути генетически одинаковых организмов является следствием особого питания: тех личинок, которым суждено стать королевами, дольше кормят маточным молочком. Молекулярные механизмы этого явления стали понятны, когда Р. Кухарски и его команда искусственно уменьшили количество фермента DNMT-3 у личинок пчел. Этот фермент прикрепляет метильные группы к ДНК (рис. 2), подавляя экспрессию генов. Без DNMT-3 активность некоторых генов у личинок оказалась повышенной, и в итоге большинство из них превратилось в королев даже без кормления маточным молочком. Расшифровка пчелиного эпигенома подтвердила это предположение: в ДНК пчеломаток было найдено значительно меньше метильных групп, чем у рабочих пчел. Несколькими годами позже группа Р. Кухарски, проводя исследование уровня метилирования цитозина в нервной системе рабочих пчел и пчеломаток, нашла 561 ген со значительными различиями в метилировании между двумя пчелиными группами [14].
Конечно, не только особенности эпигенома влияют на срок жизни пчеломатки. Как сегодня известно, долгожительницу из королевы делает совокупность факторов: это и нужное соотношение полиненасыщенных и насыщенных жирных кислот, и уменьшенное содержание цитохрома с (который способен запускать процесс клеточной гибели, апоптоз), и повышенная антиоксидантная активность [15].
Как выяснилось, влияние эпигенома на продолжительность жизни чрезвычайно велико и у людей. Так, в 2013 году большая группа итальянских генетиков, возглавляемая Джованни Витале, опубликовала результаты работы, в ходе которой изучались возрастные изменения метилирования ДНК [16]. Объектами исследования стали две группы женщин-ровесниц, жительниц Северной Италии. В одной группе были собраны пожилые итальянки, имевшие матерей-долгожительниц и отцов, проживших не менее 77 лет. К другой группе отнесли итальянок, родители которых умерли, прожив около 70 лет (отцы — 67 лет, матери — 72 года). Распределив таким образом исследуемых, ученые поставили себе задачу сравнить, какие изменения на генном уровне могут лежать в основе долголетия. А также выяснить, существует ли явная преемственность в этом вопросе — передаются ли факторы долгожительства по наследству?
Результаты их работы превзошли все ожидания и показали следующее.
Снижение метилирования ДНК (гипометилирование), характерное для пожилого возраста, происходило гораздо быстрее у итальянок, чьи родители не дожили до 70 лет, чем у их сверстниц, имевших родителей-долгожителей. Исследователи обнаружили, что метилирование (а значит, и блокирование) элемента Alu было значительно выше у потомков долгожителей. Даже в старости люди, получившие в наследство от родителей хорошее здоровье, мало чем отличались на молекулярно-генетическом уровне от молодых людей. И такие потенциально опасные элементы генома, как ретротранспозоны, были у них надежно блокированы. Можно с большой долей уверенности говорить, что хорошее здоровье (как, впрочем, и плохое) передается по наследству.
Понимание природы эпигенетики показало, что родители ответственны за здоровье своих детей гораздо в большей степени, чем это считалось ранее. Совсем недавно было показано, что такая привычная сегодня вещь, как лишний вес будущих родителей, может самым негативным образом сказаться на их потомстве. Известный американский генетик Рэнди Джиртл и его коллеги из Университета Дьюка провели исследования ДНК лейкоцитов из пуповинной крови младенцев, родившихся в госпитале при их университете. По словам ученых, анализ зафиксировал существенное снижение уровня метилирования гена инсулиноподобного фактора роста 2 (IGF 2) у тех детей, чьи родители имели лишний вес: «Мы обнаружили у новорождённых, отцы которых страдали ожирением, значительное снижение метилирования IGF2 в ДНК, извлеченной из лейкоцитов пуповинной крови. Понижение уровня метилирования IGF2 связано с повышенным риском развития раковых заболеваний» [17].
Возрастные отклонения и эпигеном
Еще в 1994 году Зигмунд Вейцман и его коллеги из Северо-Западного университета (Чикаго) обнаружили, что окисление свободными радикалами гуанина, обязательного «напарника» цитозина в двухцепочечной ДНК, влияет на метилирование. Окисленный продукт гуанина, 8-гидроксигуанин (8-OHdG), известный маркер окислительного повреждения ДНК, не только увеличивал частоту мутаций, но и препятствовал нормальному метилированию цитозина [21]. Оказалось, что эпигеном тесным образом связан с регулированием уровня АФК: общее возрастное уменьшение метилирования ДНК развивается параллельно с повышением уровня АФК и окислительным стрессом. И эти процессы связаны между собой. Так, возрастной окислительный стресс, вызванный повышенной продукцией АФК, достоверно снижает количество уже упоминавшихся сиртуинов, к которым сегодня приковано пристальное внимание геронтологов. Сиртуины представляют собой семейство консервативных (то есть встречающихся у всех живых организмов) белков, выполняющих одну из эпигенетических функций — деацетилирование гистонов. Многочисленные эксперименты показали благотворную роль сиртуинов в поддержании здоровья и увеличении продолжительности жизни. АФК же снижают уровень этих белков, сокращая тем самым срок жизни.
Если взять наугад любую патологию из длинного списка возрастных болезней (таких, как атеросклероз, болезнь Паркинсона, диабет или ревматоидный артрит), то совершенно точно обнаружится непосредственное участие эпигенома в их развитии. Этот вопрос сегодня хорошо изучен и уже ни у кого не вызывает сомнений. К примеру, у больных атеросклерозом обнаруживается повышенный уровень токсичного для артерий гомоцистеина. И причина этого — сбой в работе сложного биохимического процесса под названием фолатный цикл, который тесно связан с метилированием ДНК и эпигеномом.
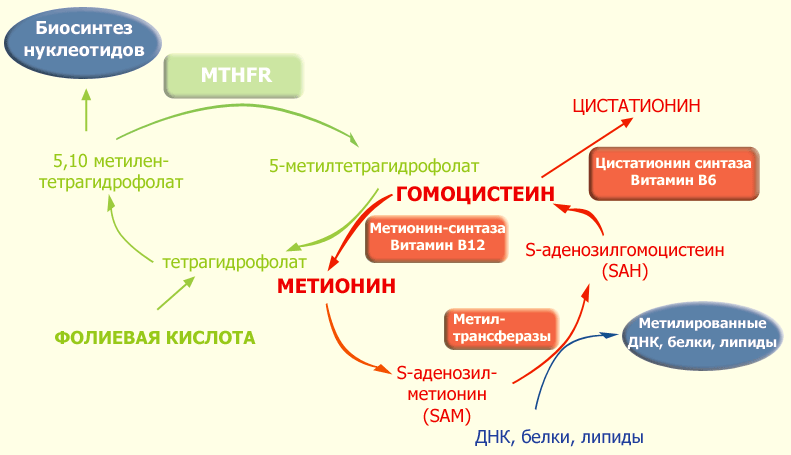
Фолатный цикл представляет собой каскад биохимических реакций, в котором задействовано большое количество ферментов (рис. 4). Для нормального протекания фолатного цикла необходимы витамины B9 (фолиевая кислота), В6 и В12. В этом цикле происходит перенос метильных групп, которые присоединяются к гомоцистеину, а избыток гомоцистеина превращается в метионин. Метионин переходит в свою активную форму, S-аденозилметионин (SАМ), который в клетке служит основным донором метильных групп, необходимых для синтеза и метилирования ДНК, РНК, белков и фосфолипидов [22].
Рисунок 4. Схема фолатного цикла. В реакции, катализируемой ферментом MTHFR, из тетрагидрофолата и серина образуется 5,10-метилентетрагидрофолат, который затем восстанавливается до 5-метилтетрагидрофолата. На следующем этапе метильная группа от 5-метилтетрагидрофолата переносится на гомоцистеин в реакции, катализируемой В12-зависимой метилтрансферазой. В результате реметилирования гомоцистеина образуется метионин. Данную реакцию катализирует цитоплазматический фермент метионинсинтаза (MTR). Для работы фермента необходим метилкобаламин, производное витамина В12. Метионинсинтаза обеспечивает преобразование гомоцистеина в метионин посредством реакции, в которой метилкобаламин выступает в роли промежуточного переносчика метильной группы. При этом происходит окисление кобаламина, и фермент MTR переходит в неактивное состояние
В фолатном цикле может произойти сбой по двум причинам: генетическим (из-за мутаций генов ферментов фолатного цикла) или алиментарным (из-за дефицита метионина, фолиевой кислоты и других витаминов группы В). Дефицит возникает, если в рационе недостает продуктов, богатых этими веществами, или если эти вещества плохо усваиваются — как правило, на фоне вредных привычек, приема лекарств, инфекций и др.
Нарушение фолатного цикла угрожает организму сразу тремя последствиями. Первое: низкий уровень одного из производных этого цикла, 5,10-метилентетрагидрофолата, приводит к разрывам в ДНК и нарушению процессов репарации [23]. Второе: возникает дефицит основного донора метильных групп, S-аденозилметионина (SAM), без которого невозможно производить метилирование ДНК. И третье последствие: нарушается метаболизм гомоцистеина, и его уровень в крови начинает расти. А далее токсичный для клеток гомоцистеин запускает цепную реакцию со множеством патологических ответвлений.
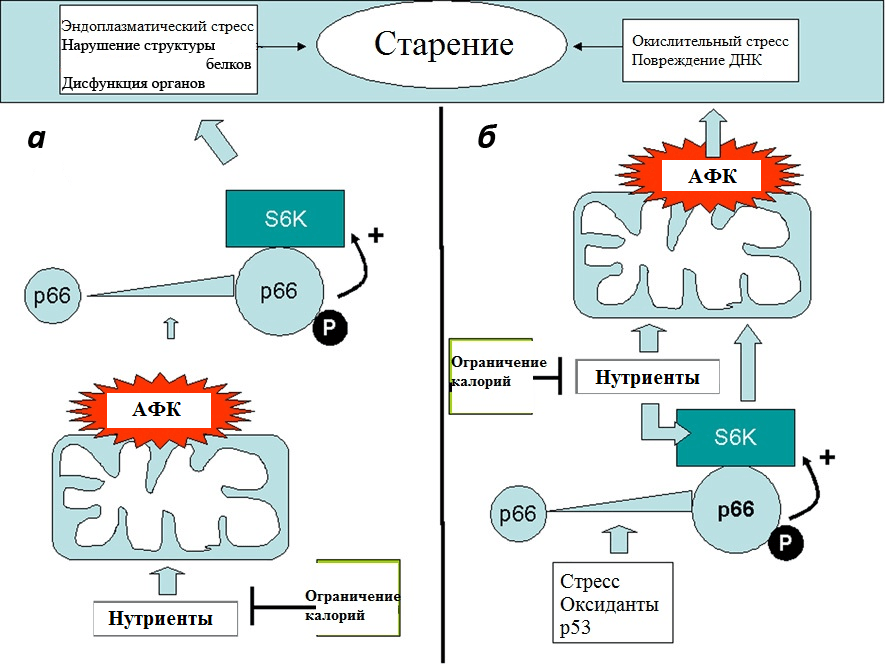
Итальянский исследователь Джовамбаттиста Пани связал возрастную активность p66 Shc и АФК с еще одним белком, вызывающим повышенный интерес у геронтологов, — mTOR (мишень рапамицина у млекопитающих), который регулирует в клетке процессы, связанные с развитием и клеточным ростом (рис. 5) [27]. По мнению одного из самых авторитетных исследователей mTOR, Михаила Благосклонного (Roswell Park Cancer Institute, США), этот белок занимает одно из центральных мест в процессах старения живых организмов, стимулируя развитие возрастных патологий, укорачивающих жизнь [28].
Рисунок 5. Две модели, показывающие, как p66 Shc может объединять АФК и mTOR/S6K-каскад в процессе старения. а — АФК активируют белок p66 Shc (или просто p66), который в свою очередь активирует рибосомную S6-киназу (S6K). АФК могут производиться в митохондриях в ответ на поступление питательных веществ (нутриентов), таким образом создавая альтернативный маршрут для детекции питательных веществ посредством S6K. б — Активированная p66 киназа S6K увеличивает образование АФК в митохондриях. В этом случае р66 может стимулироваться клеточным стрессом, белком р53 или экзогенными оксидантами. В обоих примерах воздействие р66 на старение тормозится ограничением калорий, что снижает поставку нутриентов. Активация p66 происходит в результате повышенной экспрессии (показана увеличенным значком) и фосфорилирования серина (буква «Р»). Оба изменения возникают в ответ на различные стрессы в клетках млекопитающих.
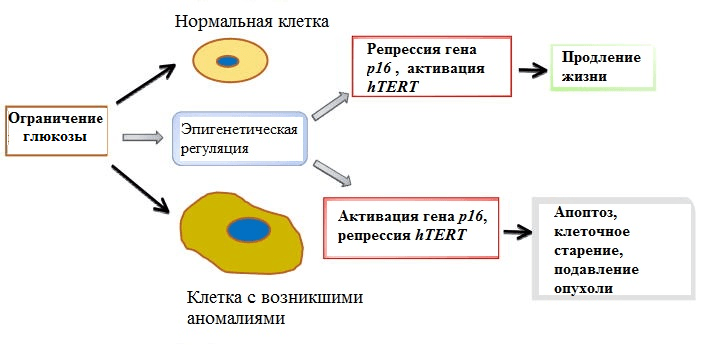
Сегодня большое внимание геронтологов приковано к механизмам благотворного воздействия на организм ограничения калорий. Как показали исследования, урезанный по калориям рацион может продлевать жизнь. Самый яркий и часто приводимый пример такого влияния — жители японского острова Окинава, которые при суточном рационе менее 2000 ккал уверенно держат первое место в мире по числу долгожителей. Суть этого феномена складывается из многих факторов, в том числе и из эпигенетических. Обнаружилось, что ограничение калорий меняет в позитивную сторону профиль метилирования ДНК: снижается метилирование генов — подавителей опухолевого роста, что ведет к их активации, и повышается метилирование онкогенов. Кроме этого, ограничение количества потребляемой глюкозы, которая дает немалую часть калорий, в эксперименте приводило к феномену расширения лимита Хейфлика — предела клеточного деления, лежащего в основе ограниченности срока жизни клетки (рис. 6). И опять это происходило вместе с изменениями эпигенома — изменениями в метилировании ДНК и модификациями гистонов, влияющими на активность ключевых генов — р16 и hTERT [30].
Рисунок 6. Влияние ограничения потребления глюкозы на продолжительность жизни. Ограничение поступления глюкозы может влиять на эпигенетическую регуляцию как в нормальных, так и в раковых клетках. В нормальных клетках это приводит к репрессии гена р16 и активации hTERT, что позволяет расширить лимит Хейфлика. Белок р16 замедляет процесс размножения клеток, ген hTERT кодирует фермент теломеразу, способный наращивать концевые участки ДНК, сокращающиеся при делении клеток, — теломеры. В предраковых клетках противоположные эффекты на p16 и hTERT приводят к апоптозу и гибели опасных клеток.
Эпигеном и теломеры
Еще один ассоциированный с возрастом процесс — укорочение теломер (повторяющихся последовательностей ДНК, стабилизирующих концевые участки хромосом, но уменьшающихся в длине при каждом клеточном делении) — также оказался тесно связанным с эпигеномом.
Очевидно, что гистоны хроматина играют очень важную роль в нормальной работе генома. И обнаруженное американскими исследователями возрастное снижение их синтеза, связанное с делением клетки и укорочением теломер, может приводить к дестабилизации генома. По предположению О`Салливана и его коллег, хронический стрессовый сигнал генерируется за счет сокращения теломер и приводит к снижению синтеза гистонов двух видов, H3 и H4. В свою очередь, это не позволяет точно восстановить ландшафт хроматина при следующем делении, и повреждение ДНК постепенно ограничивает жизнь клетки. Даже незначительные изменения в равновесии системы «ДНК — гистоны», по мнению ученых, могут нарушить синтез ДНК, архитектуру хроматина и жизнеспособность клеток.
Но, как оказалось, это не единственно возможная взаимосвязь теломер, старения и эпигенома. Не так давно проследили еще одну потенциальную связь. В.А. Галицкий и его коллеги из Института биохимии им. А.А. Палладина (Киев) описали возможность укорочения теломер на фоне возрастной геномной нестабильности. И вот как это может выглядеть.
По мнению украинских биохимиков, микроРНК в стволовых клетках поддерживают исходный профиль эпигенетических маркеров, что и лежит в основе уникальных качеств стволовых клеток (в первую очередь, их способности к долгой жизни). Но дифференцировка — превращение стволовых клеток в специализированные — требует репрессии генов некоторых микроРНК, чтобы те не мешали активности ряда нужных генов. В результате этого происходит возрастная потеря эпигенетических маркеров, снижается уровень метилирования ДНК. А это может приводить к дерепрессии «дремлющих» в ДНК ретротранспозонов и других мобильных элементов и, как следствие, к их перемещениям и повреждению ДНК. В ответ в клетке могут запуститься системы репарации ДНК, провоцирующие несанкционированные рекомбинации в участках теломер (так называемых теломерных кэпах). И по этой причине теломеры будут терять свою длину [33]. А укорочение теломер, как мы знаем, выступает одним из признанных маркеров старения организма.
Этот процесс на примере профориентации клеток крови прекрасно проиллюстрирован (в прямом смысле) в комиксе «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [34]. — Ред.
Заключение. «Эпигенетический дрейф»
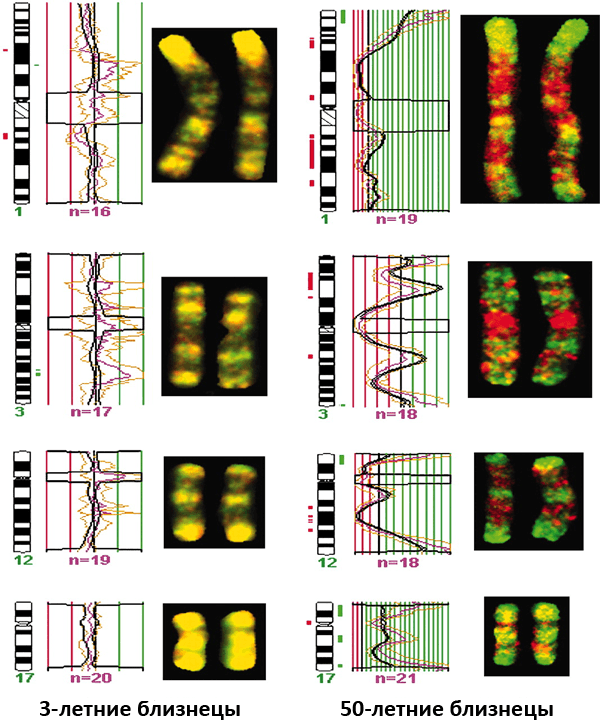
Насколько сильно меняется эпигеном с возрастом в зависимости от внешних факторов, наглядно показали исследования ДНК близнецов, выполненные испанскими учеными, Марио Фрага и его коллегами. Изучая монозиготных (однояйцевых) близнецов, они определили, что близнецы в возрасте трех лет идентичны не только генетически, но и эпигенетически [35]. А вот у 50-летних — по-прежнему одинаковых генетически — людей возникают существенные эпигенетические различия (рис. 7). Причем тем больше, чем внушительнее географическая дистанция между местами их проживания и, следовательно, разница в условиях проживания. Это может говорить о том, что подобные различия возникают не случайно, а зависят от условий, в которых живут люди.
Рисунок 7. Разница в метилировании ДНК близнецов в возрасте трех и 50 лет. Для того чтобы определить эпигенетические различия между близнецами, исследователи разработали оригинальную методику окраски одинаковых участков (локусов) гомологичных хромосом. В случае одинаковой экспрессии эти локусы окрашивались в желтый цвет, если были гипометилированы — в красный, а если гиперметилированы — в зеленый. Так вот, если у 3-летних близнецов хромосомы были окрашены практически полностью в желтый цвет, то у 50-летних явно доминировали зеленый и красный.
Результаты всех этих исследований позволили немецкому генетику Акселю Шумахеру разработать концепцию «эпигенетического дрейфа» — постепенного изменения с возрастом профиля метилирования ДНК [36]. Согласно концепции, возрастзависимый «эпигенетический дрейф» является естественным процессом, наблюдающимся у всех, даже полностью здоровых людей. Но у тех, кто подвергается сильному влиянию окружающей среды, вредных привычек, стрессов, неправильного питания, дрейф может «давать крен» в сторону неблагоприятных профилей, негативно меняя работу генома.
О природе различных, не только эпигенетических, возрастных изменений в клетках и возможных путях их преодоления образно рассказывает статья «Зачем клетки стареют» [37]. — Ред.
После всех проведенных исследований ученые могут уверенно говорить, что основу долголетия и хорошего здоровья вместе с другими факторами во многом определяет именно состояние эпигенома. А оно складывается из двух составляющих: из того, что мы получили в наследство от своих родителей, и из привычек, которые мы выработали в нашей жизни. Как сказал один из основоположников эпигенетики, профессор МГУ Б.Ф. Ванюшин, «нет никакого сомнения в том, что метилирование ДНК и модификации гистонов, а также избирательный сайленсинг генов малыми РНК играют очень важную роль в жизни клетки и организма, поэтому дальнейшие исчерпывающие исследования в этой захватывающей области знаний — очень важная и плодотворная задача нашего века» [38]. И с этим трудно поспорить. Остается ждать новых открытий, которые подарит нам область знаний, стремительно ворвавшаяся в нашу жизнь, — наука ЭПИГЕНЕТИКА.