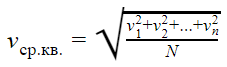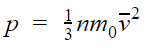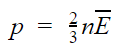что такое газ и какими свойствами обладает
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
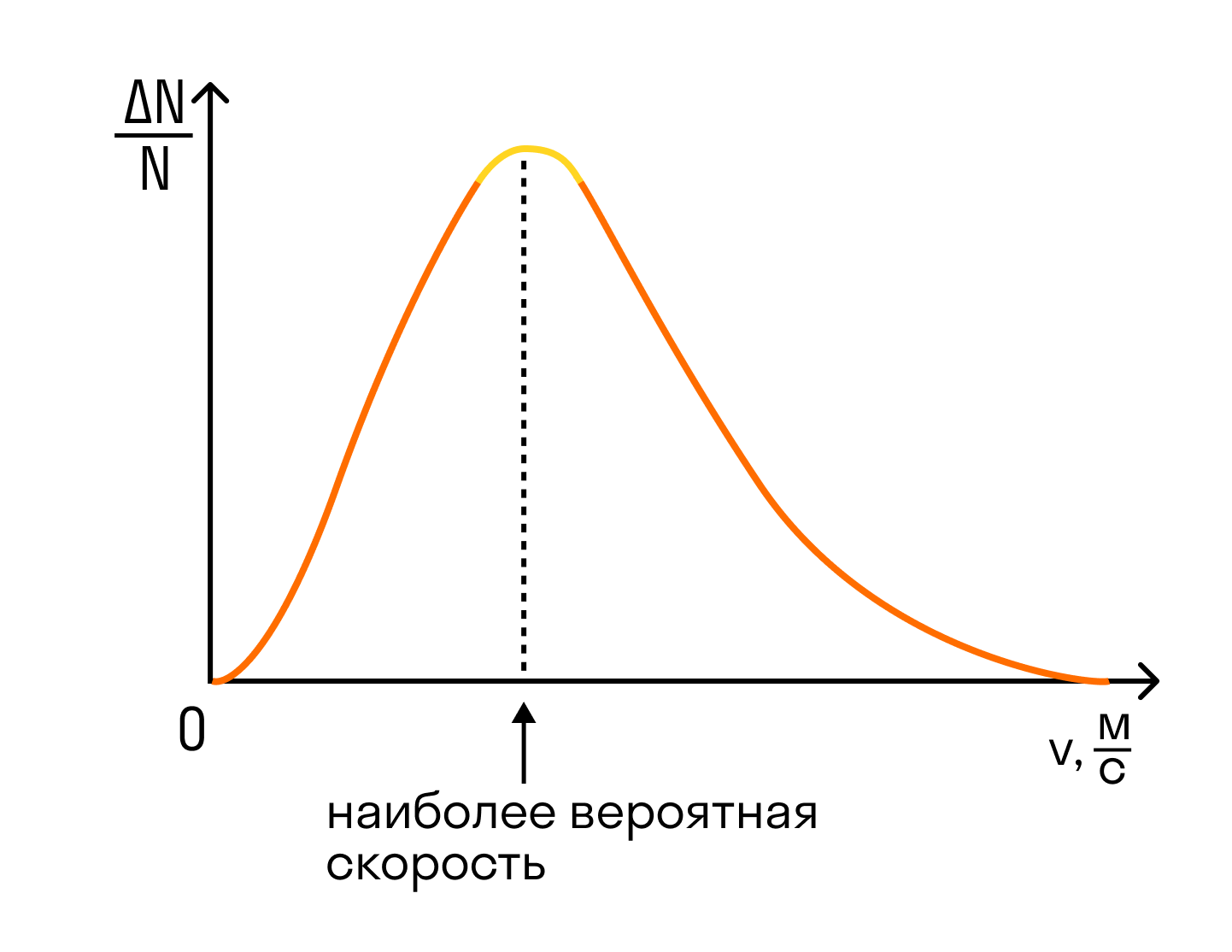
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
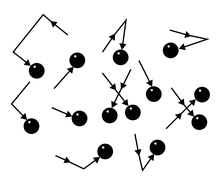
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
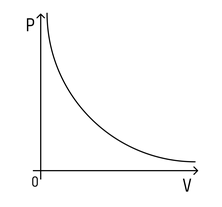
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
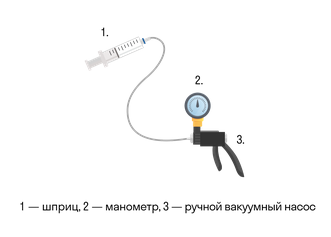
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
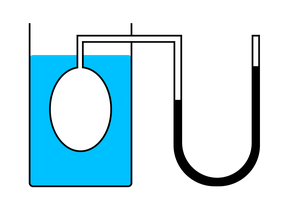
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
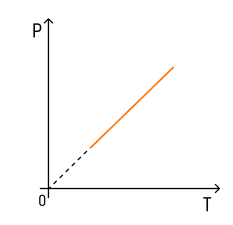
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Газообразные вещества и их характеристика
Газообразные вещества – вещества со слабыми связями между частицами. Главные свойства газов – это подвижность и хаотичное движение частиц, направление которых меняется при столкновении. Газ – одно из 4 агрегатных состояний веществ, которые на сегодняшний день известны науке.
Четыре агрегатных состояния вещества
Газообразное состояние вещества – одно из трех «классических». Помимо него, выделяются также твердые и жидкие вещества. В последнее время в учебниках встречается определение и четвертого агрегатного состояния – плазмы. Это ионизированные (частично или полностью) газы. Четвертый тип агрегатного состояния был выявлен при изучении космоса, и, оказывается, он встречается во Вселенной чаще всего. Плазма – это составная часть многих планет, основа звезд, туманностей, высших слоев атмосферы Земли.
Далее речь пойдет о газах. Они были открыты сравнительно недавно, позже жидких и твердых веществ, так как не поддавались изучению человеческим глазом. Развитие науки в сфере газообразных соединений началось с XVII века.
Краткая история открытия газов
Современное название газам дал Жан Баптист ван Гельмонт (1580-1644), голландский химик. В первые годы XVII века он экспериментальным путем впервые получил «мертвый воздух» (углекислый газ). С этого и началось изучение газообразных соединений. Слово «газ» Гельмонт выбрал для названия по аналогии с греческим словом «хаос», так как, по его словам, видел в полученном им «паре» сходство с «хаосом древних». Но некоторые ученые спорят, что принятое сейчас обозначение все же пошло от немецкого «gasen», что в переводе означает «кипеть».
Больше всего открытий ученые совершили позже, уже в XVIII-XIX веках. В 1802 г. французский исследователь Гей-Люссак открыл закон теплового расширения газов: при повышении температуры увеличивается объем газообразных веществ. Вдохновленный его примером, в 1811 итальянский химик Амедео Авогадро открыл закон, который позднее назвали его же именем. Закон звучит так: «число молекул всегда одно и то же в одинаковых объемах любых газов». Иными словами, в 1 моле любого газообразного вещества при одинаковых условиях (давление, температура) одно и то же число частиц. Это число – число Авогадро: 6,02 * 1023.
Помимо выделения общих законов, в тот же период ученые постепенно открывали отдельные газы:
На июль 2017 года открыто 826 газов, а в будущем, возможно, к газообразному агрегатному состоянию припишут еще 90 веществ. Многие открытые газы не природные, они получены в лабораторных условиях.
Свойства газообразных веществ
Выделяется целый ряд физических и химических свойств газов. Основные физические свойства:
Если же газ подвергнуть высоким температурам, сначала он станет разреженным. Увеличится скорость теплового движения частиц. При достижении определенного температурного показателя произойдет тепловая ионизация, вещество перейдет в следующее агрегатное состояние – плазму.
Некоторые газы не имеют цвета, другие же заметны человеческому глазу. Например, I2, йод. Это вещество получают путем сублимации кристаллов йода, и его клубы имеют ярко выраженный фиолетовый оттенок. Но большинство соединений все же бесцветные, прозрачные и легкие, поэтому долгое время их не могли открыть и изучить.
Классификация газов
Вещества в газообразном состоянии принято делить на несколько категорий. Классификацию часто просят отразить в конспектах во время школьных занятий. Рассмотрим самые распространенные ее типы.
Органические и не органические
Органическими газами являются те вещества, которые содержат углерод. Примеры:
Простые и сложные
Органические и не органические газы, в свою очередь, делятся на простые и сложные. Перечисленные выше органические соединения – сложные. В них содержатся разные атомы: ацетилен (C2H2) – 2 атома углерода и 2 атома водорода, этилен (С2Н4) – 2 атома углерода и 4 водорода. Если же газ получается из одного или нескольких атомов одного и того же элемента таблицы Менделеева, его называют простым.
Простые газы: кислород O2, азот O3, водород H2, хлор Cl2. Перечислять можно и дальше.
Газообразные вещества в химии
Газы в химии начинают изучать в 8 классе. Рассмотрим основные свойства, которые принято включать в учебники по предмету.
Атомы или молекулы газов соединяются между собой ковалентными связями. Они очень слабые и часто рвутся, именно поэтому вещества в газообразном агрегатном состоянии способны заполнять произвольные объемы и емкости разных форм. Бывают два вида строения решеток у газов:
На уроках химии газообразные вещества часто получают в лабораторных условиях. Для этого могут пользоваться разными методами: нагревать жидкость, твердые вещества, добиваться реакции между сложными соединениями. Некоторые формулы реакций:
Zn + 2HCl = ZnCl2 + H2 – водород.
NH4Cl + NaOH = NaCl + H2O + NH3 – аммиак
CaCO3 + 2HCl = CaCl2 + H2O + CO2 – углекислый газ.
Так как многие газы прозрачны и не имеют запаха, используются дополнительные методы их обнаружения. Одни соединения усиливают пламя, другие останавливают горения. Ряд газообразных веществ может менять цвет взвешенной в воде извести, делать жидкость мутнее.
Примеры газов
В списке газов свыше 800 наименований. Стоит рассмотреть самые распространенные:
Все перечисленные газы входят в состав воздуха и образуют земную атмосферу. Но большая часть, 98-99%, приходится на азот и кислород.
Если имеется желание, познакомиться с газообразными веществами поближе всегда можно при помощи лабораторных экспериментов. Однако при работе с газами нужно соблюдать предельную осторожность.
ГАЗ (состояние вещества)
Полезное
Смотреть что такое «ГАЗ (состояние вещества)» в других словарях:
ЭКСТРЕМАЛЬНОЕ СОСТОЯНИЕ ВЕЩЕСТВА — состояние с аномально высокой концентрацией энергии, возникающее под воздействием высоких давлений и (или) температур. Физика Э. с. в. (физика высоких плотностей энергии) охватывает физику давлений высоких и физику плазмы, составляя важную часть… … Физическая энциклопедия
Газы (агрегатное состояние вещества) — Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им… … Большая советская энциклопедия
ГАЗ — (фр. gaze). Легкая прозрачная ткань из шелка или льна; название свое получила от сирийского гор. Gaza, где впервые была приготовлена. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГАЗ (франц. gaz, от нем. gaschen … Словарь иностранных слов русского языка
газ — 1. ГАЗ, а ( у), предл. на газе; (разг.) на газу; м. [франц. gaz] 1. Физическое состояние вещества, при котором его частицы (атомы и молекулы) движутся свободно и обладают способностью распространяться и заполнять доступное пространство; вещество … Энциклопедический словарь
газ — сущ., м., употр. сравн. часто Морфология: (нет) чего? газа и газу, чему? газу, (вижу) что? газ, чем? газом, о чём? о газе и на газу; мн. что? газы, (нет) чего? газов, чему? газам, (вижу) что? газы, чем? газами, о чём? о газах 1. Газ это… … Толковый словарь Дмитриева
Газ (значения) — Газ: Газ агрегатное состояние вещества. Газ просторечное обозначение природного газа и систем его подачи. Газ лёгкая прозрачная ткань. ГАЗ аббревиатура от Горьковский автомобильный завод. «Группа ГАЗ» российская… … Википедия
ГАЗ — ГАЗ, состояние (ФАЗА) ВЕЩЕСТВА, при котором молекулы свободно движутся в любых направлениях; газ всегда распространяется (путем ДИФФУЗИИ) по резервуару любого размера, стремясь заполнить его полностью. В силу низкой плотности, основная масса… … Научно-технический энциклопедический словарь
ГАЗ — (французское gaz, от греческого chaos хаос), агрегатное состояние вещества, в котором энергия движения его частиц (атомов, молекул) значительно превышает энергию их взаимодействий. Таким образом, частицы газа движутся свободно (между… … Современная энциклопедия
Газ — (французское gaz, от греческого chaos хаос), агрегатное состояние вещества, в котором энергия движения его частиц (атомов, молекул) значительно превышает энергию их взаимодействий. Таким образом, частицы газа движутся свободно (между… … Иллюстрированный энциклопедический словарь
ГАЗ — (франц. gaz от греч. chaos хаос), агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы… … Большой Энциклопедический словарь
Газы (агрегатное состояние вещества)
При Т > Т к граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между Г. и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору вещества (кривую постоянной плотности или удельного объёма, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать Г., обладает огромной плотностью (например, в центре некоторых звёзд
Молекулярно-кинетическая теория Г. Молекулярно-кинетическая теория рассматривает Г. как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства Г., особенно полно — свойства разреженных Г.
У достаточно разреженных Г. средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см 3 Г. находится
10 19 молекул и среднее расстояние между ними составляет
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры — температура есть мера кинетической энергии молекул.
Поскольку молекулы идеального Г. обладают лишь кинетической энергией, внутренняя энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля).
Молекулярно-кинетическая теория рассматривает давление Г. на стенки сосуда, в котором он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
где n — число молекул в единице объёма. Уравнения (2) и (3) позволяют записать уравнение состояния идеального Г. в виде
В условиях теплового равновесия температура и давление Г. по всему его объёму одинаковы, молекулы движутся хаотично, в Г. нет упорядоченных потоков. Возникновение в Г. перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин.
kT ) к их потенциальной энергии ( e — глубина потенциальной ямы при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г. При повышении плотности изменяются свойства Г., они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г. становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г. пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г. от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г. (см. Ван-дер-Ваальса уравнение ).
К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критической точки, относится вириальное уравнение состояния :
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
С межмолекулярным взаимодействие связано также изменение температуры реального Г. при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется дросселированием ). Мерой изменения температуры Г при дросселировании служит Джоуля — Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. температуре инверсии (см. Джоуля — Томсона явление ). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Для точного расчёта калорических свойств Г. необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.