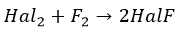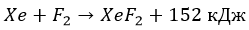что такое галогены в химии кратко и понятно
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
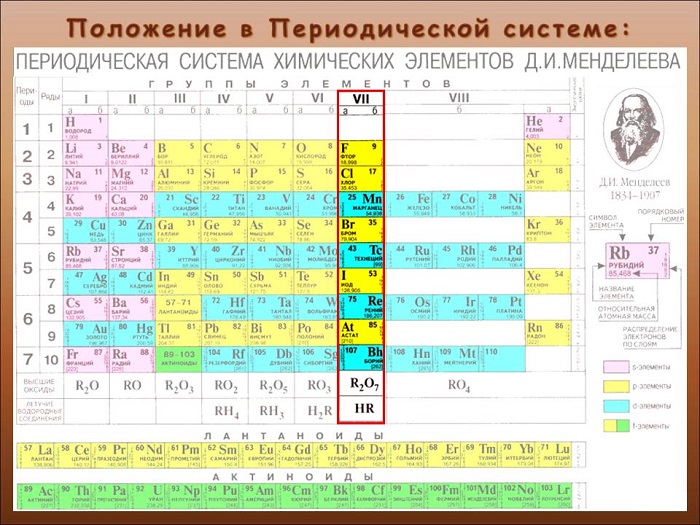
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
Что такое галогены в химии кратко и понятно
3667 дн. с момента
как существует сайт
Владельцы сайта
Галогены
Химия неметаллов VIIA группы.mp4
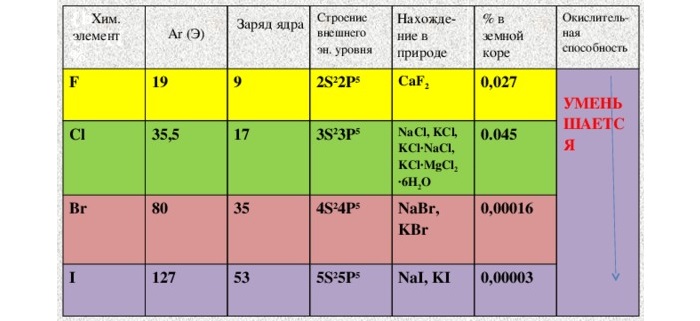
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.
Все эти элементы являются типичными неметаллами. Галогены, означает « рождающие соли»
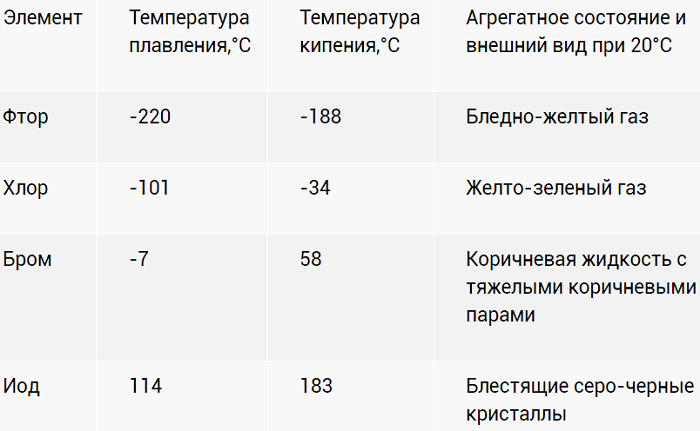
Рассмотрим таблицу, в которой отражены физические свойства галогенов.
Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.


И з таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность.
Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия.
От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются.
Галогены
1. Электролиз растворов и расплавов галогенидов:
2 KF = 2 K + F 2 (единственный способ полученияя F 2 )
2. Окисление галогенводородов:
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – лабораторный способ получения хлора
Получение хлора.mp4
3. Промышленный способ – окисление хлором (для брома и йода):
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
2Al + 3F 2 → 2 AlF 3
Взаимодействие хлора с медью.mp4
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl 2 + H 2 →2 HCl (на свету)
Взаимодействие хлора с водородом.mp4
F 2 + H 2 → 2HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Р хлор.mp4
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
2H 2 O + 2F 2 →4 HF + O 2
Cl 2 + H 2 O → HCl + HClO
H 2 O + Br 2 → HBr + HBrO
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
2KCl + F 2 → 2KF + Cl 2
2KBr + Cl 2 → 2KCl + Br 2
KBr + I 2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Взаимодействие хлора с органическими веществами
Взаимодействие хлора со скипидаром.mp4
Виртуальная практическая работа
Лабораторная работа “Химические свойства галогенов” (проделайте опыты, уравнения реакций можно не составлять)
Модуль включает модели приборов и веществ, необходимых для изучения химических свойств хлора, инструкцию, указывающую порядок действий. Ученику предлагается провести взаимодействие хлора с серой и медью, сфотографировать результаты взаимодействия.
Если Вы хорошо изучили эту часть урока, вставьте 5 пропущенных слов в тексте.
химические свойства галогенов
5 пропущенных слов
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H 2 SO 4 → NaHSO 4 + HCl↑
CaF 2 + H 2 SO 4 → CaSO 4 + 2HF
PBr 3 + 3H 2 O → 3HBr↑ + H 3 PO 3
H 2 S + I 2 → S + 2HI
Mg + 2HBr → MgBr 2 + H 2 ↑
Zn + 2HCl → ZnCl 2 + H 2 ↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na 2 O + 2HCl → 2NaCl + H 2 O
ZnO + 2HI → ZnI 2 + H 2 O
KOH + HCl → KCl + H 2 O (реакция нейтрализации)
Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO 3 + HCl → AgCl + HNO 3
Li 2 CO 3 + 2HBr →2 LiBr + H 2 CO 3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
4HI + MnO 2 → I 2 + MnI 2 + 2H 2 O
2HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
4HI + O 2 → 2H 2 O +2 I 2
2HI + Br 2 → 2HBr + I 2
2HCl + H 2 SO 4 → Cl 2 + SO 2 + 2H 2 O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO 2 с плавиковой кислотой.
SiO 2 + 4HF → SiF 4 + 2H 2 O
Растворение стекла в плавиковой кислоте.mp4
Обнаружить ионы галогенов возможно воздействием на растворы солей, содержащих галоген ион нитратом серебра (AgNO3). При наличии хлор-иона образуется белый творожистый осадок хлорида серебра: NaCl + AgNO3 → NaNO3 + AgCl↓ При наличии бром-иона образуется бледно-желтый творожистый осадок бромида серебра: NaBr + AgNO3 → NaNO3 + AgBr↓ При наличии бром-иона образуется желтый творожистый осадок иодида серебра: NaJ + AgNO3 → NaNO3 + AgJ↓
Осадки не растворимы в воде и азотной кислоте.
Применение галогенов и их соединений
Природное соединение фтора — криолит Na 3AlF 6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон. Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
Галогены: список элементов и химические свойства
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень галогенов
Галогены являются хорошими окислителями, по этой причине в природе их можно встретить только в каких-либо соединениях. Чем выше порядковый номер, тем химическая активность элементов этой группы меньше. К группе галогенов относятся нижеперечисленные элементы:
Последний разработан в институте ядерных исследований, который расположен в городе Дубна. Фтор относится к ядовитым газам бледно-жёлтого цвета. Хлор также ядовит. Это газ, имеющий довольно резкий и неприятный запах светло-зелёного цвета. Бром имеет красно-бурый окрас, это ядовитая жидкость, которая может даже поражать обоняние. Он очень летуч, поэтому его хранят в ампулах. Йод — кристаллическое легко возгоняющееся вещество тёмно-фиолетового цвета. Астат радиоактивен, цвет кристаллов: чёрный с синевой, период полураспада составляет 8,1 часа.
Положение галогенов в периодической системе и строение атомов
Слово «галоген» произошло от греческих «хальс» –соль и «генос» –рождаю, буквально: рождающий соль.
Это название изначально было предложено для хлора, так как хлор был получен электролизом поваренной соли.
А уже в дальнейшем это название распространилось на фтор F, бром Br и йод I.
Таким образом, галогены – это химические элементы главной подгруппы VII группы периодической системы химических элементов:
Галогены – элементы, у которых наиболее ярко выражены свойства неметаллов.
В свободном виде они в природе не встречаются!
Наиболее распространенные минералы, в состав которых входят галогены:
CaF2– флюорит (плавиковый шпат)
NaCl– галит (каменная соль)
КСl х NaCl– сильвинит
MgCl2 х 6Н20 – бишофит.
Бром Br и йод I встречаются в виде соединений в природных водах.
Морские водоросли ламинарии активно накапливают йод и поэтому являются источником для его получения.
Астат At – радиоактивный элемент и поэтому его свойства не изучены.
Название «астат» переводится с греческого языка «неустойчивый».
Он был предсказан ещё Дмитрием Менделеевым, который назвал его «эка-йод».
По оценкам учёных, во всей земной коре этого элемента насчитывается около 1 грамма (!), он постоянно образуется в процессе распада урана, но и столь же быстро распадается.
На внешнем энергетическом уровне у всех атомов галогенов по семь электронов.
Этим объясняется общность их свойств.
Однако эти элементы, за исключением фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7.
Разнообразие значений степеней окисления объясняется электронным строением атомов, а точнее, внешними электронами.
Из электронного строения атома фтора следует, что фтор может принять только один электрон на 2s-подуровень.
Кроме того, это самый электроотрицательный элемент – ни один другой элемент просто-напросто не способен отнять у атома фтора электрон.
Электронное строение атома фтора:
Однако у атома хлора имеется еще пять пустых 3d-орбиталей, и поэтому, если сообщить атому энергию, то возможен перескок электронов c 3s и 3p орбиталей на 3d орбитали, и тогда количество неспаренных электронов увеличивается и может быть 3, 5 или 7.
Поэтому возможные степени окисления хлора: +1, +3, +5, +7.
На схеме ниже показано электронное строение атома хлора в основном и в возбужденном состояниях.
Из схемы видно, почему максимальная валентность хлора равна 7.

Распространённость элементов и получение простых веществ
Чем больше величина атомного радиуса, тем меньше наличие солеродов в теле планеты. Величина r – радиуса атома фтора, по сравнению с радиусом атома иода, говорит о том, что фтор более распространён, нежели йод. Астата в коре планеты всего лишь граммы.
Промышленность производит галоиды (устаревшее название) в больших объёмах. При этом по количеству изготовленной продукции лидирует хлор.
Простые вещества получают при помощи галогенидов, окисляя их. Для этого используется электролитическое окисление. Причём из-за того, что положительные потенциалы у фтора и хлора достаточно высокие, приходится применять сильные окислители.
Важно! Электролиз фтора осложнён невозможностью использования водных растворов. Его потенциал окисления выше, и он может вступать в реакцию с водой, поэтому используют плавиковую кислоту.
Электролиз NaCl с применением анодов из графита позволяет добывать хлор. Катоды при этом могут быть:
Уравнение, описывающее эту реакцию, имеет вид:
Выполняя химическое окисление бромида-иона из морской воды, получают бром.
Так же добывают и йод, используя насыщенные им рассолы. Оба процесса проводят, применяя хлор в виде окислителя. Воздушным потоком, проходящим через раствор, удаляются I2 и Br2.
Химические свойства галогенов
Способность вступать в реакцию с разными веществами под воздействием сторонних факторов индивидуальна для каждого из рассматриваемых элементов.
Химические особенности солеродов
При вступлении галогенов в связь с медью (малоактивный металл) получаются галогениды с формулой:
CuHal2, где Hal2 – солероды Br, Cl, F.
Когда галогениды вступают в реакцию с галогенами, то тот солерод, который активнее, вытесняет малоактивный из его же раствора. Хлор, являясь окислителем, вступает во взаимодействие в смесях солей йода и брома. Бром не реагирует на хлориды, но может из иодидов выдавить йод.
При воздействии на органические соединения при хлорировании воды или йодировании соли происходит галогенирование. При этом атом галогена вводится в соединение. Галогенирование может осуществляться замещением, расщеплением или присоединением атома солерода к атомной структуре органических соединений.
Интересно. Йод, имея низкие окислительные способности, не выдавливает из солей галогены. С фтором реакции водных сульфитов вообще не получаются, он вступает в содействие с Н2О.
Физические свойства галогенов
Это характеристики, описывающие цвет, запах, температуры изменения свойств, а также агрегатное пребывание в нормальных условиях.
Физические свойства простых двухатомных веществ
Внимание! Такие токсичные вещества, как галогены, образовывают взаимные соединения: BrCl, ICl, IBr и иные. Три состояния (твёрдое, жидкое и газообразное) присущи солеродам при комнатной температуре.
Растворимость галогенов
Молекулы галогенов неполярны и, как обычно для неполярных веществ, умеренно растворимы в воде (за исключением фтора, который энергично взаимодействует с водой), причем растворимость брома максимальна. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора. Этот раствор называется хлорной водой (для брома и йода – бромная и йодная вода соответственно). При пропускании хлора в охлажденную до 0 °C воду из раствора выделяются зеленовато-желтые кристаллы клатратных соединений Cl2·8H2O и Cl2·6H2O. Это вещество плавится инконгруэнтно при 9,6 °C.
Значительно лучше неполярные галогены растворяются в неполярных органических растворителях (за исключением хлора и фтора, которые интенсивно реагируют практически со всеми органическими растворителями). CS2, C2H5OH, C2H5OC2H5, CHCl3, CCl4, C6H6, бензине – “подобное растворяется в подобном”. Для растворения хлора можно использовать CCl4. Йод также хорошо растворим в растворах иодидов металлов за счет образования комплексного иона I3-. Это свойство позволяет легко экстрагировать галогены из водных растворов. Если, например, взболтать водный раствор йода с небольшим количеством CS2 (не смешивающегося с водой), то почти весь йод перейдет из воды в CS2, окрашивая его в фиолетовый цвет.
Особенностью галогенов является то, что растворение в воде процесс не только физический, но и химический:
H2O + Hal2 ↔ Hhal + HhalO, Hal = Cl, Br
В водном растворе галогены диспропорционируют – подробнее см. химические свойства галогенов.
Получение
Выделить вещество настолько активное, что норовит прореагировать со всем окружающим, не так просто.
Получение хлора
В промышленности хлор получают путем электролиза.
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Обычно получают из сложных солей. При интенсивном нагреве (термолиз) провоцируется распад на более простые и нужный газ.
Или электролизом KF*3HF. Аналогичный метод применяется в промышленности.
Получение йода
Йод получают с помощью окисления.
2KI + Cl2 → I2 + 2KCl
Получение брома
Бром получают с помощью окисления.
2HBr + Cl2 → Br2 + 2HCl
Применение
Химия прочно входит в нашу жизнь, внедряясь во все сферы. Человек научился применять галогены, а также его соединения на своё благо. Биологическое значение галогенов неоспоримо. Области применения их различны:

Из природного соединение криолита, химическая формула которого выглядит следующим образом: Na3AlF6, получают алюминий. Соединения фтора нашли широкое распространение при производстве зубных паст. Фтор, как известно, служит для профилактики кариеса. Спиртовую настойку йода применяют для дезинфекции и обеззараживания ран.
Наиболее широкое применение в нашей жизни нашёл хлор. Область его применения довольно многообразна. Примеры использования:
Нужно помнить, что галогены — очень токсичные вещества. Особенно ярко это свойство выражено у фтора. Галогены могут оказывать удушающее и воздействие на органы дыхания и поражать биологические ткани.
Огромную опасность могут иметь пары хлора, а также аэрозоль фтора, имеющий слабый запах, он может ощутиться при большой концентрации. Человек может получить эффект удушья. При работе с такими соединениями нужно соблюдать меры предосторожности.
Методы производства галогенов сложные и многообразные. В промышленности к этому подходят с определёнными требованиями, соблюдение которых неукоснительно соблюдаются.
Биологическая роль галогенов
Все галогены обладают очень резким запахом. Вдыхание паров фтора, хлора и брома даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек, а больших – удушение и тяжелое отравление. Жидкий бром, попадая на кожу, вызывает сильные ожоги и долго не заживающие язвы. В то же время, галогены необходимы для жизни.
Фтор важен для млекопитающих, в т.ч. и человека. Его соединения содержатся в костях и эмали зубов (0,01%). Колебания в содержании фтора в питьевой воде приводят к различным заболеваниям зубов. В то же время фтор и его соединения сильноядовиты, исключение составляют CF4, SF6 и некоторые другие химически инертные вещества.
Хлор существенно важен для многих форм жизни, включая человека. Ионы хлора в организме активируют некоторые ферменты, служат источником для образования соляной кислоты, создающей благоприятную среду для действия ферментов желудочного сока, влияют на электропроводность клеточных мембран и т.д. Соединения хлора содержатся в плазме крови и желудочном соке.
Необходим для поддержания жизни и хлорид натрия. Солевой обмен связан с водным балансом организма. Повышенное содержание хлорида натрия в организме удерживает воду в тканях.
Йод также важен для многих живых существ, в т.ч. и для человека. Соединения йода необходимы для нормальной работы щитовидной железы. Йод содержится не только в щитовидной железе, но и в надпочечниках. Гормон щитовидной железы тироксин (соединение йода) определяет общий темп процессов жизнедеятельности. Пары йода ядовиты.
Недостаток всех вышеперечисленных элементов приводит к серьезным заболеваниям.
Биологическая роль брома и астата не установлена. В небольших количествах соединения брома оказывают успокаивающее действие на центральную нервную систему. Бром очень токсичен, соединения брома, содержание анионы брома малотоксичны. Астат токсичен в силу своей радиоактивности.
Токсичность галогенов
Галогены в опасной концентрации и соединениях действуют на человека следующим образом:
Применение галогенов и галогенидов в промышленности и в быту приносит больше пользы, чем вреда. Знание допустимых значений концентрации и правил пользования продуктами, в которых применяются солероды, позволяет пользоваться только их положительными качествами.