что такое диссеминация опухоли
Диссеминированное заболевание легких — диагностика, компьютерная томография
ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС В ЛЕГКИХ — ЧТО ЭТО ТАКОЕ?
Диагностика диссеминированных процессов в легких – это самая сложная область пульмонологии. Диссеминированным называется заболевание, которое проявляется более-менее однотипным распространением (диссеминацией) патологического процесса на большую часть легочной ткани. Такое распространение процесса по легким, как правило в виде очагов, сетчатых изменений или смешанного типа, диагностируется как с помощью рентгенографии, так и с помощью компьютерной томографии (КТ).
Сложность диагностики диссеминированных заболеваний заключается в том, что похожая рентгенологическая картина может наблюдаться при огромном количестве болезней самого разного происхождения. До 80% пациентов с легочной диссеминацией получают при первичной диагностике неверные диагнозы. Кроме того, многие заболевания легких, сопровождающиеся диссеминацией, протекают бессимптомно, что также оттягивает верную диагностику. У некоторых пациентов между началом заболевания и правильно поставленным диагнозом проходит несколько лет, а кому-то правильный диагноз не выставляется вовсе.
ДИССЕМИНИРУЮЩИЙ ПРОЦЕСС В ЛЕГКИХ — ВАРИАНТЫ ПАТОЛОГИИ
Какие болезни легких способны проявляться диссеминацией на КТ и рентгенографии?
1. Альвеолиты
1. 1. Идиопатический фиброзирующий альвеолит
1. 2. Экзогенный аллергический альвеолит
1. 3. Токсический фиброзирующий альвеолит
2. Гранулематозы
2. 1. Саркоидоз легких
2. 2. Гематогенно — диссеминированный туберкулез легких
2. 3. Гистиоцитоз
2. 4. Пневмокониозы (силикоз, силикатозы, бериллиоз и др. )
2. 5. Пневмомикозы (актиномикоз, кандидоз, криптококкоз легких и др.)
3. Диссеминации опухолевой природы
3. 1. Бронхиолоальвеолярный рак
3. 2. Карциноматоз легких
3. 3. Раковый лимфангиит
4. Редкие формы диссеминированных процессов в легких
4. 1. Идиопатический гемосидероз легких
4. 2. Синдром Гудпасчера
4. 3. Альвеолярный протеиноз
4. 4. Лейомиоматоз легких
4. 5. Первичный амилоидоз легких
5. Интерстициальные фиброзы легких при поражениях других органов и систем
5. 1. Васкулиты или/и интерстициальные пневмониты при диффузных
болезнях соединительной ткани
5. 2. Кардиогенный пневмосклероз при недостаточности кровообращения
5. 3. Интерстициальный фиброз при хроническом активном гепатите
5. 4. Интерстициальный фиброз при лучевых поражениях
5. 5. Интерстициальный фиброз как исход «шокового легкого»
Как видите, список очень длинный, а ведь здесь далеко не все диссеминированные болезни!
О чем нужно задуматься, если у Вас в легких обнаружен диссеминированный процесс? Прежде всего, об исключении самых опасных болезней – туберкулеза и рака легкого! Не является ли диссеминация туберкулезной или опухолевой природы?
МНОЖЕСТВЕННЫЕ МЕТАСТАЗЫ В ЛЕГКИХ — САМЫЙ ОПАСНЫЙ ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС
Прежде всего, врачам при обнаружении диссеминированного заболевания легких необходимо исключить злокачественную опухоль. Это может быть как метастатическая диссеминация рака (гематогенный, лимфогенный карциноматоз), так и первичная диссеминированная опухоль легкого — бронхиолоальвеолярный рак. Множественные метастазы в легкое чаще всего встречаются при раке молочной железы, почек, яичников, кишечника, желудка и матки. При правильном анализе результатов компьютерной томографии (КТ) врач-рентгенолог в большинстве случаев способен отличить метастазы от других вариантов диссеминации.
КАК ОТЛИЧИТЬ ОДНО ДИССЕМИНИРОВАННОЕ ЗАБОЛЕВАНИЕ ОТ ДРУГОГО?
Если по рентгенографии или флюорографии выставлен диагноз «диссеминированной процесс легких», необходимо сделать компьютерную томографию (КТ), чтобы выяснить, какое именно заболевание лежит в основе найденных изменений. Дифференциальная диагностика диссеминированных болезней органов дыхания — одна из самых сложных областей рентгенологии. Чтобы достоверно выявить различия между многочисленными вариантами патологии, врач-рентгенолог (радиолог) должен хорошо разбираться в пульмонологии и иметь глубокие знания по лучевой диагностике легочных болезней. Увы, такие знания есть далеко не у всех врачей. Диагностикой диссеминированных болезей профессионально занимаются врачи-рентгенологи (радиологи) специализированных легочных стационаров, например, Санкт-Петербургского НИИ Фтизиопульмонологии. Они способны из множества «похожих» признаков выделить те существенные, которые указывают на правильный диагноз.
ВТОРОЕ МНЕНИЕ ПРИ ДИССЕМИНИРОВАННОМ ПРОЦЕССЕ
Нередко возникает ситуация, когда даже КТ не вносит полной ясности в диагноз. Например, врачи могут сомневаться, что у пациента: саркоидоз или метастазы в легких, диссеминированный туберкулез или грибковая инфекция, и т.п. В таких случаях полезно получить дополнительное мнение высококвалифицированного рентгенолога, который повторно проанализирует снимки и выскажет свое мнение. Подобное экспертное мнение поможет Вашему лечащему врачу уточнить диагноз и назначить правильное лечение. Если Вы живете вдалеке от крупных центров, снимки можно отправить специализированному радиологу по интернету, например через службу Национальной телерадиологической сети. Полученное в результате второе мнение по КТ легких с подписью и печатью опытного специалиста снизит риск неверного диагноза.
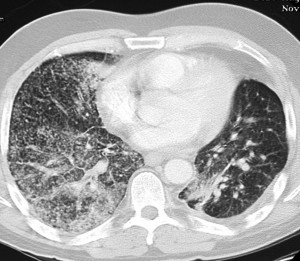
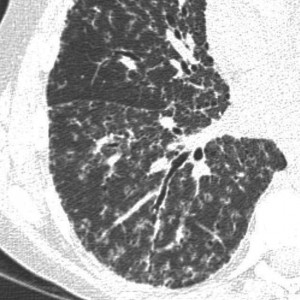
КТ при бронхиолоальвеолярном раке. Множественные хаотичные очаги, чередующиеся с участками уплотнения по типу матового стекла, фокусами альвеолярной консолидации.
КТ легких при саркоидозе. Множественные очаги, расположенные вдоль центрального интерстиция и плевральных листков, с характерной картиной «четок».
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Рак из невыявленного первичного очага
Лечение рака из невыявленного первичного очага
Рак из невыявленного первичного очага (НПО) — это злокачественное новообразование (подтвержденное морфологически), происхождение которого не представляется возможным установить ни на основании анамнеза, ни в ходе обследований, то есть отсутствует первичный очаг. Для такого злокачественного процесса, также характерны диссеминация (распространение клеток опухоли по всему органу/органам) на ранней стадии, агрессивное течение процесса, непредсказуемый характер метастазирования. По существующим данным такие пациенты составляют 3-15% онкологических больных.
Хотя метастазы без выявленного первичного очага отличаются своим происхождением из разных органов, биологическое поведение их приблизительно одинаково. Эта нозологическая форма отражает наиболее агрессивный тип злокачественных опухолей, метастазирование которых возникает на самых ранних этапах развития.
Так как заболевание уже на первых этапах проявляется метастазами, можно говорить о первично генерализованном процессе, который к моменту обращения пациента за медицинской помощью, как правило, выходит за пределы одного органа.
В зависимости от локализации и распространенности метастатического поражения больных делят на следующие группы:
Клинические проявления заболевания неспецифичны и зависят от локализации очагов метастатического поражения и распространенности опухолевого процесса. Первым симптомом чаще всего является увеличение размеров периферических лимфоузлов. Общие проявления: слабость, потливость, похудание, гипертермия более характерны при поражении органов — легких, печени. При обращении за медицинской помощью часто встречаются следующие изменения: наличие того или иного опухолевого образования, боль, увеличение печени, боли в костях, патологические переломы, респираторные нарушения, потеря веса, неврологические расстройства.
В ходе обследования после анализа данных рентгенографии органов грудной клетки, ультразвуковой томографии органов брюшной полости, забрюшинного пространства и малого таза, радиоизотопного исследования скелета и лимфоузлов, компьютерной томографии головного мозга оценивается распространенность метастатического поражения. Далее проводится морфологическое исследование материала, взятого при пункции или биопсии опухоли. Морфологическое исследование является наиболее значимым и должно выполняться как можно раньше. Полученные данные позволяют подтвердить злокачественность процесса, определить гистогенез опухоли, степень дифференцировки клеток, а иногда и предположительную локализацию первичной опухоли, что значительно облегчает поиск первичного очага и сокращает количество диагностических манипуляций.
Существенную помощь в определении характеристик опухоли может оказать выполнение иммуногистохимического исследования, которое позволит в каждом конкретном случае выработать индивидуальную лечебную тактику.
На заключительном этапе исследований осуществляется поиск первичной опухоли (если ее не смогли обнаружить ранее) в соответствии с гистологической структурой метастазов и распространенностью поражения. Эти два фактора существенно влияют на индивидуальную программу обследования конкретного пациента.
Стандартные методы лечения рака из НПО — это лучевая терапия, возможно в комплексе с химиотерапией, лимфаденэктомия (хирургическая операция, заключающаяся в иссечении лимфатических узлов, пораженных злокачественным процессом).
В медицинском центре ООО «Эдис Мед Ко» научились бороться с разными гистологическими формами злокачественных заболеваний, в том числе и рак из НПО, применяя авторский метод лечения фотодинамической терапией (ФДТ) в сочетании с омелотерапией. Применяемый на протяжении многих лет, этот метод доказал свою эффективность в борьбе с заболеваниями, которые считались неизлечимыми.
Курсы лечения ФДТ в медицинском центре помогут пациенту выйти на ремиссию болезни, восстановить иммунитет и защитные силы своего организма, чтобы патологический процесс не смог появиться вновь.
Смотрите также другие научные статьи:
Что такое диссеминация опухоли
В структуре онкологической заболеваемости женского населения России РМЖ устойчиво занимает первое ранговое место, составляя при этом 20,4 % [5]. Средняя продолжительность жизни больных диссеминированным РМЖ не превышает 24 месяцев. По данным B. Fisher, около 35 % больных РМЖ во время выявления первичной опухоли имеют клинически определяемые метастазы, кроме того, еще 30–35 % больных имеют микрометастазы, которые в дальнейшем клинически манифестируют [7]. В итоге результаты лечения больных РМЖ остаются неудовлетворительными (прирост грубого показателя смертности за последние 10 лет составил 7,56 %) [5].
Диагностика гематогенного распространения эпителиальных опухолей на ранних стадиях – одна из главных проблем онкологии. Морфологически единичные разрозненные опухолевые клетки не определяются – требуется применение высокочувствительных иммунологических методов. К ним в настоящее время относятся иммуноцитологические (иммуноцитохимический, проточная цитометрия) методы и молекулярно-биологические (RT-PCR) методы. Иммунологические методы исследования костного мозга значительно различаются по своей чувствительности и специфичности, технической сложности и стоимости. Для того чтобы контролировать эффективность воздействия лекарственных средств на микрометастазы нужно, в первую очередь, стандартизировать методы количественной оценки единичных диссеминированных опухолевых клеток. Речь идет об иммунологическом стадировании рака [4]. В клинической практике пока не найдено рутинных методов обнаружения микрометастазов. Методы исследования костного мозга нуждаются в дальнейшем развитии. Однако уже накапливаются данные о том, что количественное определение и характеристика диссеминированных опухолевых клеток позволяют получить важную прогностическую информацию и проводить мониторинг эффективности терапии. По мере того как методы исследования станут стандартизированными, с приемлемой чувствительностью и специфичностью, это позволит сделать еще один шаг к индивидуализации антиметастатической терапии [1].
В связи с тем, что диссеминированные опухолевые клетки присутствуют в костном мозге в малых количествах, для увеличения чувствительности иммунологических методов исследования были разработаны методы обогащения популяции клеток-мишеней. Техника обогащения включает большую панель технологий, в основе которых лежат различные свойства диссеминированных опухолевых клеток, отличающие их от нормальных гематопоэтических клеток. Стандартной процедурой считается метод градиентной сепарации Ficoll. Кроме того, большинство современных технологий основано на экспрессии молекулы адгезии эпителиальных клеток (EpCAM). Применение, в частности, метода иммуномагнитного обогащения клеток и проточной цитометрии позволяет оценивать до 50 млн миелокариоцитов у одного больного. Для сравнения ‒ иммуноцитологически на цитоцентрифужных препаратах можно оценить обычно 1–2 млн миелокариоцитов [1].
Ранее нами было проведено исследование, в котором изучался костный мозг у 50 больных РМЖ с помощью цитологического, гистологического и иммуноцитохимического методов. От общего числа больных, включенных в исследование, микрометастазы в костный мозг были обнаружены у 19 (38 %) пациенток. Комбинация различных методов диагностики существенно не повысила вероятность выявления опухолевых клеток в костном мозге. Наиболее информативными в плане определения оккультных метастазов в костный мозг были иммуноцитохимический (63,2 %) и гистологический (57,9 %) методы. Таким образом, чтобы максимально повысить вероятность диагностики метастазов в костный мозг, целесообразно одновременно пользоваться обоими методами. Что становится весьма актуальным для правильного стадирования опухолевого процесса и составления дальнейшего плана лечения [3].
Целью настоящей работы явилось установление степени гематогенной диссеминации РМЖ на основании обнаружения диссеминированных опухолевых клеток высокочувствительным иммуноцитологическим методом с применением моноклональных антител к эпителиальным антигенам.
Материалы и методы исследования
В работе использованы материалы клинического, морфологического, иммуноцитологического обследования 28 больных РМЖ, находящихся на лечении в ГУЗ «Областной клинический онкологический диспансер» с ноября 2011 г. по настоящее время. На проведение данного исследования было получено разрешение этической комиссии ФГБОУ ВПО «Ульяновский государственный университет». Исследования проводились с соблюдением законодательства РФ, этических норм и принципов Декларации Хельсинки (1964) со всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериалах, полученных от людей, а также международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Все первичные данные пациенток были обезличены в соответствии с требования п. 3 ст. 6 действующего Федерального закона РФ 152-ФЗ «О персональных данных».
В исследуемую группы вошли женщины в возрасте от 33 до 74 лет. Средний возраст составил 56 ± 11,0 лет. На момент постановки первичного диагноза пациентки распределились по стадиям следующим образом: I стадия была диагностирована у 1 (3,6 %) больной, IIА – у 7 (25 %), IIВ – у 3 (10,7 %), IIIА – у 6 (21,4 %), IIIВ – у 3 (10,7 %), IIIC – у 4 (14,3 %), IV – у 4 (14,3 %). Наиболее частым гистологическим вариантом был инфильтративный смешанный рак (42,9 %). Отмечена достаточно высокая частота инфильтративного протокового рака (28,6 %). Реже встречались инфильтративный дольковый рак (21,4 %) и другие формы рака (медуллярный, папиллярный, тубулярный) – 7,1 %. Больным было проведено стандартное клиническое обследование. Исследование костного мозга до начала лечения выполнялось как стандартными цитологическим и гистологическим методами, так и методом проточной цитометрии с применением МКА к цитокератинам EpCAM (CD326). Материал для цитологического исследования и проточной цитометрии получали с помощью стернальной пункции. Объем костномозгового пунктата не превышал 0,5 мл, т.к. при большем объеме возможно разбавление образца периферической кровью. Проточная цитометрия проводилась на базе лаборатории иммунологии гемопоэза ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН (руководитель – д.м.н., проф. Н.Н. Тупицын). Исследование проводилось в координатах CD45/CD326. Предварительно было проведено иммуномагнитное обогащение клеток, связывающих антитела CD326 (EpCAM). Это позволило оценивать до 50 млн миелокариоцитов у одного больного. Подсчет клеток миелограммы и их анализ производился в клинической лаборатории. Для гистологического исследования выполнялась трепанбиопсия задне-верхней ости подвздошной кости с двух сторон.
Результаты исследования и их обсуждение
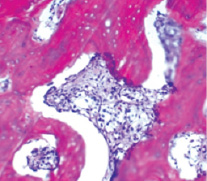
При стандартном цитологическом исследовании метастазы в костный мозг не были выявлены ни у одной из 28 пациенток. У 5 из 28 больных в микропрепаратах были обнаружены «единичные недифференцированные клетки неясного происхождения, возможно, негемопоэтической природы». При проточной цитометрии у 2 из этих 5 пациенток выявлены микрометастазы в костном мозге. При гистологическом исследовании трепанобиоптатов лишь у 1 (3,6 %) пациентки были обнаружены метастазы в костный мозг (рис. 1). Исходная стадия у этой пациентки была расценена как T4N3aM0 (IIIC), после гистологического обнаружения метастазов в костный мозг стадия была изменена на IV. При дополнительной остеосцинтиграфии у этой пациентки были выявлены множественные остеопластические метастазы в кости, не подтвержденные рентгенологически. Метастазы в костный мозг в данном случае были подтверждены методом проточной цитометрии.
Рис. 1. Микрофото метастаза инфильтрирующего рака молочной железы в костном мозге больной Д., 58 лет. Окр. гематоксилином и эозином, ×200
У 3 из 28 больных в трепанобиоптатах были обнаружены единичные клетки, подозрительные на раковые, что не было подтверждено иммуноцитологически. Еще у 7 больных в трепанобиоптатах были обнаружены единичные плазматические клетки или микроочаговое их скопление, что является косвенным признаком поражения костного мозга. При проточной цитометрии у 2 из этих 7 пациенток были обнаружены микрометастазы.
Эпителиальные (опухолевые) клетки в образцах костного мозга были выявлены у 24 (89,3 %) из 28 пациенток с помощью проточной цитометрии с применением моноклональных антител ЕрСАМ (CD326). Важно то, что количество опухолевых клеток, определяемых иммуноцитологически, было очень низким и варьировалось от 1 до 118 клеток в образце, что в 82,2 % случаев составило менее 1 клетки на 1 млн миелокариоцитов. Лишь у 5 (17,8 %) из 28 больных было выявлено ≥ 1 (максимум – 10) эпителиальных клеток на 1 млн миелокариоцитов. У двух пациенток была установлена IV стадия РМЖ (T4N3сM1). У одной имелись метастазы в позвоночнике, грудине, легких, плевре. У другой было выявлено поражение селезенки, внутрибрюшных, забрюшинных лимфатических узлов, яичников. Костный мозг обеих пациенток, как показали миелограммы и трепанобиоптаты, был гипоклеточным (особенно это касалось красного ростка). У двух других пациенток изначально была диагностирована IIA стадия РМЖ. Еще у одной больной изначально была диагностирована IIIB стадия, причем у нее были выявлены метастазы в трепанобиоптате, что потребовало проведения рестадирования – была выставлена IV стадия заболевания (об этом было сказано ранее).
Если считать положительной реакцию при наличии 1 метастатической клетки среди 1 миллиона мононуклеарных клеток (МНК) костного мозга (сумма количества лимфоцитов, моноцитов и плазматических клеток), то число таких пациенток составило 21 (75 %) из 28. При этом только у 3 (10,7 %) из 28 больных число клеток было ≥ 10. У двух больных было выявлено наибольшее число клеток на 1 млн МНК – 32 и 35 соответственно.
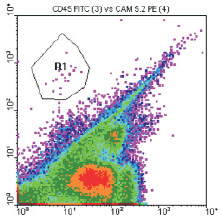
Четкий кластер опухолевых клеток при проведении проточной цитометрии был диагностирован у 4 (14,3 %) из 28 пациенток (рис. 2).
При этом число клеток в образцах костного мозга было очень низким: у одной пациентки (IIA стадия) число опухолевых клеток на 1 млн миелокариоцитов равнялось одной, у трех остальных (IIB, IIIA и IIIB стадии) – менее одной клетки. При пересчете на 1 млн МНК это число составило 6, 2, 6 и 4 клетки соответственно.
Полагая, что обнаружение одной изолированной опухолевой клетки может быть диагностически незначимым, ряд исследователей попытался количественно определить «критическую» опухолевую нагрузку, превышение которой достоверно было бы связано с ростом частоты рецидива заболевания. Было показано, что количество рецидивов рака молочной железы резко возрастает при обнаружении в костном мозге 10 или 15 изолированных опухолевых клеток [6]. В нашем исследовании не была прослежена общая и безрецидивная выживаемость в связи с небольшим сроком от начала исследования. Однако одна больная с IV стадией РМЖ, у которой были подтверждены микрометастазы в костный мозг, погибла от прогрессирования заболевания во время проведения ей второго курса химиотерапии.
Рис. 2. Цитограмма больной раком молочной железы Б., 74 лет, IIB стадия, с микрометастазом в костном мозге, выявленным методом проточной цитометрии. Область R1 – это «кластер» из 20 CD45-негативных клеток (ось абсцисс), положительных в реакции с антителами к молекуле адгезии эпителиальных клеток EpCAM (CD326) – ось ординат
В работе Крохиной О.В. и соавт. (ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН) было сделано предположение, что к наиболее ранним проявлениям реакции костного мозга на присутствие отдельных опухолевых клеток можно отнести следующие изменения кроветворения по данным миелограмм: гипоклеточность костного мозга, скопления плазматических клеток, обнаружение крупных клеток с гиперхромным ядром и множественными нуклеолами, повышение лейко-эритробластического отношения, повышенные средние значения количества моноцитов и лимфоцитов [2].
В нашем исследовании в целом у пациенток были обнаружены следующие изменения в миелограммах: снижение клеточности костного мозга (28,6 %), повышение, а также снижение лейко-эритробластического соотношения (25,0 % и 14,3 %, соответственно), повышенные значения количества моноцитов (42,9 %), лимфоцитов (46,4 %) и плазмацитов (10,7 %). У 5 (17,9 %) пациенток из 28 были обнаружены «единичные недифференцированные клетки неясного происхождения, возможно, негемопоэтической природы». У 2 из них были выявлены микрометастазы. Поскольку все эти изменения кроветворения с различной частотой имелись как у пациенток с микрометастазами, так и без них, мы пока не можем утверждать об ассоциации этих признаков с присутствием отдельных опухолевых клеток в костном мозге.
Возможность выявления единичных опухолевых клеток в костном мозге вследствие большей чувствительности является главным преимуществом метода проточной цитометрии в диагностике диссеминированных опухолевых клеток рака молочной железы в костный мозг по сравнению с морфологическими методами исследования: в 5 (17,8 %) и 1 (3,6 %) случаях из 28 соответственно. Следовательно, метод проточной цитометрии позволяет более точно судить о степени гематогенной диссеминации РМЖ в костный мозг, чем стандартные морфологические методы. В то же время обнаружение малого количества опухолевых клеток при проведении проточной цитометрии сложно трактовать в тех случаях, где они не формируют четкого кластера. При наличии такого кластера микрометастазы могут быть констатированы даже при наличии менее 1 опухолевой клетки на 1 миллион миелокариоцитов. Пока остается неясным диагностически значимое пороговое значение количества единичных опухолевых клеток в костном мозге у больных РМЖ. Нет четких данных о том, какова «критическая» опухолевая нагрузка костного мозга, превышение которой было бы связано с ростом частоты рецидива заболевания. На основании анализа миелограмм пока не удалось выявить косвенные признаки присутствия опухолевых клеток рака молочной железы. Работа в данном направлении будет продолжена.
Представленные нами данные демонстрируют необходимость внедрения в клиническую практику иммунологического исследования костного мозга, особенно на ранних стадиях рака молочной железы, для оценки распространенности опухолевого процесса. Методы исследования костного мозга нуждаются в дальнейшем развитии, а оценка значимости обнаружения диссеминированных опухолевых клеток и микрометастазов в костном мозге возможна после анализа результатов общей и безрецидивной выживаемости у данных больных.
Авторы заявляют об отсутствии каких бы то ни было конфликтов интересов с кем бы то ни было в отношении идеи, планирования, выполнения и опубликования результатов настоящего исследования и их последующего использования в коммерческих или иных целях.
Работа поддержана гос. заданием Минобрнауки РФ. Шифр гос. задания 4. 1219. 201.
Рецензенты:
Чарышкин А.Л., д.м.н., профессор, заведующий кафедрой факультетской хирургии, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Хайруллин Р.М., д.м.н., профессор, заведующий кафедрой анатомии человека, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.