что такое дикарбоновые кислоты
Дикарбоновые кислоты
Двухосновные карбоновые кислоты (дикарбоновые кислоты) – это карбоновые кислоты, содержащие две карбоксильные группы –COOH. Общей формулой HOOC-R–COOH, где R любой двухвалентный органический радикал.
Содержание
Химические свойства
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые обусловленные наличием карбоксильной группы:
более сильные кислоты по первой стадии, чем соответствующие монокарбоновые. Во-первых из-за статистического фактора (две группы в молекуле), во-вторых из-за индуктивного эффекта, если обе группы находятся недалеко или связаны цепью кратных связей.
В то же время есть существенные различия, обусловленные наличием второй карбоксильной группой :
Примеры
| Тривиальное название | Систематическое название | Химическая структура | pKa1 | pKa2 |
|---|---|---|---|---|
| Щавелевая кислота | Этандиовая кислота | HOOC–COOH | 1,27 | 4,23 |
| Малоновая кислота | Пропандиовая кислота | НООС–СН2–СООН | 2,87 | 5,70 |
| Янтарная кислота | Бутандиовая кислота | НООС–(СН2)2–СООН | 4,16 | 5,61 |
| Глутаровая кислота | Пентандиовая кислота | НООС–(СН2)3–СООН | 4,34 | 5,27 |
| Адипиновая кислота | Гександиовая кислота | НООС–(СН2)4–СООН | 4,26 | 5,30 |
| Пимелиновая кислота | Гептандиовая кислота | НООС–(СН2)5–СООН | ||
| Субериновой кислота | Октандиовая кислота | НООС–(СН2)6–СООН | ||
| Азелаиновая кислота | Нонандиовая кислота | НООС–(СН2)7–СООН | 4,55 | 5,42 |
| Себациновая кислота | Декандиовая кислота | НООС–(СН2)8–СООН | 4,62 | 5,59 |
| Фталевая кислота | Бензол-1,2-дикарбонавя кислота | 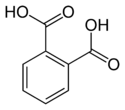 | 3,54 | 4,46 |
| Изофталевая кислота | Бензол-1,3-дикарбонавя кислота | 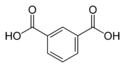 | ||
| Терефталевая кислота | Бензол-1,4-дикарбонавя кислота | 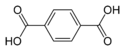 |
Другие важные представители
Применение
Используются для получения получения полиамидов и полиэфиров. Например, таких широкоизвестных полимеров как капрон и полиэтилентерефталат.
См. также
Полезное
Смотреть что такое «Дикарбоновые кислоты» в других словарях:
ДИКАРБОНОВЫЕ КИСЛОТЫ — орг. соед., содержащие две карбоксильные группы СООН. Называют их аналогично карбоновым кислотам; многие Д. к. имеют тривиальные назв., которые, как правило, и используются (см. табл.). Д. к. кристаллич. в ва. Т ры плавления алифатич. Д. к. с… … Химическая энциклопедия
Насыщенные дикарбоновые кислоты — Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH,… … Википедия
Предельные дикарбоновые кислоты — Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH,… … Википедия
Двухосновные карбоновые кислоты — (или дикарбоновые кислоты) это карбоновые кислоты, содержащие две карбоксильные группы COOH, с общей формулой HOOC R COOH, где R любой двухвалентный органический радикал. Содержание 1 Химические свойства 2 Примеры … Википедия
Карбоновые кислоты — класс органических соединений, содержащих карбоксильную группу (карбоксил) Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная… … Большая советская энциклопедия
КАРБОНОВЫЕ КИСЛОТЫ — органические соединения, содержащие одну или неск. карбоксильных групп. В организмах обнаружены К. к. алифатического (жирные кислоты), ароматического (бензойная, коричная, салициловая), алициклического (камфорная, хаульмугровая, хинная,… … Биологический энциклопедический словарь
МАЛЕИНОВАЯ И ФУМАРОВАЯ КИСЛОТЫ — цис и транс этилен 1,2 дикарбоновые к ты, ф лы I и II соотв., мол. м. 116,07; бесцв. кристаллы. Физ. св ва представлены в табл. На свету, при нагр. выше 200 °С или при действии хим. агентов малеиновая к та изомеризуется в фумаровую к ту; DH… … Химическая энциклопедия
СОДЕРЖАНИЕ
Линейные насыщенные дикарбоновые кислоты
| п | Распространенное имя | Систематическое название ИЮПАК | Структура | pK a 1 | pK a 2 | PubChem |
|---|---|---|---|---|---|---|
| 0 | Щавелевая кислота | этандиовая кислота |  | 1,27 | 4,27 | 971 |
| 1 | Малоновая кислота | пропандиовая кислота |  | 2,85 | 5,05 | 867 |
| 2 | Янтарная кислота | бутандиовая кислота | 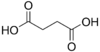 | 4,21 | 5,41 | 1110 |
| 3 | Глутаровая кислота | пентандиовая кислота |  | 4,34 | 5,41 | 743 |
| 4 | Адипиновая кислота | гександиовая кислота |  | 4,41 | 5,41 | 196 |
| 5 | Пимелиновая кислота | гептандиовая кислота |  | 4,50 | 5,43 | 385 |
| 6 | Субериновая кислота | октандиовая кислота | 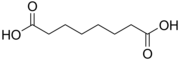 | 4,526 | 5,498 | 10457 |
| 7 | Азелаиновая кислота | нонандиовая кислота |  | 4,550 | 5,498 | 2266 |
| 8 | Себациновая кислота | декандиовая кислота |  | 4,720 | 5,450 | 5192 |
| 9 | ундекандиовая кислота |  | 15816 | |||
| 10 | додекандиовая кислота |  | 12736 | |||
| 11 | Брассиловая кислота | тридекандиовая кислота | 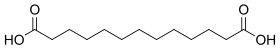 | 10458 | ||
| 14 | Тапсиновая кислота | гексадекандиовая кислота |  | 10459 | ||
| 19 | Японская кислота | генейкозадионовая кислота | 9543668 | |||
| 20 | Феллогеновая кислота | докозандиовая кислота | 244872 | |||
| 28 год | Эквизетоловая кислота | триаконтандиовая кислота | 5322010 |
Вхождение
Японский воск представляет собой смесь триглицеридов дикарбоновых кислот C21, C22 и C23, полученных из дерева сумах ( Rhus sp.).
Некоторые исходные двухосновные кислоты от C29 до C32, но с метильными группами на атомах углерода C-13 и C-16, были выделены и охарактеризованы из липидов термофильных анаэробных эубактерий Themanaerobacter ethanolicus. Наиболее распространенной двухосновной кислотой была C30α, ω-13,16-диметилоктакозандиовая кислота.
Бифитановые двухосновные кислоты присутствуют в геологических отложениях и считаются индикаторами анаэробного окисления метана в прошлом. В кайнозойских просачиваемых известняках обнаружено несколько форм без или с одним или двумя пентациклическими кольцами. Эти липиды могут быть неизвестными метаболитами архей.
Кроцетин является основным соединением кроцинов (гликозидов кроцетина), которые являются основными красными пигментами рыльц шафрана ( Crocus sativus ) и плодов гардении ( Gardenia jasminoides ). Кроцетин представляет собой дикарбоновую кислоту с 20 углеродными цепями, которая является дитерпененоидом и может рассматриваться как каротиноид. Это был первый растительный каротиноид, который был признан еще в 1818 году, а история выращивания шафрана насчитывает более 3000 лет. Основным активным ингредиентом шафрана является желтый пигмент кроцин 2 (известны три других производных с различным гликозилированием), содержащий гентиобиозную (дисахаридную) группу на каждом конце молекулы. Был разработан простой и специфический метод ВЭЖХ-УФ для количественного определения пяти основных биологически активных ингредиентов шафрана, а именно четырех кроцинов и кроцетина.
Ненасыщенные дикарбоновые кислоты
транс, транс- муконовая кислота является метаболитом бензола в организме человека. Поэтому определение его концентрации в моче используется в качестве биомаркера воздействия бензола на рабочем месте или в окружающей среде.
Алкилитаконаты
Ряд алкил- и алкенил-итаконатов, известных как церипоровая кислота ( Pub Chem 52921868 ), был обнаружен в культурах гриба, селективно разлагающего лигнин (гриб белой гнили ), Ceriporiopsis subvermispora. Абсолютная конфигурация церипоровых кислот, их стереоселективный путь биосинтеза и разнообразие их метаболитов были подробно обсуждены.
Замещенные дикарбоновые кислоты
Ароматические дикарбоновые кислоты
Характеристики
Дикарбоновые кислоты представляют собой твердые кристаллические вещества. Растворимость в воде и температура плавления α, ω- соединений прогрессируют последовательно по мере того, как углеродные цепи становятся длиннее с чередованием нечетного и четного числа атомов углерода, так что для четного числа атомов углерода температура плавления выше, чем для следующий в серии с нечетным номером. Эти соединения представляют собой слабые двухосновные кислоты с pK a, стремящимся к значениям ок. 4.5 и 5.5 по мере увеличения расстояния между двумя карбоксилатными группами. Таким образом, в водном растворе с pH около 7, типичным для биологических систем, уравнение Хендерсона – Хассельбаха указывает, что они существуют преимущественно в виде дикарбоксилат-анионов.
Дикарбоновые кислоты, особенно маленькие и линейные, можно использовать в качестве сшивающих реагентов. Дикарбоновые кислоты, в которых карбоксильные группы не разделены ни одним атомом углерода, или одним атомом углерода, разлагаются при нагревании с выделением диоксида углерода и оставляют монокарбоновую кислоту.
Производные
Дикарбоновые кислоты. Дикарбоновые кислоты
Дикарбоновые кислоты – это вещества с двумя функциональными одновалентными карбоксильными группами – СООН, функция которых заключается в определении основных свойств этих веществ. Их общая формула – HOOC-R-COOH. И здесь под «R» подразумевается любой органический
2-валентный радикал, представляющий собой атомы, соединенные с функциональной группой молекулы.
Наиболее известными являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода:
За счет наличия дополнительной полярной карбоксильной группы (COOH), способной образовывать водородные связи, дикарбоновые кислоты лучше растворяются в воде и имеют более высокие температуры плавления, чем соответствующие монокарбоновые кислоты.
Карбоксильная группа проявляет сильные электроноакцепторные свойства, и поэтому дикарбоновые кислоты являются более сильными кислотами, чем соответствующие монокарбоновые.
Названия дикарбоновых кислот по систематической номенклатуре образуют прибавлением окончания «диовая кислота» к названию алкана. Часто применяют тривиальные названия.
Свойства дикарбоновых кислот
Двухосновные карбоновые кислоты проявляют свойства, характерные для одноосновных кислотам – они образуют соли, сложные эфиры, хлорангидриды и амиды. Помимо этого, они способны вступать в специфические реакции, например, образование циклических ангидридов, двух различных рядов сложных эфиров (кислых и полных) и смешанных производных.
По физическим свойствам двухосновные кислоты подобны одноосновным. Это кристаллические вещества с высокими температурами плавления. Одной из особенностей дикарбоновых кислот является то, что кислоты с четным числом углеродных атомов плавятся при более высоких температурах, нежели с нечетным (стоит заметить, что с удлинением углеродной цепи разница в температурах постепенно уменьшается). Низшие гомологи хорошо растворяются в воде. Так же, как и монокарбоновые кислоты, двухосновные кислоты способны образовывать межмолекулярные водородные связи.
Особенности
К свойствам дикарбоновых кислот также относится образование хелатов. Это – комплексные соединения, состоящие из циклических группировок с комплексообразователем (центральным ионом). Хелаты используются для разделения, аналитического определения и концентрирования самых разных элементов. А в сельском хозяйстве и медицине их используют для ввода в пищу таких микроэлементов, как марганец, железо, медь и т. д. Еще некоторые дикарбоновые кислоты образуют циклические ангидриды – соединения R1CO-O-COR2, которые являются ацилирующими агентами, имеющими способность вступать в реакции с нуклеофилами, электроноизбыточными химическими реагентами. И последняя особенность дикарбоновых кислот – это образование ими полимеров (высокомолекулярных веществ). Оно происходит вследствие реакции с иными полифункциональными соединениями.
Химические свойства
1) Образование солей
Дикарбоновые кислоты являются двухосновными, поэтому 1 моль кислоты будет взаимодействовать с двумя моль NaOH. При этом вначале образуется кислая соль, затем средняя:
Характерной особенностью щавелевой кислоты является образование нерастворимого осадка оксалата кальция при добавлении к еѐ раствору растворимых солей кальция, что используется в аналитической химии для обнаружения кальция или щавелевой кислоты:
(COOH)2 + CaCl2 → (COO)2Ca + 2 HCl
Моча животных и человека часто содержит небольшие количества оксалата кальция. Его содержание увеличивается в патологических случаях (оксалурия).
Оксалат кальция также может образовывать камни в почках.
2) Поведение при нагревании
Щавелевая кислота при нагревании до 150oC претерпевает декарбоксилирование и превращается в муравьиную кислоту:
Аналогично и малоновая кислота легко декарбоксилируется с образованием уксусной кислоты:
Янтарная и глутаровая при нагревании отщепляют воду и дают ангидриды:
(здесь формула янтарной кислоты изображена в виде конформации ―клешня).
Высшие дикарбоновые кислоты отщепляют воду только при действии сильных дегидратирующих агентов – например, P2O5. При этом образуются полимерные ангидриды.
Легко образуются те циклические ангидриды, которые имеют 5 или 6 атомов в цикле, т. к. именно в этих случаях напряжения в цикле минимальны.
Щавелевая кислота легко окисляется перманганатом калия в кислой среде до угольной кислоты, что используется в перманганатометрии:
Янтарная кислота является одним из компонентов важнейшего биохимического пути – цикла трикарбоновых кислот (цикл Кребса), в котором она окисляется до ненасыщенной дикарбоновой кислоты – фумаровой:
(ФАД – флавинадениндинуклеотид – является коферментом сукцинатдегидрогеназы. Обратите внимание, что два атома водорода переходят от янтарной кислоты к ФАД)
4) Другие реакции
Среди очень важных реакций производных дикарбоновых кислот следует отметить синтезы с использованием малонового эфира (включая реакцию Кнѐвенагеля и реакцию Михаэля), конденсацию Дикмана (аналог сложноэфирной конденсации Кляйзена), ацилоиновую конденсацию и термическое разложение солей с образованием циклических кетонов.
Получение дикарбоновых кислот
Методы получения дикарбоновых кислот
Наиболее распространенным способом синтеза высших двухосновных кислот является окисление циклических кетонов. Также высшие дикарбоновые кислоты можно получать из тетрахлоралканов. Требуемые галогеналканы синтезируют по реакции теломеризации из этилена и четыреххлористого углерода. Кислоты с четным числом углеродных атомов в скелете могут быть получены электролизом солей кислых эфиров низших двухосновных кислот.
Щавелевая кислота и ее соли применяются как протрава в кожевенной и текстильной промышленности, в аналитической химии, органическом синтезе, для очистки металлов от ржавчины и накипи, компонент композиций для очистки Al, Cr и Ag, для осаждения редкоземельных элементов.
Малоновая кислота в больших количествах находится в свѐкле. Встречается во всех живых организмах, которые синтезируют высшие жирные кислоты, так как это один из субстратов для биосинтеза жирных кислот. В организме образуется путѐм карбоксилирования уксусной кислоты (точнее еѐ производного – ацетил-КоА):
Процесс сопровождается гидролизом АТФ и с участием биотина (витамин H), который является коферментом ацетил-КоА-карбоксилазы.
Промышленно важная адипиновую кислоту получают окислением циклогексана кислородом (катализатор – стеарат кобальта). Исходный циклогексан получают гидрированием бензола. Адипиновая кислота в основном идѐт на производство нейлона
Ненасыщенные дикарбоновые кислоты
Благодаря стереохимическим особенностям, особое значение имеют фумаровая и малеиновая кислоты, которые отвечают составу бутендиовой кислоты, то есть имеют одну двойную С=С связь и две карбоксильные группы.
Обе кислоты являются геометрическими изомерами друг друга и могут быть получены дегидратированием яблочной кислоты: фумаровая образуется при более низкой температуре, а малеиновая – при более высокой:
Так как малеиновая кислота при нагревании легко образует циклический ангидрид, а фумаровая кислота не даѐт ангидрида, то был сделан вывод, что малеиновая кислота является цис-изомером, а фумаровая – транс-изомером (Вант-Гофф, Ле-Бель, Вислицениус):
Действительно, у фумаровой кислоты карбоксильные группы расположены слишком далеко друг от друга, чтобы образовать циклический ангидрид:
Малеиновая кислота в природе практически не встречается. Еѐ синтезируют из ангидрида, который получают окиcлением бензола кислородом в присутствии V2O5.
Малеиновая кислота, бесцветные кристаллы, tпл 139 °С. Используется как антиоксидант для жиров и масел, в производстве янтарной, аспарагиновой и молочной кислот
Нахождение в природе и применение кислот:
Щавелевая кислота широко распространена в растительном мире. В виде солей содержится в листьях щавеля, ревеня, кислицы. В организме человека образует труднорастворимые соли (оксалаты), например оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре. Применяют как отбеливающее средство: удаление ржавчины, красок, лака, чернил; в органическом синтезе.
Янтарная кислота (соли и сложные эфиры называются сукцинатами) участвует в обменных процессах, протекающих в организме. Является промежуточным соединением в цикле трикарбоновых кислот. В 1556 году немецким алхимиком Агриколой впервые выделена из продуктов сухой перегонки янтаря. Кислота и ее ангидрид широко используются в органическом синтезе.
Насыщенные дикарбоновые кислоты
Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH, где n = 0, 1, 2, …
Номенклатура
Систематические названия двухосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -диовая и слова кислота.
Изомерия
Изомерия скелета в углеводородном радикале проявляется, начиная с бутандиовой кислоты, которая имеет два изомера:
Гомологический ряд
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Щавелевая кислота | Этандиовая кислота | HOOCCOOH | оксалаты |
| Малоновая кислота | Пропандиовая кислота | HOOCСH2COOH | малонаты |
| Янтарная кислота | Бутандиовая кислота | HOOC(СH2)2COOH | сукцинаты |
| Глутаровая кислота | Пентандиовая кислота | HOOC(СH2)3COOH | глутараты |
| Адипиновая кислота | Гександиовая кислота | HOOC(СH2)4COOH | адипинаты |
| Пимелиновая кислота | Гептандиовая кислота | HOOC(СH2)5COOH | пимелинаты |
| Пробковая кислота | Октандиовая кислота | HOOC(СH2)6COOH | субераты |
| Азелаиновая кислота | Нонандиовая кислота | HOOC(СH2)7COOH | азелаинаты |
| Себациновая кислота | Декандиовая кислота | HOOC(СH2)8COOH | себацинаты |
| — | Ундекандиовая кислота | HOOC(СH2)9COOH | |
| — | Додекандиовая кислота | HOOC(СH2)10COOH | |
| Брассиловая кислота | Тридекандиовая кислота | HOOC(СH2)11COOH | |
| — | Тетрадекандиовая кислота | HOOC(СH2)12COOH | |
| — | Пентадекандиовая кислота | HOOC(СH2)13COOH | |
| Тапсиевая кислота | Гексадекандиовая кислота | HOOC(СH2)14COOH | |
| — | Гептадекандиовая кислота | HOOC(СH2)15COOH | |
| — | Октадекандиовая кислота | HOOC(СH2)16COOH | |
| — | Нонадекандиовая кислота | HOOC(СH2)17COOH | |
| — | Эйкозандиовая кислота | HOOC(СH2)18COOH | |
| Японовая кислота | Генэйкозандиовая кислота | HOOC(СH2)19COOH |
Полезное
Смотреть что такое «Насыщенные дикарбоновые кислоты» в других словарях:
Предельные дикарбоновые кислоты — Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH,… … Википедия
Карбоновые кислоты — класс органических соединений, содержащих карбоксильную группу (карбоксил) Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная… … Большая советская энциклопедия
АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ — А. МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ 1. С1 : металлоорганические соединения. Эти соединения обычно получают двумя методами: а) действием активного металла (Na, Li, Mg, Zn) на органический галогенид, например: или б) действием галогенида менее… … Энциклопедия Кольера
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ — Встречаются в самых разнообразных природных соединениях, в частности, в нефти. Алициклические соединения определяют как карбоциклические (в цикле присутствуют только атомы углерода) соединения, которые в своих реакциях обнаруживают… … Энциклопедия Кольера














