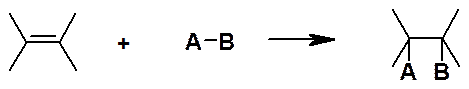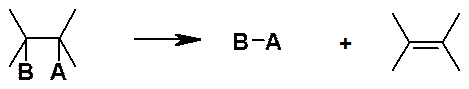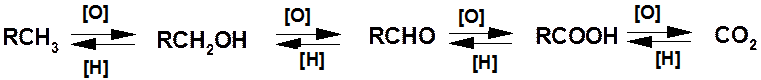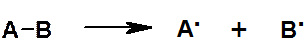что такое дельта с в химии
Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
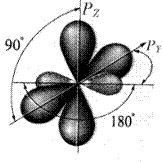
Рис. 7. sp-Гибридизованный атом углерода
Чем связь короче, тем она прочнее.
Следует помнить, что гибридизация – это математическая обработка параметров орбиталей в соответствии с принципами квантовой механики, позволяющая сохранить концепцию ковалентных связей с помощью пар электронов. Гибридизация не является экспериментально доказанной реальностью.
Полярность и поляризуемость связей
Как показано выше, ковалентная связь образуется за счет обобществления пары электронов. Ядра атомов, связанных ковалентной связью, удерживаются друг около друга за счет общей электронной пары. Чаще всего распределение электронной плотности не равномерно. У одного атома она выше, чем у другого. Один конец связи богаче электронами (более отрицательный), другой – беднее (более положительный). Такая связь называется полярной. Ковалентная связь полярна, когда она образована атомами по-разному притягивающими электроны, т.е. имеющими разную электроотрицательность. Связи, образованные атомами одного элемента, например С-С, – неполярны. Также неполярны и связи С-Н.
Рис. 8. Неполярные (а) и полярные (б) связи
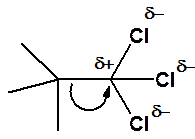
Знаки d+ и d- (дельта-плюс и дельта-минус)показывают, в каком направлении происходит сдвиг электронной плотности. Сам знак дельта означает частичный (не полный) заряд.
Рис. 9. Поляризованная углерод-углеродная связь
Понимание того, какие связи являются неполярными, какие полярными или поляризованными чрезвычайно важно для всего курса органической химии.
Лекция № 3
· Классификация органических реакций по характеру превращения, по способу разрыва связи в исходной молекуле. Электрофильные, нуклеофильные и радикальные реагенты и реакции.
· Понятие о промежуточных частицах (радикалы, карбокатионы, карбанионы) и их строение. Электронные эффекты заместителей (индуктивный, мезомерный), их влияние на устойчивость промежуточных частиц. Резонансные структуры.
· Факторы, определяющие возможность протекания реакций. Энергетическая кривая. Энтропийный и энтальпийный факторы, потенциал Гиббса, энергия активации, переходное состояние. Равновесные реакции, константа равновесия, кинетический и термодинамический контроль. Механизм реакции и пути его установления. Принцип микроскопической обратимости, постулат Хэммонда.
Классификация органических реакций:
по характеру превращения
Бескрайнее число органических реакций может быть сведено к нескольким типам.
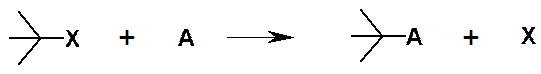
Обозначают S (от англ. substitution). Х – Уходящая группа.
Обозначают A (от англ. addition).
Реакции отщепления (элиминирования):
Обозначают E (от англ. elimination).
Реакции окисления и восстановления:
Перициклические (согласованные) реакции: циклоприсоединение, электроциклические реакции, сигматропные перегруппировки.
по типу разрыва связи в исходной молекуле
Гомолитический разрыв связи:
Частицы, несущие неспаренный электрон, называются свободными радикалами (R . ). Необходимо отличать термины:
· радикал – органический остаток (фрагмент);
· свободный радикал – частица с неспаренным электроном.
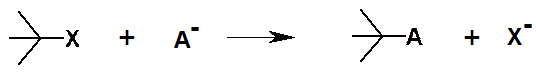
Гетеролитический разрыв связи:
Атом или группа атомов, имеющие избыток электронной плотности и способные выступать в роли донора электронной пары при образовании ковалентной связи, называются нуклеофилами (Nu). В роли нуклеофилов могут выступать как анионы, так и нейтральные молекулы. В переводе на русский язык нуклеофил – «любящий ядро», т.е. положительный заряд.
Частица или фрагмент молекулы, имеющие недостаток электронной плотности или свободную орбиталь и способные принимать пару электронов с образованием ковалентной связи, называются электрофилами (E). Ими могут быть как катионы, так и нейтральные молекулы. Электрофил – «любящий электроны», т.е. отрицательный заряд.
Реакции замещения могут происходить под действием свободных радикалов, электрофилов и нуклеофилов. Пример реакции нуклеофильного замещения:
Аналогично реакции присоединения, элиминирования и перегруппировки могут протекать под действием нуклеофилов, электрофилов и свободных радикалов.
Энергетические аспекты химических реакций
Основным критерием возможности протекания химической реакции является термодинамический аспект процесса. Термодинамика процесса описывается следующим уравнением:
Любая система (молекула или группа молекул) стремится находиться в наиболее устойчивом состоянии, т.е. стремится к минимуму внутренней энергии. В этом случае молекула наиболее термодинамически и химически стабильна. Поэтому реакция протекает в том случае, когда она сопровождается уменьшением свободной энергии. Величина DG является критерием возможности протекания химической реакции. Если DG меньше 0 – реакция возможна (но не означает, что она идет), если DG больше 0 – протекание реакции невозможно.
Чтобы распечатать файл, скачайте его (в формате Word).
Считаем связь атомов (дельта электроотрицательности)
Дельта электроотрицательности:
Связь двух атомов иногда требуется посчитать, для этого используют таблицу, где электроотрицательность, в отличие от предыдущей иллюстрации, увеличивается вправо.
Мы видим, что связь в молекуле ковалентная полярная.
Если бы ΔЭО была = 0, то мы бы сказали, что связь ковалентная неполярная. Так как молекулы одинаково заряжены. Такое случается, когда связь образуется между одинаковыми молекулами: O2, Cl2, H2 и т.д.
Если же электроотрицательность ΔЭО превышает 2, то связь называют ионной, так как, похоже, что один из атомов отнял себе слишком много электронов и стал резко отрицательным парнем.
Вещества с ионной связью часто бывают кристаллами, где один отрицательный ион окружен несколькими положительными и каждый положительный несколькими отрицательными.
Ближайшие соседи иона называются координационным числом (они как бы окружают координату атома). И все вместе они становятся гигантской молекулой без начала и конца, которая очень крепка и только плавится при больших температурах.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
При правильном ответе Вы получите 2 балла
Какая связь в молекуле NaCl?
Выберите всего один правильный ответ.
Добавление комментариев доступно только зарегистрированным пользователям
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
28.01.17 / 22:14, Иван Иванович Ответить +5
В Японии пытаются объяснить неожиданное исчезновение дельта-штамма. Возможно он самоуничтожился
Япония вновь удивила ученых. Пятая и самая сильная волна пандемии в Стране восходящего солнца в самый разгар роста числа новых заражений внезапно остановилась. Сейчас ученые пытаются понять, чем Япония отличается от остальных развитых стран, где стремительно растет число заражений коронавирусом.
Генетики не исключают, что на Японских островах имело место самоуничтожение штамма «Дельта», самой опасной и агрессивной разновидности Covid-19. Еще каких-то три месяца назад каждый день заражались в среднем рекордные 26 тыс. японцев, сейчас же число новых заражений опустилось ниже 200. При этом 7 ноября впервые почти за 15 месяцев в стране не было зафиксировано ни одного летального случая, связанного с коронавирусом.
Ученые приводят целый ряд возможных причин такой приятной аномалии. В том числе и один из наиболее высоких уровней вакцинации среди развитых стран – в Японии по состоянию на среду, 17 ноября, полностью привито 75,7% населения. Называют в качестве причин исчезновения Дельты также неукоснительное соблюдение японцами мер социального дистанцирования и ношение защитных масок.
Однако главная причина, пишет Japan Times, может быть связана с генетическими изменениями, которые происходят с самим вирусом при воспроизводстве со скоростью, приблизительно, две мутации в месяц. Профессор Национального института генетики Итуро Инуэ предложил революционную теорию, согласно которой штамм «Дельта» в Японии претерпел слишком много мутаций в белке nsp14, который отвечает за исправление ошибок. В результате борьба вируса за исправление ошибок привела к его самоуничтожению.
Исследования показывают, что в Азии значительно больше, чем в Европе и Африке, людей с защитным ферментом APOBEC3A, который нападает на РНК-вирусы, включая SARS-CoV-2, тот самый вирус, который вызывает Covid-19. Сейчас ученые из Национального института генетики пытаются понять, как APOBEC3A действует на белок nsp14 и может ли он подавлять активность коронавируса.
Японские ученые проанализировали генетические данные штаммов «Альфа» и «Бетта» из заражений, произошедших в Японии в июне-октябре. Затем они представили отношения в последовательностях ДНК вируса SARS-CoV-2. Оказалось, что в целом, чем больше гаплотиповая сеть, тем больше в ней положительных случаев.
Сеть штамма «Альфа», который доминировал в четвертой волне пандемии, охватившей Японию в марте-июне, имел пять основных групп со множеством мутаций, что подтверждало высокий уровень генетического разнообразия. Ученые предположили, что штамм «Дельта», который, как утверждают американские врачи, более чем вдвое заразен по сравнению с предыдущими вариантами коронавируса и который вызывает тяжелое протекание болезни в непривитых людях, имеет и значительно более высокое генетическое разнообразие.
Однако выяснилось, что в гаплотической сети имелись лишь две главные группы и что мутация внезапно остановилась в самый разгар эволюционного процесса развития. Когда японские ученые начали изучать белок nsp14, отвечающий за исправление ошибок, они с изумлением обнаружили, что подавляющее большинство образцов nsp14 на островах претерпели генетические изменения на мутационных участках A394V.
По мнению профессора Инуэ, мутаций оказалось так много, что штамм «Дельта» в Японии мог превратиться в дефектный вирус, потерял способность размножаться и в какой-то момент запустил механизм самоуничтожения.
Теперь необходимо выяснить, почему в Японии произошел процесс самоуничтожения, а Южная Корея, скажем, или западные страны сейчас ставят один антирекорд по числу заражений за другим?
Такеши Урано, профессор университета Симанэ, соглашается с тем, что у поврежденного белка nsp14 резко снижается способность к воспроизводству и что этот феномен может играть важную роль во внезапной остановке очередной волны пандемии в Стране восходящего солнца. Химическое вещество, способное контролировать этот белок, может потенциально стать мощным средством в борьбе с распространением коронавируса. Ученые уже ищут это химическое вещество.
В Японии уже к концу августа практически полностью исчезли штаммы «Альфа» и другие разновидности коронавируса. Однако в других странах, включая Индию и Индонезию, штамм «Альфа» остался наряду со штаммом «Дельта».
Профессор Инуэ не видит в соотечественниках никакой исключительности. Он считает, что такие же случаи самоуничтожения возможны и в других странах и регионах, когда nsp14 там достигнет такого же количества мутаций, как в Японии. Схожие мутации на участке А394V обнаружены как минимум в 24 странах.
Теория Итуро Инуэ может объяснить и внезапное исчезновение атипичной пневмонии (тяжелого острого респираторного синдрома SARS) в 2003 году. Эксперименты показывают, что и в случае с SARS тоже имело место внезапная потеря белком nsp14 способности к воспроизводству.
Ответить положительно на вопрос, может ли Covid-19 исчезнуть так же внезапно, как SARS, по мнению профессора Инуэ, теоретически можно, но пока делать это слишком рано. Пика пятая волна пандемии в Японии достигла в середине августа, после чего количество новых заражений начало неуклонно снижаться. К середине сентября заражений было уже меньше 5 тыс. в день, а в конце октября оно упало ниже 200. Однако, уверен Итуро Инуэ, это не значит, что в Японии не может быть новой волны пандемии. Дело в том, что раньше Дельта захватил острова и не пускал на них другие штаммы. Сейчас же, когда этой защиты нет, Япония вновь открыта перед другими разновидностями коронавируса. По крайней мере, одна вакцина защитить страну не в силах. Поэтому сейчас особую важность в Японии приобретает иммунный контроль на границах, который может помочь защитить ее от завезенных из-за границы коронавирусов.
Новости Барнаула
Опросы
Спецпроекты
Прямой эфир
Чем опасен новый штамм коронавируса дельта и какие у него симптомы?
Третья волна COVID-19 в Москве произошла из-за штамма дельта (B.1.617.2). Почти у 90% заболевших в столице, по словам её мэра Сергея Собянина, выявлен именно этот мутировавший индийский вариант коронавируса. Распространяется он и в регионах. Известно, что дельта опаснее уханьского варианта и быстрее поражает организм. В чём отличие этого штамма, как его распознать (и нужно ли?), почему люди, которые привились одними из первых, сейчас находятся в зоне риска, об этом в рубрике «Вопрос-ответ».
О штамме дельта известно, что впервые его выявили и описали в Индии. Эта мутация COVID-19 (она же «индийская», или B.1.617.2) на данный момент считается самой реактивной из четырёх наиболее значимых (альфа – «британская», B.1.1.7, бета – «южноафриканская», B.1.351, гамма – «бразильская», P.1).
Дельта не только активнее передаётся от человека к человеку, но также быстрее развивается в тяжёлую форму заболевания, тем самым «сокращая время возможного появления собственных антител, приводит слова директора НИЦ эпидемиологии и микробиологии имени Гамалеи Александра Гинцбурга «Коммерсант».
«Индийский» штамм быстрее заражает клетки и легче обходит иммунную защиту, утверждают учёные. За эти качества его окрестили «двойным мутантом». Сейчас среди заболевших очень много граждан в возрасте до 40 лет.
Этот штамм больше напоминает простуду. Его главные симптомы: боль в горле, насморк, повышение температуры тела. Кроме того, у пациентов фиксируются боли в животе, тошнота (и даже рвота), диарея, головная и мышечная боль, потеря слуха, рассказала РИА Новости замдиректора по клинико-аналитической работе ЦНИИ эпидемиологии Роспотребнадзора Наталья Пшеничная. Медик добавила, что у пациентов довольно часто встречаются микротромбозы нижних конечностей, что может привести к развитию гангрены. И лишь в редких случаях фиксируются кашель, потеря обоняния и лихорадка.
При всей своей активности учёные пока не подтверждают данные о более высокой смертности и более тяжёлом течении болезни при этом варианте коронавируса. Вместе с тем, по данным ВОЗ, дельта становится доминантным вариантом во всём мире.
Предварительные результаты исследования эффективности вакцин против новых штаммов огласил Институт имени Гамалеи. Руководитель лаборатории механизмов популяционной изменчивости патогенных микроорганизмов Владимир Гущин сообщил «Коммерсанту», что в случае с «индийским», а также с «британским» и «южноафриканским» штаммами фиксируется снижение вирусонейтрализующей активности, но оно не критическое и она не исчезает полностью. То есть привитые люди могут переболеть коронавирусом, но это пройдёт в лёгкой форме.
«Иногда такие пациенты попадают в больницы, но наш мониторинг показывает, что даже среди людей, которым потребовалось стационарное лечение, шанс, что разовьётся среднетяжёлое или тяжёлое течение, в 14 раз меньше, чем среди невакцинированных. При этом среди сделавших прививку заболевают в 10-20 раз меньше людей», – сказал учёный.
Максимальная эффективность достигается после второй инъекции. При этом в зоне риска сейчас находятся наиболее сознательные граждане, которые привились одними из первых. Дело в том, что у части из них уровень антител уже успел опуститься до недостаточного. В связи с этим в России проведут ревакцинацию. В Минздраве готовят соответствующую программу, которую обещают запустить уже на этой неделе. Прививку будут ставить даже беременным, написала «Лента».
Важно соблюдать санитарные требования. Обязательно надевайте маску (и желательно перчатки) в общественных местах, менять её следует не позже, чем через два часа. Регулярно мойте руки с мылом, если такой возможности нет, используйте антисептик или спиртовые гели.
Не касайтесь лица грязными руками, в общественных местах минимизируйте прикосновения к посторонним предметам и поверхностям. Рекомендуется избегать и рукопожатий.
Перед выходом из дома врачи советуют обрабатывать преддверие носа противовирусной мазью. А промывать нос мыльным раствором не рекомендуется, чтобы не пересушить слизистую. В этом случае вероятность заболеть COVID-19 возрастает.
При первых симптомах простуды лучше остаться дома, чтобы не заражать других, и вызвать врача.