что такое деформация желудка
Что надо знать об атрофическом гастрите?
Атрофический гастрит или более правильное медицинское название атрофия слизистой оболочки желудка – это необратимый процесс, при котором происходит гибель клеток слизистой желудка, вырабатывающих желудочных сок и соляную кислоту. К атрофии, также относится постепенное замещение клеток желудка соединительной тканью и клетками, сходными по строению с клетками слизистой оболочки кишечника.
Атрофия слизистой оболочки желудка – это опасное для здоровья состояние, так как с течением времени и, особенно, при наличии дополнительных факторов риска, она может привести к развитию рака желудка.
Причины атрофического гастрита

Хронический гастрит – это распространенное заболевание (выявляется до 30% населения в различных популяциях), имеющее хроническое и рецидивирующее течение, проявляющееся воспалением слизистой оболочки желудка и подтвержденное морфологическим исследованием.
Причинами развития хронического гастрита являются:
То есть, в большинстве случаев атрофия слизистой желудка является результатом наиболее часто встречающегося (80%) хронического гастрита, вызванного хеликобактерной инфекцией, или аутоиммунного гастрита, который встречается в 1-2% случаев. В данной статье подробно рассмотрена атрофия, связанная с этими двумя причинами.
Что происходит с клетками слизистой оболочки при атрофии?
Атрофия слизистой оболочки желудка затрагивает верхний слой и собственную пластинку желудка и является почти необратимым процессом, который можно замедлить, если устранить причины воспаления.
Слизистая желудка находится под действием агрессивной среды, поэтому ее клетки полностью обновляются каждые три дня. Воспалительный процесс, развивающийся вследствие влияния внешних факторов, например, бактериальная инфекция или внутренних причин, например, реакция иммунной системы, нарушает процесс обновления (регенерации) клеток слизистой желудка, в том числе и клеток желез желудка, вырабатывающих желудочный сок. В результате клетки желез желудка погибают и замещаются клетками соединительной ткани, а также клетками по строению схожими с клетками кишечника.
Этот процесс можно диагностировать с помощью гистологического исследования образцов слизистой желудка. Если выявлено только уменьшение количества клеток желудочных желез, то говорят только об атрофии слизистой оболочки желудка. Если же в исследуемом образце будут обнаружены клетки кишечника, то устанавливается диагноз атрофия с кишечной метаплазией. Метаплазия – это появление клеток, нетипичных для данного органа.
Как правильно диагностировать атрофию слизистой желудка?

Диагноз устанавливается врачом-морфологом после проведения гистологического исследования. На основании данного исследования подбирается лечение и определяется периодичность обследований для своевременного выявления онкологического процесса.
Также для оценки выраженности атрофии используется определение активности секреторной функции желудка по лабораторному анализу крови – Гастропанель (ссылка).
Диагностику хеликобактерной инфекции проводят с помощью исследования биоптатов и 13 С-уреазного дыхательного теста.
При аутоиммунном гастрите проводятся лабораторная диагностика анализа крови на определение антител к клеткам желудка и к внутреннему фактору Кастла.
Атрофический гастрит, связанный с хеликобактерной инфекцией
После инфицирования бактерией Helicobacter Pylory, в слизистой желудка развивается воспаление и хронический неатрофический гастрит. Железы желудка в начале заболевания вырабатывают достаточное количество желудочного сока. При отсутствии лечения, воспаление становится более активным и распространяется на все отделы желудка, приводя к атрофии слизистой) и частичному замещению клеток желудка кишечными клетками (кишечная метаплазия).
Симптомы

Лечение
Эрадикация (уничтожение) Helicobacter Pylory является первым этапом лечения при данном варианте атрофического гастрита.
Аутоиммунный атрофический гастрит
При данном типе хронического гастрита клетки желудка повреждаются антителами, которые вырабатывает собственная иммунная система. При этом развивается хроническое воспаление, приводящее к атрофии желез желудка и снижению выработки соляной кислоты и внутреннего фактора Кастла, обеспечивающего усвоение витамина B12. Значительное снижение выработки внутреннего фактора Кастла может вызывать анемию В12-дефицитную анемию (пернициозную анемию) – заболевание, для которого характерно нарушение кроветворения.
Симптомы
Симптомы аутоиммунного атрофического гастрита схожи с симптомами, атрофии, вызванной хеликобактерной инфекцией.
Дополнительно развивается анемия, часто аутоиммунному гастриту могут сопутствовать другие аутоиммунные заболевания.
Лечение
Специфического лечения при аутоиммунном гастрите нет, лечение кортикостероидами используется только в исключительных случаях.
Питание при атрофии слизистой
Специфической диеты при атрофическом гастрите не существует, питание должно быть регулярным, сбалансированным с учетом индивидуальной переносимости. Также рекомендуется сократить в рационе питания: грубую клетчатку, рафинированные сахара, избыток соли, насыщенные жиры, алкоголь, а также консерванты и стабилизаторы.
Прогноз и факторы риска при атрофическом гастрите
В зависимости от уменьшения количества желез в слизистой оболочке желудка выделяют три степени атрофии:
Наибольший риск рака желудка имеют пациенты с тяжелой атрофией, кишечной метаплазией, а в особенности с наличием дисплазии.
Дополнительными факторами риска рака желудка являются:
При наличии атрофии наиболее актуальным является профилактика рака желудка, для чего профессор Мехтиев, главный врач центра Эксперт рекомендует регулярное наблюдение у гастроэнтеролога, который следит за симптомами и определяет периодичность выполнения ФГДС (гастроскопии) с расширенной гистологией и Гастропанели.
Получить консультацию гастроэнтеролога, специализирующегося на ведении пациентов с атрофическим гастритом, можно в Гастроэнтерологическом центре Эксперт. ФГДС (гастроскопия) в ГЦ Эксперт выполняется опытными специалистами с помощью видеоэндоскопической системы, оснащенной технологией виртуальной хромоэндоскопии i-Scan, что повышает точность забора образцов слизистой для гистологического исследования.
Что такое деформация передней брюшной стенки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Маншетов В. В., пластического хирурга со стажем в 16 лет.
Определение болезни. Причины заболевания
Эстетическая деформация передней брюшной стенки — несоответствие мысленного образа формы живота настоящему его состоянию.
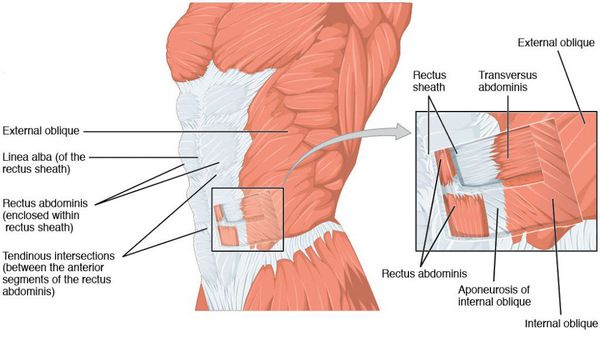
Идеальная форма живота у женщины представляется нам следующей. Втянутые боковые поверхности (фланки) туловища, которые переходят в паховые и пояснично-крестцовую области, подчеркивая талию. Боковые поверхности живота плавно переходят в желобки, идущие от реберных дуг до паховой связки по полулунной линии с двух сторон. Ниже пупочного кольца слегка выпуклая поверхность переходит в менее выпуклую поверхность выше пупочного кольца. Последняя по срединной линии от мечевидного отростка до пупочной области разделена не выраженным и сглаженным желобком.
Изменения передней брюшной стенки в норме происходят с течением возраста, на степень их выраженности влияет характер и режим питания, обмен веществ и гормональный фон (при беременности), индивидуальные особенности организма. Кроме того, к изменениям формы живота могут приводить травмы и заболевания. Все причины деформации брюшной стенки можно разделить на прямые и косвенные.
Косвенными причинами являются:
К прямым причинам деформации живота относят:
Классификация и стадии развития деформации передней брюшной стенки
Согласно классификации опущения тканей передней брюшной стенки (абдоминоптоз) в положении стоя по A. Matarasso различают следующие степени: [1]
I степень (минимальная) — растяжение кожи без формирования кожно-жировой складки;
II степень (средняя) — формирование небольшой кожно-жировой складки, которая четко свисает в позе «ныряльщика»;
III степень (умеренная) — кожно-жировой фартук в пределах фланков, свисающий в вертикальном положении, «pinch» менее 10 см;
IV степень (выраженная) — кожно-жировой фартук в пределах поясничной области, «pinch» более 10 см, сочетание с кожно-жировыми складками в подлопаточных областях.
Осложнения деформации передней брюшной стенки
Диастазом (расхождением) прямых мышц живота называют ослабление и расширение более 2 см белой линии, что приводит к увеличению расстояния между прямыми мышцами живота. Показанием к операции является расширение белой линии более 4 см. [2] Внешне диастаз мышц проявляется как продольное валикообразное выбухание по срединной линии в средних и верхних отделах живота при напряжении прямых мышц и увеличении внутрибрюшного давления.
Грыжа передней брюшной стенки — это хронически развивающийся дефект в мышечно-апоневротическом комплексе живота с выходом органов из брюшной полости без её разгерметизации. Выглядит грыжа в виде выпячивания на поверхности живота, при этом возможно чувство дискомфорта, боли в ее области при ходьбе, беге и других физических нагрузках. По происхождению грыжи бывают врожденные и приобретенные (первичные, послеоперационные, рецидивные). [3] Причинами грыжевой болезни и ослабления белой линии являются сочетание факторов, основным из которых является увеличение внутрибрюшного давления (физические нагрузки, частый кашель и хронический запор, беременность и др.). Ослабление структуры и защитной функции мышечно-апоневротического комплекса у больных с ожирением развиваются из-за снижения репаративных процессов, развития дистрофии мышечной ткани, разрыхления соединительной ткани (сахарный диабет, дисплазия соединительной ткани). [4]
Диагностика деформации передней брюшной стенки
В диагностике учитываются конституциональные, половые, возрастные, особенности брюшной стенки и внутренних органов живота. Оценивают конфигурацию живота при осмотре в выпрямленном положении стоя с поднятыми руками на плечи и фиксированным поворотом по часовой стрелке, а также в позе «ныряльщика» и лежа.
Пальпаторно оценивается тургор и эластичность кожи передней брюшной стенки. Состояние подкожной клетчатки оценивается пробой щипка «pinch», а также измерением объемов талии и бедер. Диагностировать диастаз прямых мышц живота удобно в положении пациента лежа. При этом необходимо попросить его приподнять верхний плечевой пояс и голову с опорой на локтевые суставы. Оценка слабых участков брюшной стенки позволяет выявить грыжевые дефекты. Более детально изучить состояние тканей возможно инструментальными методами обследования (УЗИ мягких тканей передней брюшной стенки и компьютерная томография).
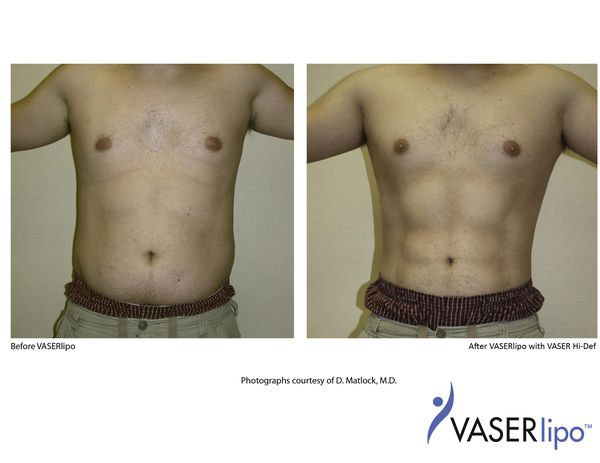
Лечение деформации передней брюшной стенки
Предоперационная разметка выполняется в день операции в вертикальном положении. С целью профилактики хирургической инфекции за 30 минут до операции вводятся антибиотики широкого спектра действия (цефалоспорины III поколения). Деформация передней брюшной стенки I-II степени (A. Matarasso), без изменений в мышечно-апоневротическом комплексе живота, позволяет корректировать объём подкожной клетчатки и придать желаемое очертание посредством липосакции. Липосакция — одно из популярных направлений в пластической хирургии, количество данных операций в мире увеличивается. Одним из наиболее современных методов липосакции является ультразвуковая, или VASER («Vibration Amplification of Sound Energy at Resonance») липосакция, явными преимуществами которой являются: эффект сокращения кожи после процедуры, возможность её гравировки (детальной проработки рельефа), более глубокая коррекция фигуры, сохранение высокой жизнеспособности жировых клеток для липофилинга, короткий восстановительный период. Суть технологии основана на фрагментации жировой ткани за счет кавитации тумесцентного раствора (метод тумесцентной липосакции был описан в 1985 г. Джеффри Кляйном и Патриком Лиллисом и основан на введении в область операции раствора Кляйна, состоящего из физиологического раствора, раствора адреналина и лидокаина).
Процедура VASER (липосакция) состоит из трех этапов: инфильтрация, эмульгирование жира и аспирация. На этих этапах используются специальные инструменты: канюли инфильтрации и аспирации, ультразвуковые зонды. Интраоперационно после инфильтрации жировые клетки обрабатываются энергией ультразвука в специальном режиме. За счет эффекта кавитации раствора высвобожденная энергия отделяет клетки жира от стромы и друг от друга, что способствует более легкой их аспирации и уменьшению агрессии процедуры на окружающие ткани. При этом мембрана самих адипоцитов во время фрагментации остается неповрежденной, что повышает их приживление после проведения липофилинга.
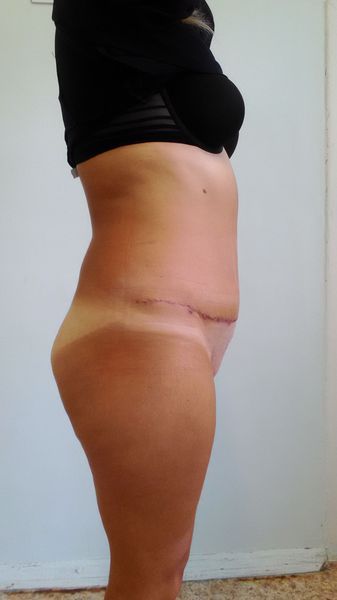
Пластика живота — одна из самых частых операций в эстетической и общей хирургии. Успех эстетической пластики передней брюшной стенки во многом зависит от грамотного выбора и соблюдения технологии выполнения операции. С учетом индивидуальной подвижности кожно-жирового слоя хирург размечает линию хирургического доступа, предполагаемые границы иссечения тканей, срединную линию. Хирургическое вмешательство проводится под наркозом и заключается в мобилизации подкожной клетчатки с кожей передней брюшной стенки, иссечении кожно-жирового фартука, восстановлении целостности живота.
Классическая абдоминопластика включает в себя коррекцию кожно-жирового лоскута с пересадкой или формированием искусственного эстетического пупка, работу на мышечно-апоневротическом слое. Для более выразительной коррекции линии талии, при абдоминоптозе III-IV степени (A. Matarasso), классическая абдоминопластика может быть дополнена липосакцией фланков и поясничной области. После операции длительность пребывание пациента в клинике определяется индивидуально, она обычно составляет от 3 до 5 суток. На 7-10 сутки после операции снимают послеоперационные швы. Полный курс реабилитации длится 2 месяца, при этом послеоперационное компрессионное белье необходимо носить постоянно 1 месяц, затем ежедневно по 12 часов в сутки. В этот период исключаются физические нагрузки.
Правильно выполненный эстетический послеоперационный шов обычно располагается в виде тонкой линии на уровне кожи внизу живота в поперечном направлении, это позволяет его непринужденно закрыть нижним бельем. Пупок — это естественного происхождения втянутый рубец, который расположен в области пупочного кольца. Искусственно сформированный пупок представляется нам в виде вертикально расположенного овальной формы, небольшого воронкообразного углубления передней брюшной стенки. Он должен находиться по срединной линии и равноудален между мечевидным отростком и лобком или на 3 см выше линии, соединяющей передние верхние ости тазовых костей. При этом малозаметным является расположенный внутри послеоперационный шов, который прикрепляет невысокий столбик пупка к его воронке.
Выявление грыжевых дефектов, диастаза прямых мышц живота предполагает их устранение во время операции. Наличие грыжи у пациентов с абдоминоптозом существенно увеличивают травматичность абдоминопластики необходимостью закрытия грыжевого дефекта брюшной стенки. Применение сетчатого протеза позволяет перераспределить и тем самым уменьшить нагрузку на слабые места передней брюшной стенки, что значительно уменьшает риск рецидива грыжи. В протезирующей герниопластике вентральных послеоперационных грыж выделяют технологии SUBLAY, ONLAY, INLAY. Окончательно выбор метода герниопластики определяется интраоперационно в зависимости от состояния тканей передней брюшной сотенки, размеров грыжевых ворот, степени натяжения тканей при сопоставлении краев грыжевого дефекта.
ONLAY технология подразумевает сшивание дефекта передней брюшной стенки край в край с расположением и фиксацией сетчатого протеза над апоневрозом.
SUBLAY технология заключается в размещении сетчатого протеза предбрюшинно или на задние листки влагалищ прямых мышц живота, после чего края апоневроза сшивают край в край над протезом.
INLAY метод — синтетический протез фиксируют к тканям, образующим грыжевые ворота, при этом сетка является продолжением тканей брюшной стенки. Важной особенностью данной методики является предотвращение контакта сетки с органами брюшной полости для предотвращения образования между ними спаечных сращений и кишечных свищей. Для этого используют ткани грыжевого мешка. Для протезирующей герниопластики более предпочтительной является технология SUBLAY. Этот метод исключает контакт сетчатого протеза с подкожной клетчаткой и органами брюшной полости, что, в свою очередь, снижает риск возникновения осложнений (серома, спаечные сращения с органами брюшной полости, кишечные свищи), сохраняет возможность адекватного устранения диастаза прямых мышц живота. [4]
Использование различных доступов, варианты размещения сетки и её фиксации требует не только подробных знаний классической и эндоскопической анатомии передней брюшной стенки, но и соответствующего технического оснащения операционной, высокой квалификации хирурга.
Прогноз. Профилактика
В раннем послеоперационном периоде со стороны послеоперационной раны передней брюшной стенки возможны варианты развития следующих осложнений: серома, гематома, нагноение, краевые некрозы кожи и подкожной клетчатки.
Серома — скопление свободной жидкости (экссудата) между тканями в послеоперационной ране. К причинам образования серомы относят: большую площадь отслойки подкожной клетчатки с повреждением кровеносных и лимфатических сосудов, отсутствие оттока экссудата, остаточное пространство и (или) смещение слоев раны при движении. При этом нарушение лабораторных показателей (гипокальциемия) сопровождаются более длительным серомообразованием. Скопление экссудата в ране ведет к разобщению прилежащих друг к другу раневых поверхностей и препятствует их срастанию, создает условия для развития гнойных осложнений. Профилактикой образования сером в послеоперационной ране является: адекватное дренирование большой послеоперационной раны, ношение компрессионного белья или бандажа, нормализация показателей гомеостаза.
Гематома. Диагностировать гематому послеоперационной раны помогают УЗИ мягких тканей передней брюшной стенки, пункция толстой иглой и аспирация её содержимого. При получении лизированной крови её удаляют с последующим УЗИ контролем. При возникшей гематоме проводят разведение краев раны, удаление свертков крови и дренирование раны. Назначают антибактериальные и противовоспалительные препараты, физиолечение. [4]
Нагноение, краевой некроз послеоперационной раны. Для профилактики инфекционных осложнений пациентам за 1 час до операции проводят антибиотикопрофилактику. Для улучшения микроциркуляции, уменьшения отека и стимуляции репаративных процессов со 2-х суток на область заживления проводится воздействие переменным магнитным полем низкой частоты. В течение 3-5 суток после операции все пациенты получают антибиотики широкого спектра действия. При нагноении послеоперационной раны, краевых некрозах кожи и подкожной клетчатки лечение проводится по принципам гнойной хирургии. [4]
С целью профилактики легочных осложнений после операции проводят дыхательную гимнастику, раннюю активизацию пациента, ингаляции. Профилактика ТЭЛА включает в себя переменную пневмокомпрессию во время операции, эластическую компрессию нижних конечностей и введение антикоагулянтов после операции до полной активизации пациента.
Предраковые заболевания желудка
Облигатный предрак — заболевания, на почве которых всегда или в большинстве случаев, если их не лечить, возникает рак. К таким заболеваниям относят каллезную язву желудка, ригидный антральный гастрит, полипы, полипоз желудка.
факультативный предрак — хронические заболевания желудка, при которых рак развивается относительно редко, но чаще, чем У здоровых людей. Это хронический атрофический гастрит, болезнь оперированного желудка, пернициозная анемия, болезнь Менетрие и др.
Национальный раковый конгресс в Японии трактует ряд заболеваний, на фоне которых может возникнуть рак желудка, как фоновые, объединяя в одну группу облигатный и факультативный предрак.
По данным Национального ракового конгресса, рак желудка может развиться на фоне хронического атрофического гастрита в 0-13% случаев, пернициозной анемии — в 0,5-12,3%, хронической язвы желудка — в 1-2%, гиперпластического полипа — в 1-2%, плоской аденомы — в 6-21%, папилловирусной аденомы — в 20-75%, болезни Менетрие — в 5-10%, резекции желудка в анамнезе — в 0,4-7,8% случаев.
С морфологической точки зрения мультицентрически расположенные участки пролиферации атипического эпителия называются дисплазией.
Дисплазия — это нарушение структуры ткани, характеризующееся патологической пролиферацией и атипией эпителия. В слизистой оболочке желудка дисплазия может быть трех степеней (легкая, умеренная и тяжелая).
При дисплазии I и II степени изменения слабо выражены и носят обратимый характер. Изменения же, относящиеся к дисплазии III степени, постоянны и могут рассматриваться как рак in situ. У 40-45% людей в возрасте старше 60 лет в слизистой оболочке желудка происходит перестройка эпителия по кишечному типу — кишечная метаплазия (тонкокишечная, толстокишечная). Толстокишечная метаплазия трактуется как предраковое состояние.
Хронический гастрит — самое распространенное заболевание среди патологии желудочно-кишечного тракта, которое составляет 35% всех болезней органов пищеварения и 85% болезней желудка.
Хронический гастрит — заболевание полиэтиологическое. Существует много причин, вызывающих его, однако в соответствии с этиопатогенезом их можно объединить в три основные группы:
•I группа — инфекционные (экзогенные), связанные с желудочным хеликобактером (гастрит В — бактериальный);
•II группа — эндогенные аутоиммунные, обусловленные образованием антител к обкладочным клеткам желез желудка (гастрит А — аутоиммунный) — атрофический гастрит;
•III группа — экзоэндогенные, связанные с частичными термическими раздражениями, медикаментозными воздействиями выражаются гастродуоденальным рефлюксом (гастрит С — реактивный или химический).
На фоне хронического атрофического гастрита в 0-13% случаев возникает рак желудка.
Клиника. В клинической картине хронического гастрита нет типичных характерных признаков, на основании которых можно было бы распознать те или иные его формы.
Основные жалобы: нарушение аппетита, неприятные ощущения в эпигастральной области, связанные с приемом пищи отрыжка, изжога, тошнота, иногда рвота.
Синдромы желудочной и кишечной диспепсии могут быть в самых различных сочетаниях (чувство переполнения желудка пищей, метеоризм, урчание в животе, тенезмы, запоры, сменяющиеся поносами).
Диагностика. Рентгенологический метод исследования в диагностике хронического гастрита играет относительную роль. Он больше пригоден для выявления язвенного, полипозного и опухолевого поражения желудка. Исключение составляет ригидный антральный гастрит. Решающее значение в распознавании различных форм хронического гастрита принадлежит гастрофиброскопии и гастробиопсии. Диагноз: кишечная метаплазия, дисплазия разной степени выраженности, инфекция, вызванная Helicobacter pylori (HP), — только цитологический и гистологический.
Лечение. К терапевтическим мероприятиям при хроническом гастрите неинфекционной этиологии относятся: устранение основных факторов, способствующих развитию заболевания или поддерживающих его, диетотерапия, седативные средства в период обострений, средства, улучшающие микроциркуляцию и трофику слизистой оболочки, витаминотерапия, санаторно-курортное лечение.
Особого отношения требует инфекционный гастрит, вызванный микроорганизмами Helicobacter pylori. На сегодняшний день учеными мира доказано, что 30-50% населения земного шара — носители HP-инфекции (больной человек или бактерионоситель). HP-бактерии обычно размножаются под слоем слизи над слизистой оболочкой привратника, прикрепляются к апикальной части клеток эпителия, выделяют энзимы — цитотоксины и уреазу, и в эпителии развиваются отек, гиперемия, нарушение трофики, дегенерация клеток слизистой оболочки. Процессы воспаления и атрофии тесно связаны между собой и имеют инфекционно-иммунное происхождение.
В последние 10 лет многих исследователей интересуют проблемы хеликобактериоза и рака желудка. На сегодняшний день доказано, что Helicobacter pylori вырабатывается множество патогенных ферментов и токсинов, некоторые из них могут быть вовлечены в канцерогенез.
•Показана взаимосвязь между наличием HP-инфекции и кишечной метаплазией, разновидность которой — неполная кишечная метаплазия — считается предраковым состоянием.
•Установлено, что HP с помощью энзима экстрацеллюлярной уреазы расщепляет мочевину с образованием аммиака, активизирует процессы перекисного окисления липидов, повышает концентрацию свободных радикалов — производных кислорода, что стимулирует процессы канцерогенеза.
•В экспериментах in vitro показана способность HP стимулировать рост культуры опухолевых клеток.
Рак желудка в большинстве случаев сопровождается инфицированием слизистой оболочки HP; при этом НР-инфекция имеет большую распространенность, чем при язвенной болезни, приобретает характер тотального обсеменения всех отделов желудка, в том числе и самой опухоли.
Хеликобактерный гастрит (гастрит В) требует особого лечения. Чтобы уничтожить эти бактерии, необходимо обязательное применение трех препаратов, обладающих антибактериальной активностью: амоксициллина или ампициллина, производного нитронидазола (метронидазола) и производного нитрофурина (фуразолидона). Базисный препарат — де-нол (соль лимонной кислоты с висмутом).
Язва желудка. Малигнизация рецидивирующих и каллезных язв желудка отмечается у 2-10% больных.
Клиника. В отличие от хронического гастрита хроническая язва желудка имеет довольно четкую клиническую картину.
Наиболее постоянный симптом язвенной болезни — боль, связанная с приемом пищи. Боли могут быть ранними, возникающими либо сразу после приема пищи, либо через 0,5-1 ч, и поздними, наступающими через 2-3 ч после приема пищи и позднее. Иногда боли возникают ночью и проходят после приема пищи (молока).
Для язвенной болезни желудка характерна также сезонность — обострения в осенне-зимние и весенние месяцы, ремиссии в летний период.
Важным симптомом заболевания является изжога; у большей половины больных бывает рвота, тошнота. В рвотных массах — кислая жидкость с примесью пищи. При рубцовых стенозах привратника рвота становится более частой, при этом рвотные массы обильны, с остатками пищи, съеденной накануне. Нередко отмечаются нарушения функции кишечника — запоры часто сменяются поносами.
Диагностика. В распознавании язвенной болезни желудка, кроме клинической семиотики, определенную роль играет исследование желудочного сока. У большинства больных имеет место повышение секреции и кислотообразования. Лишь при длительном течении заболевания, особенно при каллезных язвах, кислотность желудочного сока понижается. Важно также исследование кала на скрытую кровь.
При рентгенологическом исследовании желудка главным симптомом является ниша. Большая ниша с окружающим валом и конвергенцией складок слизистой оболочки указывает обычно на каллезный характер язвы. Отличить доброкачественную язву желудка от злокачественной помогает эндоскопическое, цитологическое исследование, а также множественная биопсия с разных участков язвы.
Лечение. Острые и рецидивирующие язвы в стадии обострения лечатся, как правило, консервативным путем. Обычно для заживления язвы требуется от 4 до 8 нед, а при больших или застарелых язвах — и более длительный промежуток времени. Эндоскопический или рентгеноскопический контроль проводится через 8 нед и до полного заживления. Если полное заживление не наступает, проводится повторная биопсия.
При осложнениях язвы (пенетрация, перфорация, рубцовый стеноз, повторяющиеся кровотечения), отсутствии эффекта от консервативной терапии, частом рецидивировании неосложненной пептической язвы, лишающем больного трудоспособности, подозрении на злокачественную язву желудка показано хирургическое лечение.
Полипы и полипоз желудка. Полипы бывают гиперпластическими и аденоматозными.
Гиперпластические изменения встречаются в 80-90% случаев всех полипозных образований в желудке и относятся к опухолеподобным поражениям. В 10-20% случаев возникают аденоматозные полипы — доброкачественные эпителиальные опухоли. Обычно они имеют вид выступающих в просвет желудка округлых образований, расположенных на тонкой ножке или широком основании.
К числу предраковых относят железистые аденоматозные полипы. Дисплазия разной степени выраженности в аденоматозных полипах отмечается в 40-60% случаев, а дисплазия III степени — в 5-10%. Если гиперпластические полипы перерождаются в рак в 1-2% случаев, то плоская аденома — в 6-21%, а папилловирусная аденома — в 20-75% случаев;
Клиника. Одиночные полипы могут протекать бессимптомно и быть случайной находкой. Клинически они проявляются, как правило, при сопутствующем хроническом гастрите. При распаде опухоли возможны кровотечения, при ущемлении полипа — приступ боли в эпигастрии, тошнота, рвота.
Диагностика. Ведущая роль в распознавании полипоза и полипов желудка принадлежит рентгенологическому и гастроскопическому методам.
Биопсия при эндоскопии позволяет дать цитологическую и морфологическую характеристику полипов.
Лечение. Аденоматозные полипы лечат хирургически. При одиночных полипах возможна эндоскопическая полипэктомия, при множественных — выполняется резекция желудка или гастрэктомия.
Оперированные больные находятся под диспансерным наблюдением. Не реже одного раза в 6 мес проводится эндоскопическое исследование, также периодически комплексное лечение, включающее рациональную диету, витаминотерапию, седативные средства, санаторно-курортное лечение.
Пернициозная анемия (болезнь Аддисона) может быть определена как отсутствие внутреннего фактора Касла, связанное с полной атрофией слизистой оболочки фундального отдела желудка и потерей париетальных клеток. Болезнь диагностируется, когда отмечается полная атрофия слизистой оболочки фундального отдела желудка, как правило, это бывает после 50 лет. На момент обнаружения болезни воспаление в слизистой оболочке отсутствует, т. е. патологический процесс представляет собой атрофию без гастрита.
Некоторые данные указывают на иммунологическую и наследственную основу пернициозной анемии, называемой также гастритом типа А.
При этой болезни в 90% случаев в организме присутствуют антитела к париетальным клеткам желудка; а в 60% случаев — антитела к внутреннему фактору Касла (как блокирующие, так и связывающие его). Анемия обычно развивается постепенно и незаметно, прогрессируя по мере истощения запасов витамина В в печени.
Рак желудка при пернициозной анемии встречается в 0,5-12,5% случаев.
Больные с пернициозной анемией обычно наблюдаются у терапевта и гематолога. Для больных старше 50 лет обязательно эндоскопическое исследование желудка 1 раз в год.
Болезнь Менетрие — поражение желудка неизвестной этиологии, проявляющееся очень большими желудочными складками, большими железами с незначительным их воспалением и кистозным расширением; при этом изредка затрагивается подслизистый слой; часто процесс ограничивается телом и дном желудка (антральный отдел обычно не поражается). Иногда ширина и высота складок достигает 3,5 см. Характерно повышенное слизеобразование, гипосекреция соляной кислоты и пепсина, Уменьшение содержания сывороточных белков, приводящее к появлению гипоальбумических отеков.
Клиника. Характерны боль в эпигастрии, потеря массы тела, тошнота.
Течение заболевания хроническое (ремиссии, обострения), иногда наступает спонтанное выздоровление либо переход в атрофический гастрит.
Болезнь Менетрие, как правило, встречается в возрасте 30-60 лет.
Диагностика. При рентгенологическом и эндоскопическом исследовании выявляются очень крупные складки, которые никогда не переходят на пилорический отдел (показана биопсия на всю толщину складки). В 5-10% случаев развивается рак желудка.
Лечение — консервативное; в случае тяжелой гипоальбуминемии может быть необходимой резекция желудка.
Атрофический гастрит резецированного желудка. Закономерным исходом резекции желудка является развитие хронического гастрита в культе, который сопровождается дисплазией и кишечной метаплазией эпителия вследствие снижения кислотности желудочного сока и заброса желчи в культю желудка.
Рак культи желудка возникает у 0,4-7,8% больных из числа оперированных по поводу неопухолевых заболеваний желудка через 10, 15, 20 лет после операции.
Пациенты с резецированным желудком нуждаются в постоянном диспансерном наблюдении на протяжении всей жизни. Один раз в год им должно выполняться гастроскопическое обследование культи желудка.